
OCHRONA ATMOSFERY
Dr hab. inż. Krzysztof GOSIEWSKI
Profesor AJD
Wprowadzenie w zagadnienia
ochrony atmosfery
- Homeostaza środowiska
naturalnego

Ochrona Atmosfery -
Wykład 1
RECYKLING
(Recycling)

Ochrona Atmosfery -
Wykład 1
Nie istnieją procesy całkowicie
odwracalne !!!
• ZASADY TERMODYNAMIKI
• I zasada - Zasada zachowania energii: zmiana
energii wewnętrznej układu równa jest różnicy ciepła
dostarczonego do układu i pracy wykonanej przez ten
układ. Jest to zasada najbardziej oczywista !
• II zasada - Ciepło nie może samorzutnie
przejść od ciała zimniejszego do cieplejszego
Istnieje entropia będąca funkcją stanu układu, stałą w
odwracalnych procesach adiabatycznych i rosnącą we
wszystkich innych. Clausius (1854)
• III zasada: - entropia układu o ustalonych
parametrach (np. o stałym ciśnieniu lub objętości) i
temperaturze zmierzającej do zera bezwzględnego
zmierza również do zera. Dla naszych rozważań zasada
mniej ważna!

Ochrona Atmosfery -
Wykład 1
Entropia ??????
-1
[J K ]
dQ
ds
T
Entropia molowa S
(odniesiona do mola substancji)
[J K
-1
mol
-1
]
0
S
D >
Wykazano, że w praktyce:
Czyli zawsze wystąpi pewne rozpraszanie energii !!!
0
S
Z drugiej zasady termodynamiki wynika:
Ochrona Atmosfery -
Wykład 1
1
ln
k
i
i
i
S
R
y
y
=
D
=-
�
�
Dla mieszanin chemicznych:
gdzie:
R - uniwersalna stała gazowa [J mol
-1
K
-1
]
y
i
- ułamek molowy składnika i [ -]
ujemn
e
dodatni
e
Ponieważ:
0 < y
i
< 1
Czyli zawsze wystąpi pewne rozpraszanie materii !!!
Wniosek:
W przyrodzie nie ma procesów całkowicie odwracalnych !!
CZYLI, INACZEJ:
ZAWSZE POJAWIĄ SIĘ STRATY ENERGII I ODPADY !!

Ochrona Atmosfery -
Wykład 1
Każdy pierwiastek zabrany
Ziemi, wodom, czy powietrzu,
prędzej czy później, po pewnej
ilości przemian powrócić może
już tylko jako bezużyteczny
odpad.
Potocznie procesami bezodpadowymi nazywamy te,
w których krążenie pierwiastków w przemianach
trwa wyjątkowo długo
i przy każdym cyklu ilość odpadu jest niewielka.
Ochrona Atmosfery -
Wykład 1
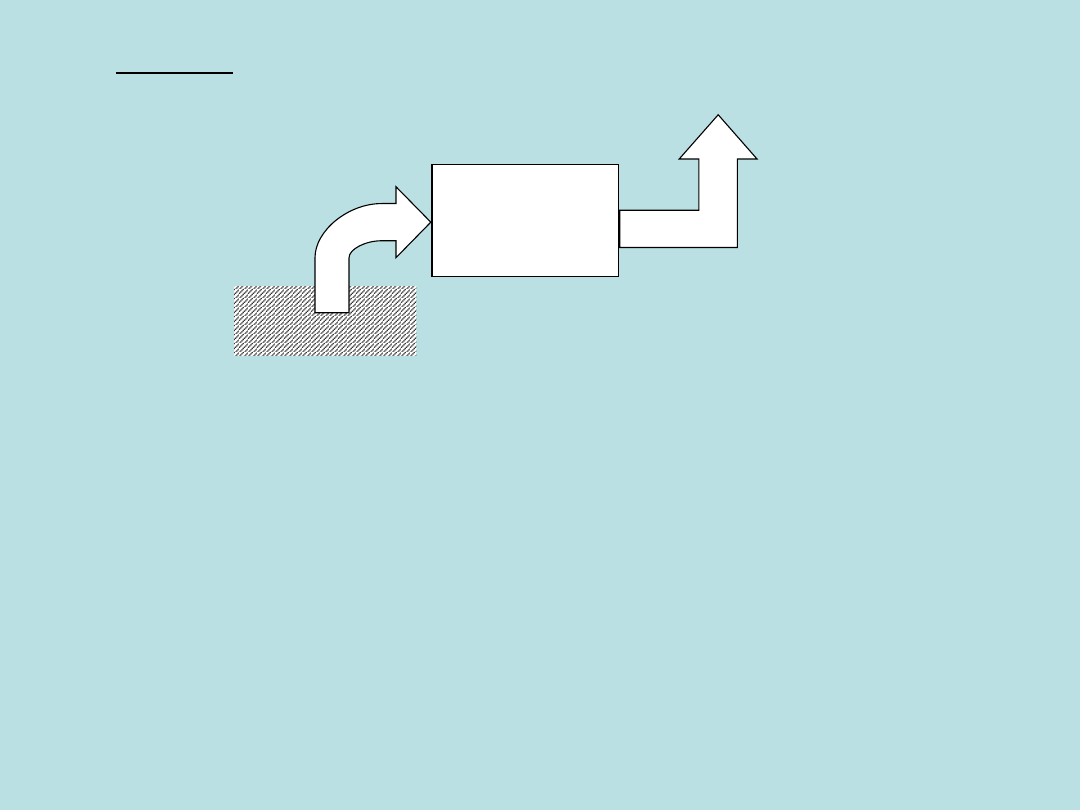
Ziemia
Paliwo kopalne
SPALANIE
CO
2
emitowane
do atmosfery
Przykład:
Spalanie paliw kopalnych
Dwutlenek węgla wyprodukowany podczas tego spalania
będzie się kumulował w atmosferze (praktycznie mamy tu
do czynienia z zerowym stopniem recyklingu).
Z H
2
O jest mniejszy problem, gdyż w końcu się wykropli
i spłynie do zbiorników wodnych (recykling).
Ochrona Atmosfery -
Wykład 1
CO
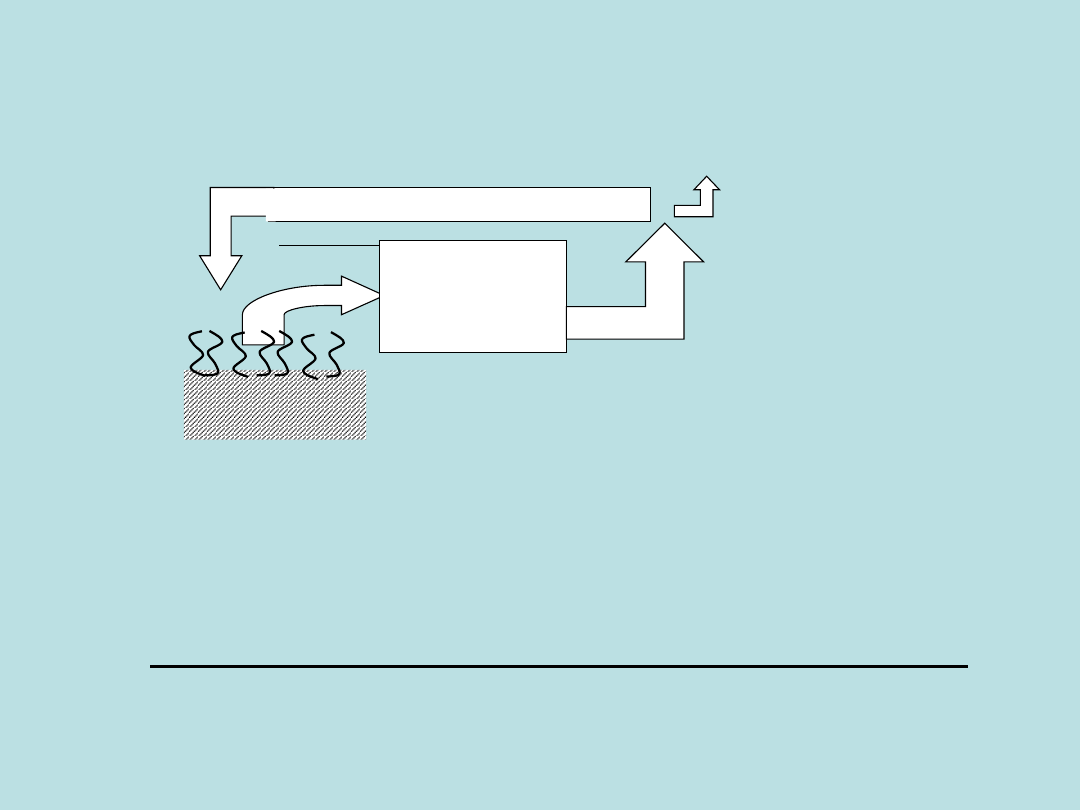
2
zużywane w procesach
fotosyntezy
Ziemia
Biopaliwo
SPALANIE
CO
2
emitowane
do atmosfery
Spalanie bio-
paliw
Z drugiej zasady termodynamiki wynika,
że aby zmniejszyć przyrost entropii
(tzn. zmniejszyć ilość odpadów)
musimy zawsze dostarczyć energii.
Ochrona Atmosfery -
Wykład 1
• proces syntezy prostych związków organicznych
(węglowodanów) z dwutlenku węgla i wody przebiegający
dzięki wykorzystaniu energii świetlnej pochłanianej przez
barwniki asymilacyjne (np. chlorofil).
• Ogólne równanie stechiometryczne procesów
spalania paliw organicznych:
• Pełne spalanie większości węglowodorów pochodzących z
przeróbki ropy naftowej przebiega wg następującej reakcji:
C
n
H
m
+ (n + m/4) O
2
n CO
2
+ m/2 H
2
O
• Pełne spalanie alkoholi i estrów powstałych na bazie
alkoholi i kwasów organicznych:
C
n
H
m
O
k
+ (n + m/4-k/2) O
2
n CO
2
+ m/2 H
2
O
• Fotosynteza jest więc procesem odwrotnym
do spalania !!!!
Fotosynteza

Ochrona Atmosfery -
Wykład 1
• Wg Encyklopedii Britannica:
lub :
Wg Encyklopedii Wiem 2004 :
Ogólne równania stechiometryczne
procesów fotosyntezy:
(
)
2
2
2
2
energia swietlna
chlorofil
CO
2 H O
O + H O
+
�������
�
+
2
CH O
(
)
2
2
2
2
energia swietlna
chlorofil
6 CO
12 H O
6 O
6H O
+
�������
�
+
+
6
12
6
C H O
(
)
2
2
2
energia swietlna
chlorofil
6 CO
6 H O
6 O
+
�������
�
+
6
12
6
C H O
UWAGA !!!!
W procesach spalania uzyskujemy energię
(cieplną) zaś w procesach fotosyntezy musimy
ją dostarczyć !

Ochrona Atmosfery -
Wykład 1
Źródłem energii dla
procesów fotosyntezy jest
energia słoneczna, nie ma
tu więc perpetuum mobile.
W PROCESACH TYCH
ZACHODZI JEDNAK ZAWSZE
PEWNE ROZPROSZENIE
ENERGII !!!
Ochrona Atmosfery -
Wykład 1
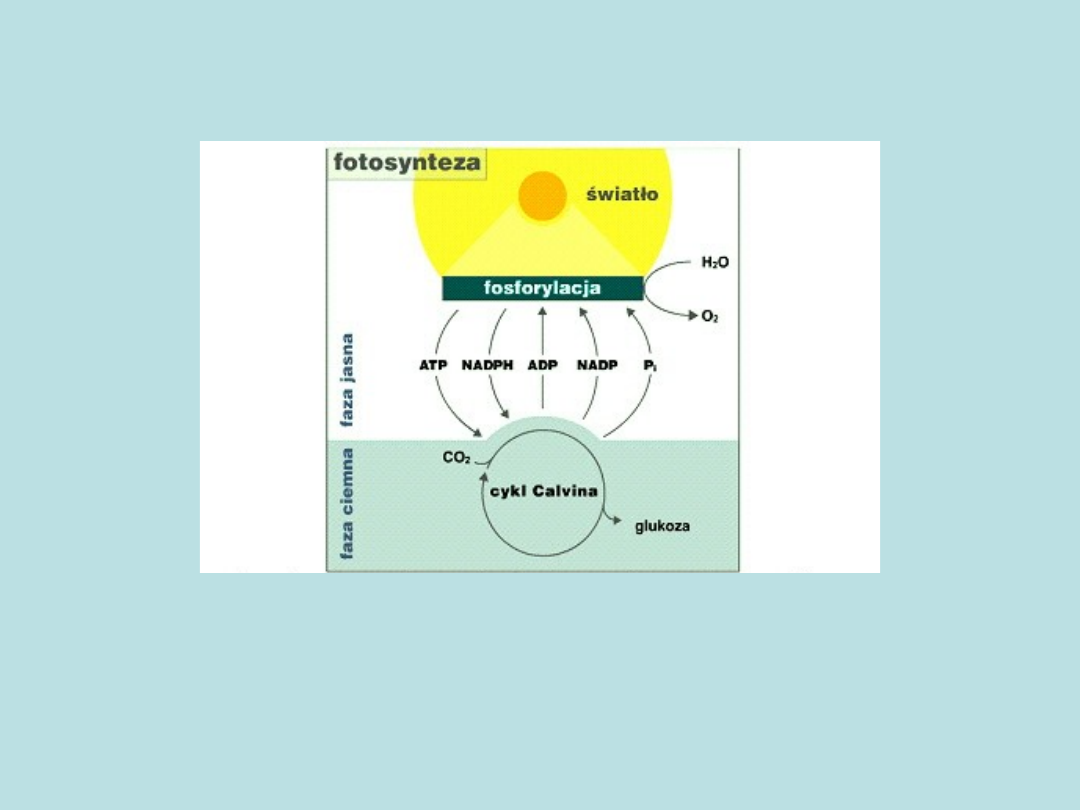
Fotosynteza - schemat
ogólny
• W przebiegu fotosyntezy wyróżnia się dwie fazy:
• fazę jasną (energia słoneczna pochłaniana jest
przez chlorofil - w wyniku fosforylacji
fotosyntetycznej powstaje ATP (ATP,
adenozynotrójfosforan), a u roślin wyższych w
tej fazie następuje redukcja NADP+
(Ortofosforan(V) dinukleotydu
nikotynoamidoadeninowego) i rozpad wody)
• fazę ciemną (wbudowanie CO
2
do związków
organicznych i powstanie glukozy (C
6
H
12
O
6
)-
proces ten zachodzi z wykorzystaniem energii
zgromadzonej w ATP)
• autor: Adam Świergul (Encyklopedia Wiem 2004)
Ochrona Atmosfery -
Wykład 1
Ochrona Atmosfery -
Wykład 1
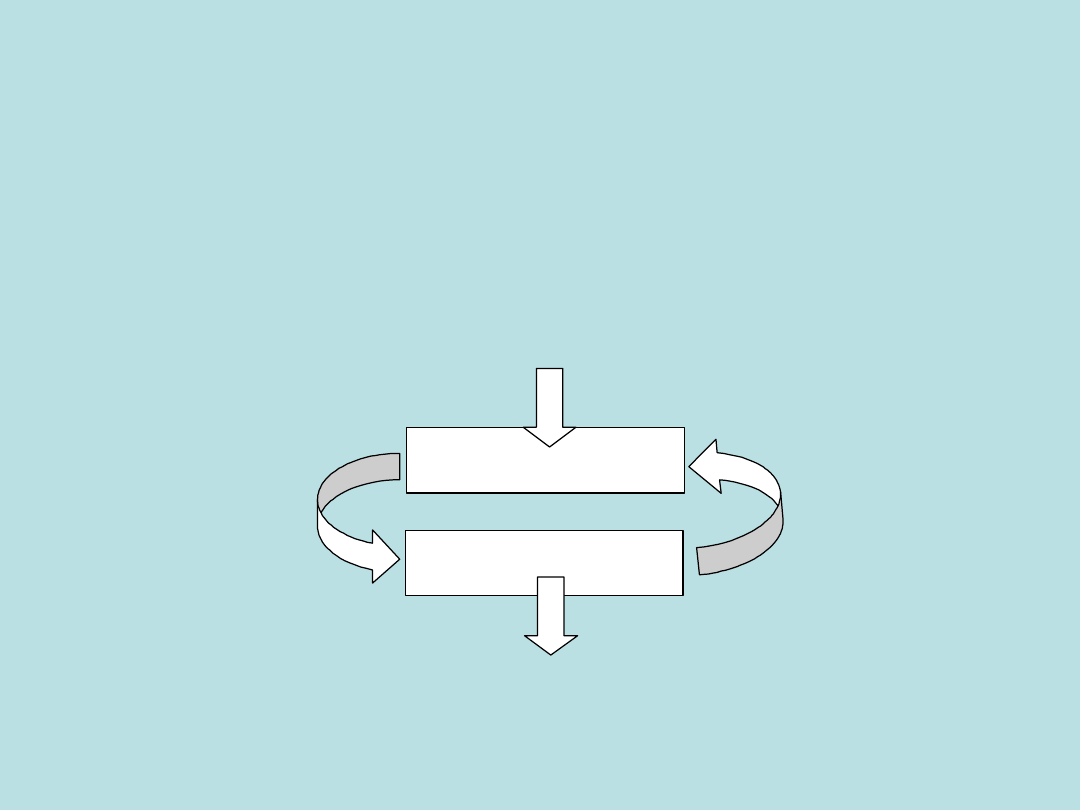
Ogólny schemat recyklingu zachodzącego w obiegu:
Spalanie węglowodorów – Fotosynteza
obrazuje poniższy ogólny schemat blokowy obiegu
związków chemicznych podczas recyklingu:
spalanie - fotosynteza
FOTOSYNTEZA
SPALANIE
Energia słoneczna
Energia cieplna
CO
2
+
H
2
O
paliwo
+
O
2

Ochrona Atmosfery -
Wykład 1
• ODPADY:
odpady przemysłowe
ODPADY KOMUNALNE
ODPADY NIEBEZPIECZNE
(np. szpitalne)
• odpady stałe
• odpady ciekłe (tzw. ścieki)
• odpady gazowe
Klasyfikcja
odpadów:
Ochrona Atmosfery -
Wykład 1
Emisja i imisja
• Emisja kilkadziesiąt ppm do kilku %
• Imisja [ppb] lub kilka [ppm]
(maksymalnie do kilkunastu [ppm])
Pomiar imisji
pozwala tylko
monitorować
zagrożenia
Emisja
kilkadziesiąt ppm do
kilku %
Imisja
[ppb]
lub kilka [ppm]
(maksymalnie do
kilkunastu [ppm])
K
om
in
Pomiar emisji
pozwala karać
trucicieli

Ochrona Atmosfery -
Wykład 1
• [
ppm
] PARTS PER MILLION
(CZĘŚCI NA MILION)
• [
ppb
] PARTS PER BILLION
(CZĘŚCI NA MILIARD)
• JEDNOSTKI [
ppm
] ORAZ [
ppb
]
DEFINIUJE SIĘ OBJĘTOŚCIOWO
(np.. [
ppm vol.
] ) LUB WAGOWO
([
ppm wt
] ).

Ochrona Atmosfery -
Wykład 1
Homeostaza TO: NATURALNA
TENDENCJA UKŁADÓW
BIOLOGICZNYCH (NP.
EKOSYSTEMÓW) DO
OPIERANIA SIĘ ZMIANOM
ŚRODOWISKA
I TRWANIA W STANIE
RÓWNOWAGI.
DESZCZ WYMYWAJĄCY PYŁY
Z POWIETRZA ATMOSFERYCZNEGO
JEST NP. ELEMENTEM HOMEOSTAZY
.

Ochrona Atmosfery -
Wykład 1
W ATMOSFERZE MECHANIZMY
HOMEOSTAZY ZAPEWNIA
OCZYSZCZANIE NA ZASADZIE REAKCJI
FOTOCHEMICZNYCH.
A + hv
A*
gdzie:
A
-
cząstka niewzbudzona
A* -
cząstka wzbudzona
hv
-
absorbowana energia
promieniowania
• fluorescencja: A*
A + hv
• dezaktywacja zderzeniowa:
A* + M
A+ M*
Ochrona Atmosfery -
Wykład 1
• dysocjacja:
A*
B + C
• bezpośrednia reakcja:
A* + B
C + ....
Ochrona Atmosfery -
Wykład 1
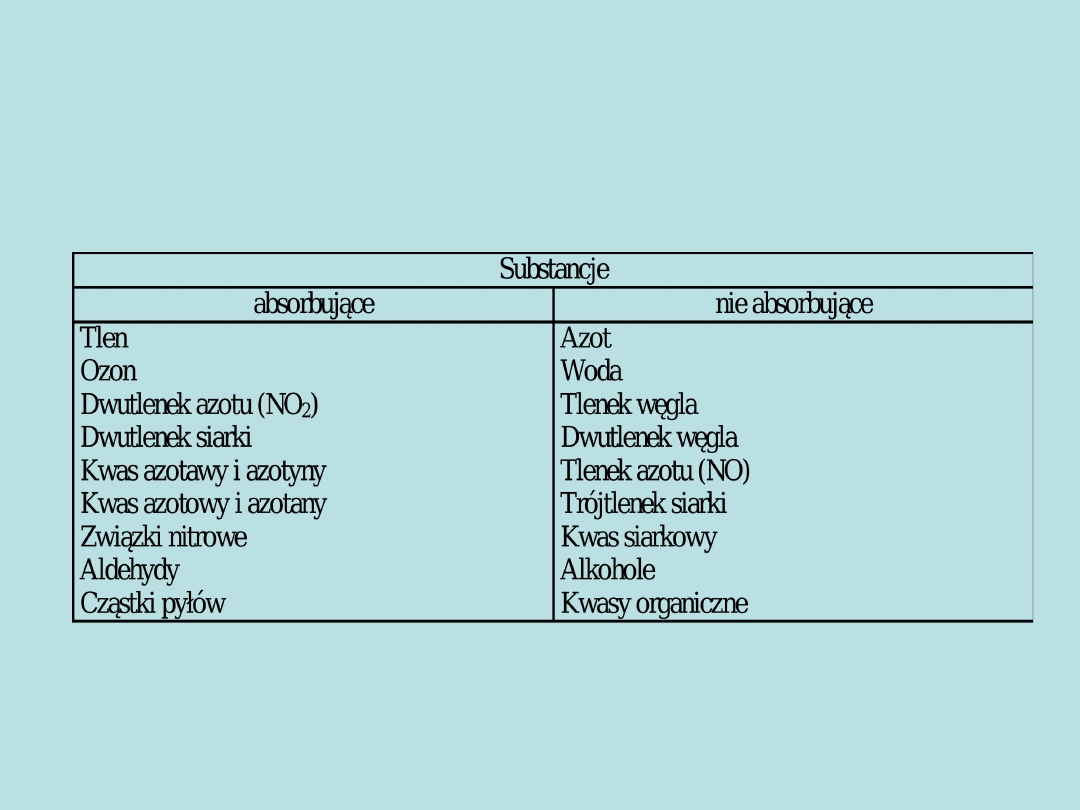
Substancje absorbujące i nie
absorbujące w zakresie
promieniowania 300-700 [nm]

Ochrona Atmosfery -
Wykład 1
Przykład: Reakcja utleniania SO
2
do SO
2
• Globalnie:
• Szczegółowo:
2
2
3
2SO +O
2SO
hv
*
2
2
300nm
SO
SO
hv
*
2
2
3
SO +SO
SO +SO
*
2
2
3
SO + O
SO + O
2
3
SO
O
SO
2
3
O
O
O
2
3
SO
O
SO
Ochrona Atmosfery -
Wykład 1
Ochrona Atmosfery -
Wykład 1

Ochrona Atmosfery -
Wykład 1
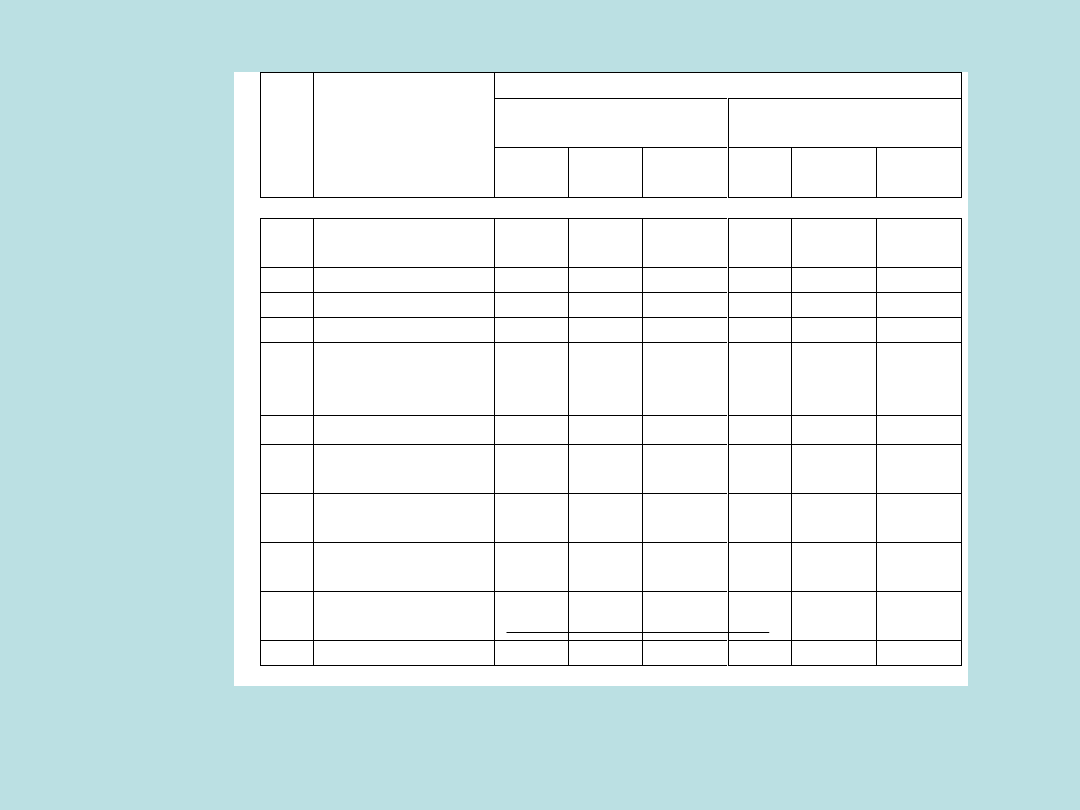
Dopuszczalne stężenia wybranych substancji zanieczyszczających powietrze.
Dz. U. Nr. 15 z 1990r. z późniejszymi poprawkami.
Dopuszczalne stężenie zanieczyszczeń μg/m³
Obszary
Obszary specjalnie
chronione
Lp. Nazwa substancji
30 min 24 h
Śred.
Roczne
30
min.
24 h
Śred.
Roczne
1 Arsen
(w
pyle
zaw.)
–
0,05
0,01
–
0,05
0,01
2 Azbest
włókien/m³
(w pyle zaw.)
–
1000,0
–
–
1000,0
–
3 Azotu dwutlenek
500,0 150,0
50,0
150,0
50,0
30,0
4 Benzo/a/piren
[ng/m
3
]
-
5,0
1,0
-
5,0
1,0
5 Chlor
100,0
30,0
4,3
30,0
10,0
1,6
6 Chrom (+6)
–
2,0
0,4
–
0,5
0,08
7 Fluor (suma fluoru i
fluorków)
30,0
10,0
1,6
10,0
3,0
0,4
8 Kadm (i jego zw.)
(w pyle zaw.)
–
0,22
0,01
–
0,2
0,001
9 Kwas siarkowy
200,0 100,0
16,0
100,0
50,0
7,9
Ochrona Atmosfery -
Wykład 1
Dopuszczalne stężenie zanieczyszczeń μg/m³
Obszary
Obszary specjalnie
chronione
Lp. Nazwa substancji
30 min 24 h
Śred.
Roczne
30
min.
24 h
Śred.
Roczne
10 Miedź (w pyle zaw.
jako zw. Cu)
20,0
5,0
0,6
6,0
2,0
0,3
11 Ołów (całkowity)
–
1,0
0,2
–
0,5
0,1
12 Pył zawieszony
–
120,0
50,0
–
60,0
20,0
13 Rtęć (całkowita)
–
0,3
0,04
–
0,1
0,02
14 Siarki dwutlenek
do roku 1998
od roku 1999
600,0
440,0
200,0
150,0
32,0
32,0
250,0
150,0
75,0
75,0
11,0
11,0
15 Siarkowodór
30,0
5,0
1,0
4,0
1,0
0,5
16 Tlenek węgla
5000,0 1000,0 120,0 3000,
0
500,0
61,0
17 Wanad (w pyle
zaw.)
–
1,0
0,25
–
0,1
0,0005
18 Mangan (w pyle
zaw.)
–
4,0
1,0
–
2,0
0,5
19 Nikiel (w pyle
zaw.)
–
100,0
25,0
–
100,0
25,0
20 Węgiel elementarny 150,0
50,0
8,0
50,0
20,0
4,0
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
Wykład 5 OCHRONA ATMOSFERY
Wykład 6 OCHRONA ATMOSFERY
Wykład 2 OCHRONA ATMOSFERY
Wykład 9 OCHRONA ATMOSFERY
Wykład 4 OCHRONA ATMOSFERY
Wykład 3 OCHRONA ATMOSFERY
Wykład 8 OCHRONA ATMOSFERY
Wykład 7 OCHRONA ATMOSFERY
Wykład 14 OCHRONA ATMOSFERY
Wykład 10 OCHRONA ATMOSFERY
Wykład 13 OCHRONA ATMOSFERY
Wykład 12 OCHRONA ATMOSFERY
Wykład 11 OCHRONA ATMOSFERY
ochrona atmosfery zadania
technologie bioenergetyczne wykłady, Ochrona Środowiska, Technologie bioenergetyczne
Wyklad 6, ochrona środowiska
Kopia Rybactwo - wyklady, Ochrona środowiska, semestr 2
Chemizacja srodkow zywienia - wyklady, Ochrona środowiska, semestr 2
więcej podobnych podstron