
MIEJSCE ALLOSTERYCZNE - BUDOWA,
FUNKCJA, ZNACZENIE W REGULACJI
AKTYWNOŚCI NA PODSTAWIE WYKRESÓW.
Angelika Dudek Gr.
5B
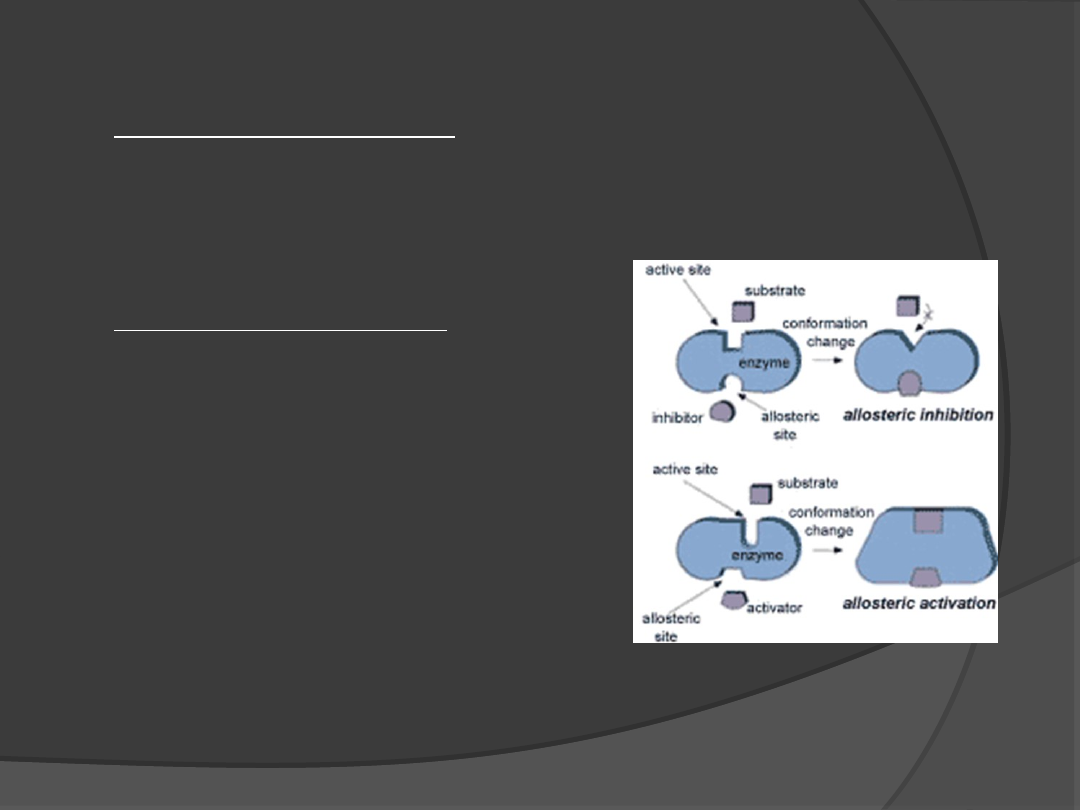
Miejsce allosteryczne- to specyficzne miejsce na
podjednostce regulatorowej enzymu
oligomerycznego, do którego przyłącza się efektor,
modyfikujący konformację i aktywność enzymu.
Przyłączenie efektora:
-hamowanie aktywności katalitycznej
enzymu
- zwiększenie aktywności enzymatycznej
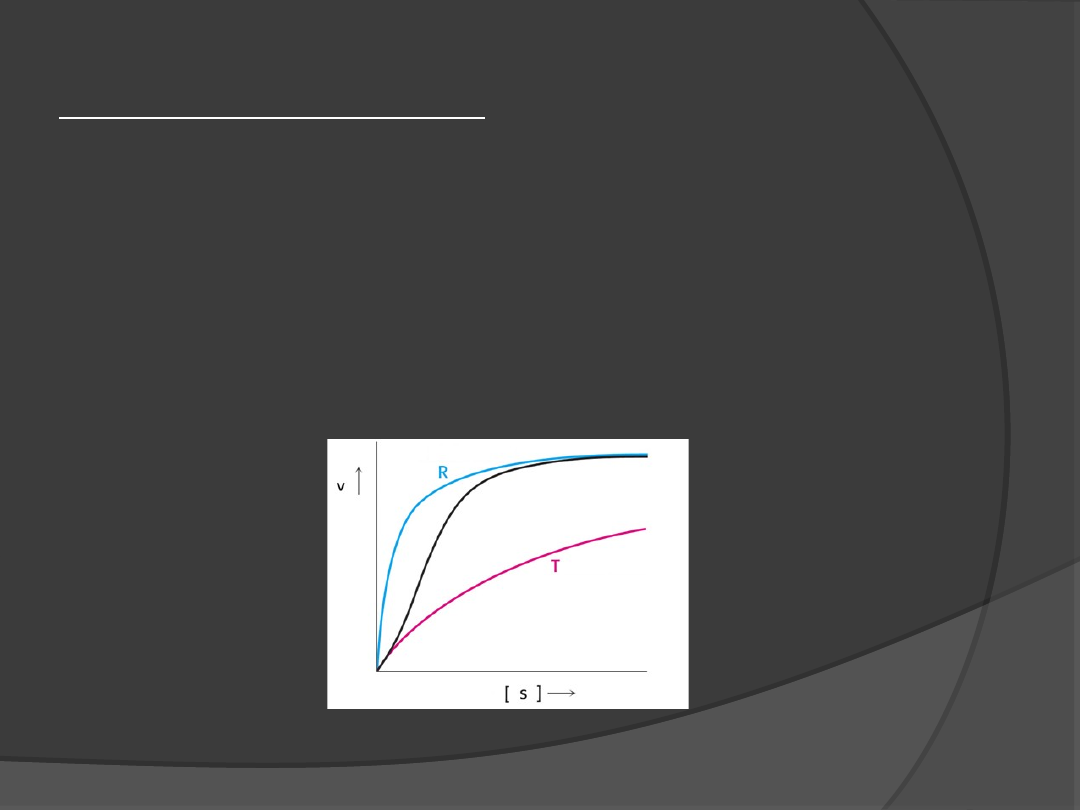
Regulacja allosteryczna
Enzymy allosteryczne wykazują kinetykę
sigmoidalną, dzieje się tak dlatego, że dzięki
kooperatywności wiązania cząsteczek substratu-
jedno miejsce aktywne enzymu może oddziaływać na
inne miejsca aktywne tej samej
cząsteczki enzymu.
Regulatory allosteryczne
modulują stan równowagi
pomiędzy formami R i T
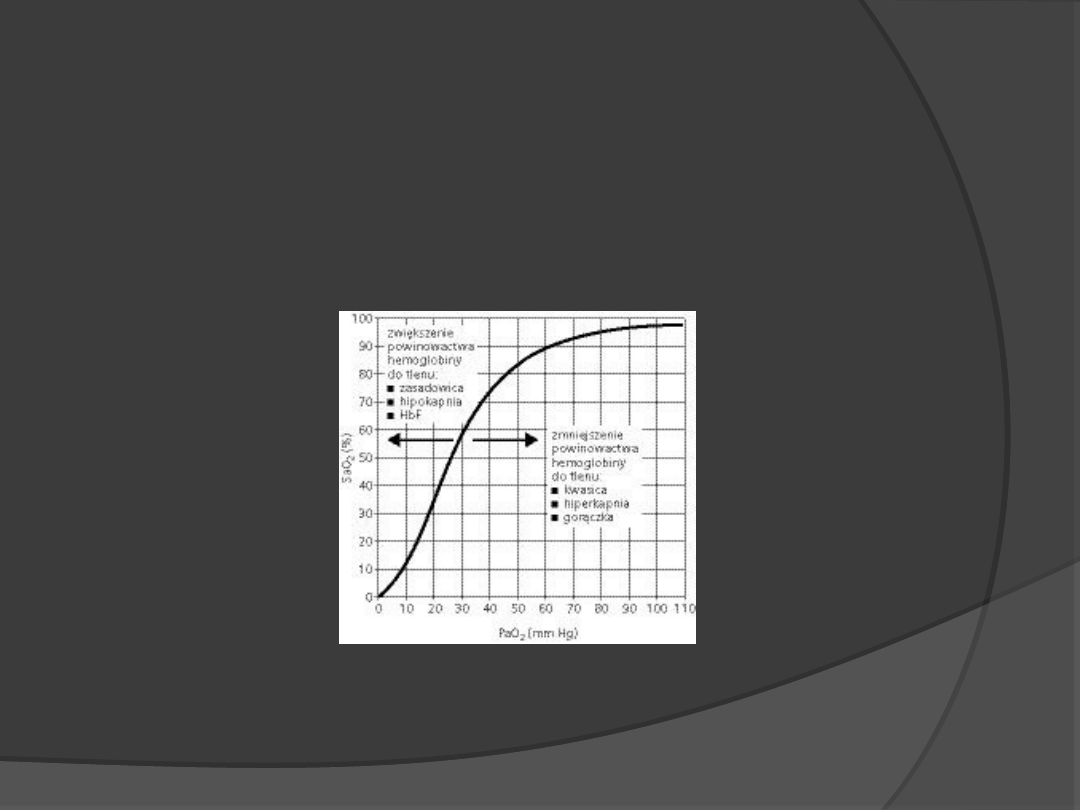
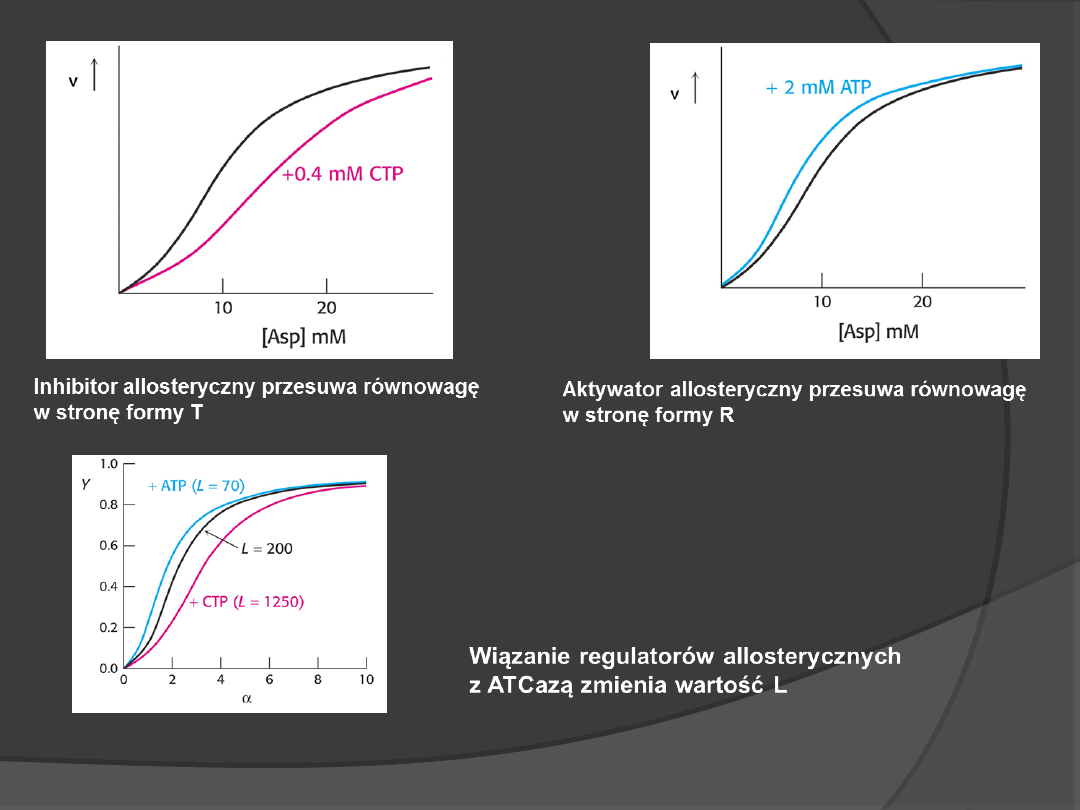
Aktywność enzymów allosterycznych może być regulowana
cząsteczkami, które wiążą się w innym miejscu niż miejsca
katalityczne, podobnie jak wodór czy dwutlenek węgla wpływają
na wiązanie tlenu przez hemoglobinę.
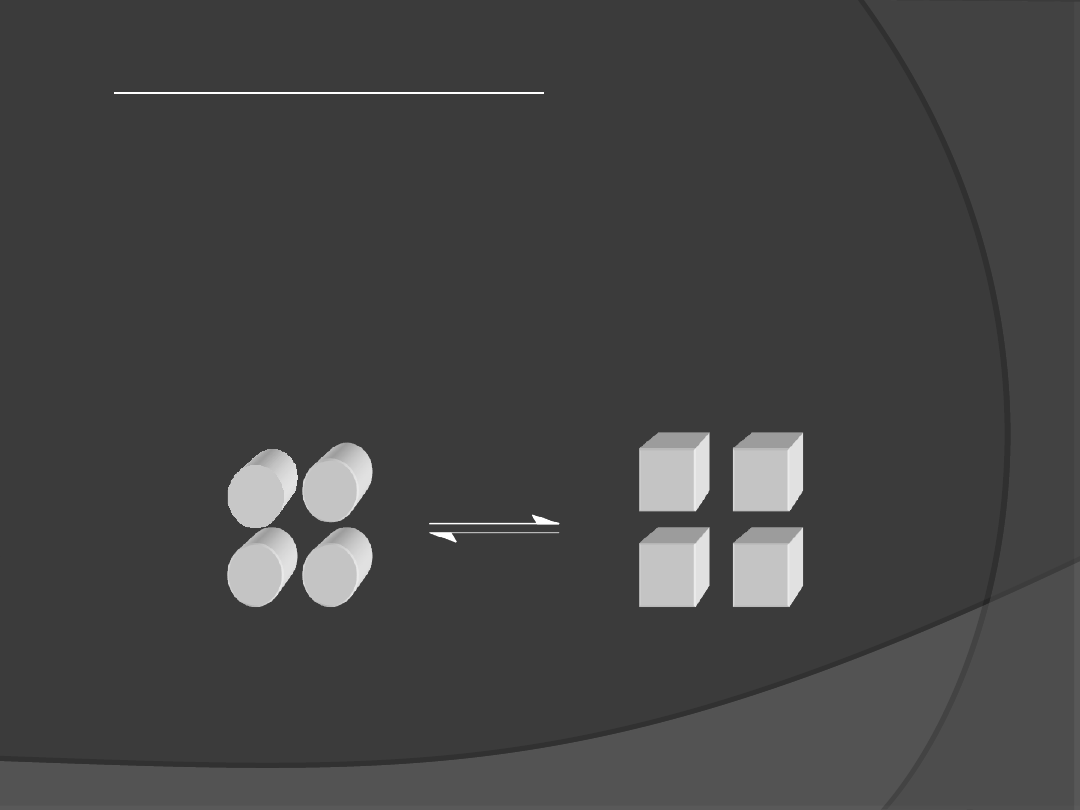
Model jednoprzejściowy
Gdy enzym składa się z 2 podjednostek formy R i T mogą
przechodzić w siebie wzajemnie jednak wszystkie
podjednostki muszą występować w tej samej konformacji
tak aby została zachowana symetria cząsteczki enzymu.
Dozwolonymi konformacjami są RR i TT. Forma RT jest
niedozwolona.
Efekt oddziaływań jest homotropowy lub heterotropowy.
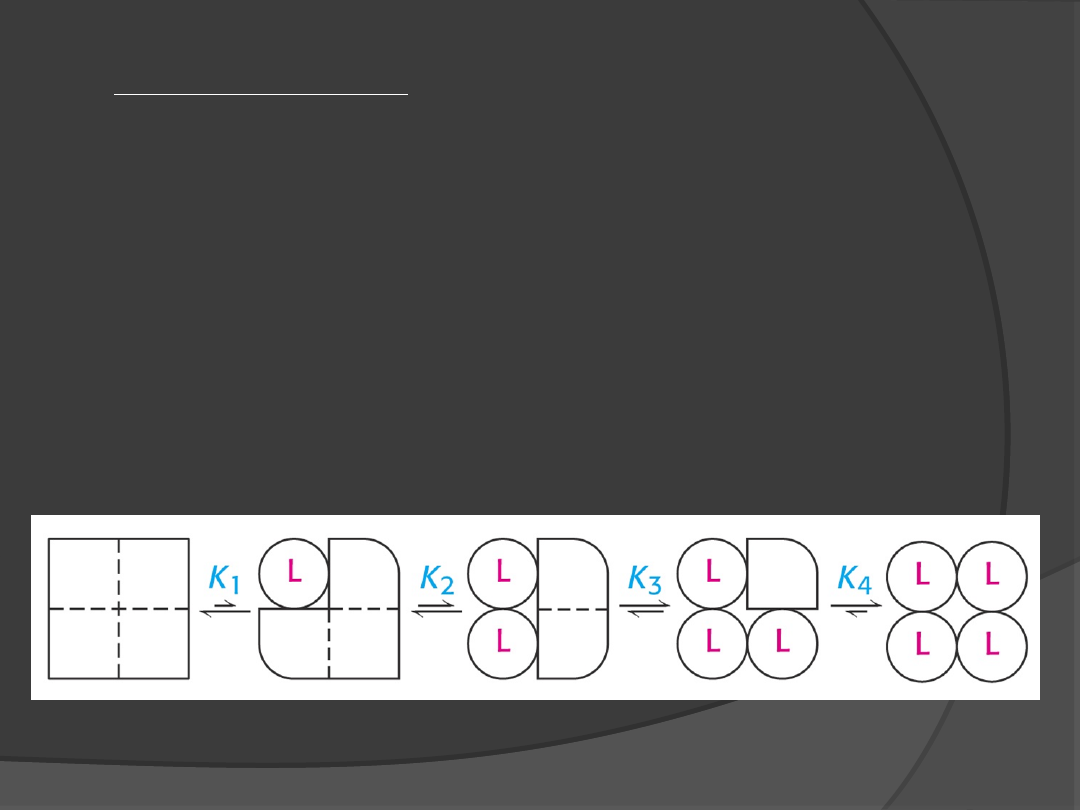
Model sekwencyjny
Każda z podjednostek enzymu występuje w jednej z
form konformacyjnych R lub T. Związanie efektora
allosterycznego powoduje zmianę konformacji
podjednostki jednak nie ma wpływu na konformację
drugiej jednostki. Zmiana konformacji podjednostki
powoduje zwiększenie powinowactwa do substratu
innych podjednostek tej samej cząsteczki enzymu.
Wiązanie jest kooperatywne tylko wtedy gdy
powinowactwo RT do substratu jest większe niż
powinowactwo TT.

Co powodują zmiany konformacyjne miejsca katalicznego pod
wpływem efektora allosterycznego?
Wpływ na:
Sprawność katalityczna substratu :
Enzymy serii V-efekt allosteryczny zmieniają wartość Vmax
bez wpływu na Km czego pierwotnym skutkiem jest zmiana
orientacji przestrzennej lub ładunku reszt katalitycznych
prowadzących do zmniejszenia Vmax
Powinowactwo enzymu do substratu:
Enzymy serii K zmieniają Km nie Vmax czego skutkiem są
zmiany konformacyjne i osłabienie wiązań między substratem
i resztami aminokwasowymi w miejscu wiążącym substrat
Obie właściwości.

Dziękuję.
Document Outline
Wyszukiwarka
Podobne podstrony:
Budowa, wystepowanie i znaczenie biologiczne disacharydow
układ pokarmowy budowa i funkcja
BUDOWA I FUNKCJA UKŁADU NERWOWEGO, weterynaria, Anatomia
Budowa i Funkcje Układu Nerwowego
Budowa i funkcje komorek bakteryjnych (opracowanie)
budowa funkcje krwi
Budowa i funkcje skóry
2 budowa i funkcje skóry
UkÄaâad oddechowy czÄaâowieka ââZâs budowa, funkcje, choroby
177Tarczyca budowa i funkcje
Budowa i funkcja genomu ludzkiego 02
budowa i funkcje ukladu moczowego
Budowa i funkcje narządów mowy
Budowa i funkcje układu odpornościowego człowieka, Szkoła, przydatne w szkole
wydruk, JĄDRO, JĄDRO - budowa i funkcje
Budowa i funkcje serca, Szkoła, przydatne w szkole
Związek między budową a funkcją organelli komórkowych, podręczniki szkoła średnia liceum technikum k
Budowa i Funkcje Tkanek Zwierzęcych
1 Budowa i funkcja ukladu odpornosciowego
więcej podobnych podstron