
Budowa miejsca aktywnego
i modele powstawania
kompleksu enzym-substrat.
Tomasz Fijałkowski

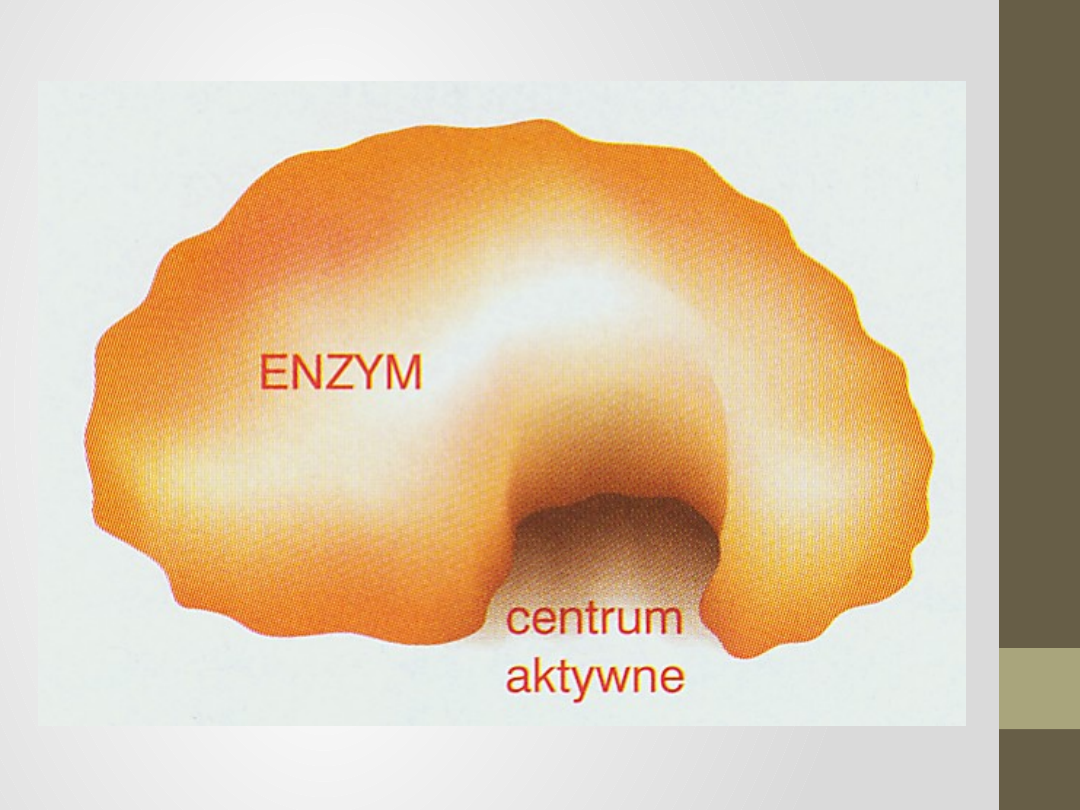
Miejsce aktywne
•
obszar, który wiąże substrat (i kofaktor, jeśli taki
występuje), tworząc stan przejściowy,
•
zajmuje stosunkowo małą część całkowitej
objętości cząsteczki enzymu,
•
miejsca aktywne są trójwymiarowymi
zagłębieniami lub szczelinami, niedostępnych
zazwyczaj dla cząsteczek wody (jeśli nie bierze
ona udziału w reakcji):
•
enzymy składające się z jednej podjednostki -> miejsce
aktywne w bruździe, np. lizozym (rozpuszcza ściany
komórkowe wielu bakterii Gram-dodatnich),
•
enzymy multimeryczne -> miejsca aktywne przy
powierzchniach między podjednostkami, np. HMG-CoA
(ogranicza szybkośc biosyntezy cholesterolu).

•
niepolarny charakter znacznej części szczeliny
sprzyja wiązaniu substratu i katalitycznemu
przebiegowi reakcji,
•
reszty polarne uzyskują specjalne właściwości
istotne dla wiązania substratu i katalizy (ich
wewnętrzne umiejscowienie jest wyjątkiem od
reguły (zwykle grupy polarne na zewnątrz w
środowisku wodnym)),
•
zawiera reszty aminokwasowe (zwane grupami
katalitycznymi), które biorą bezpośredni udział w
tworzeniu i zrywaniu wiązań,
•
miejsce aktywne utworzone jest przez łańcuchy
boczne reszt aminokwasowych pochodzących z
różnych, zazwyczaj odległych części sekwencji
aminokwasowej, np. w lizozymie, miejsce aktywne
złożone jest z reszt numerowanych jako 35, 52,
62, 63, 101 i 108 w sekwencji 129 aminokwasów.

•
w tworzeniu miejsca aktywnego uczestniczą
przede wszystkim te reszty aminokwasowe, które
w łańcuchach bocznych mają grupy mogą być
donorami lub akceptorami protonów :
•
beta-karboksylowe asparaginianu,
•
gamma karboksylowe glutaminianu,
•
e-aminowe lizyny,
•
atomy azotu w pierścieniu imidazolowym histydyny,
•
grupy OH seryny, treoniny i tyrozyny,
•
grupy SH cysteiny.

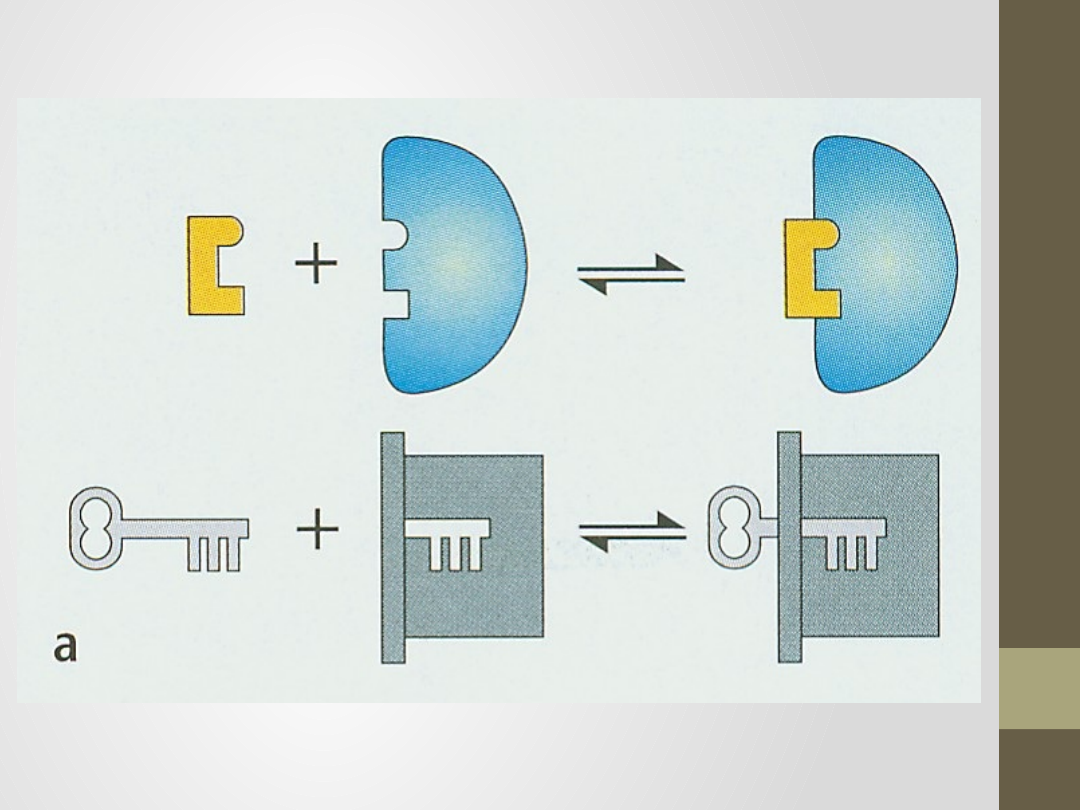
Teoria Emila Fischera z
1890r.
•
substrat pasuje do miejsca aktywnego enzymu jak
klucz do zamka,
•
sztywny model matrycowy,
•
enzym i substrat oddziaływują poprzez siły o
niewielkim zasięgu, substrat musi mieć
odpowiedni kształt, by mógł pasować do miejsca
aktywnego,
•
możliwe jest połączenie tylko odpowiedniego
enzymu z przynależnym mu substratem.

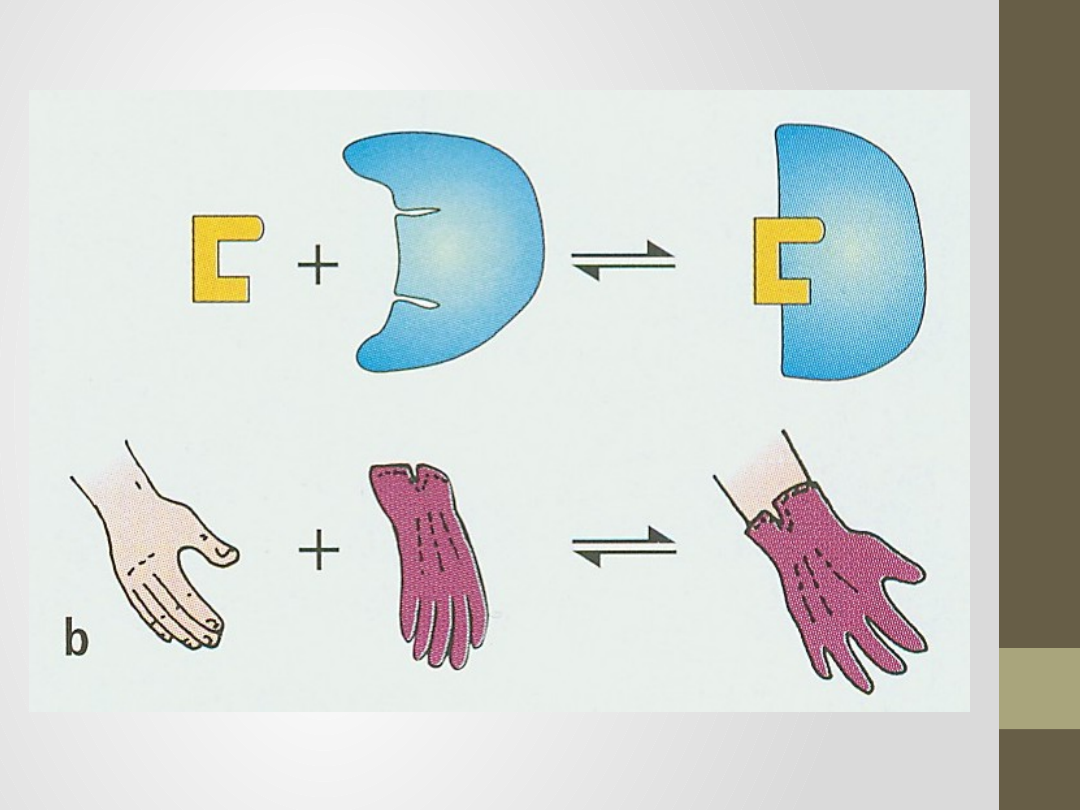
Teoria Koshlanda z 1958r.
•
substrat pasuje do miejsca aktywnego enzymu jak
ręka do rękawiczki,
•
model indukowanego (wymuszonego)
dopasowania,
•
kształt miejsc aktywnych może być znacznie
zmodyfikowany przez wiązanie substratu,
•
substrat wymusza zmianę konformacyjną miejsca
aktywnego, łącząc się z nim komplementarnie,
•
w niektórych przypadkach kształt miejsca
aktywnego pojawia się dopiero po związaniu
substratu.
Document Outline
- Slide 1
- Miejsce aktywne
- Slide 3
- Slide 4
- Slide 5
- Teoria Emila Fischera z 1890r.
- Slide 7
- Teoria Koshlanda z 1958r.
- Slide 9
Wyszukiwarka
Podobne podstrony:
Kompleks enzym substrat
,SOCJOLOGIA MIAST, OD TWORZENIA MIEJSC AKTYWNYCH DLA WSPÓLNOT PRZEZ MEBLOWANIE PRZESTRZENI
05 Budowa centrum aktywnego
Miejsce aktywności fizycznej w programie rehabilitacji kardiologicznej
56+55 budowa czesci plemnika fazy powstawania
zaświadczenia o przeznaczeniu terenu (działki) w miejscowym planie zagospoda, Budowa domu, UM
Biotechnologia Šw 4 AktywnoŠ enzymˇw 12 dla studentˇw
BUDOWA PEDAGOGIKI I JEJ MIEJSCE W SYSTEMIE NAUK
@PSI W08 Modele stanów i aktywności
Opracowane Zagadnienia z Dydaktyki Języka Polskiego, Modele lekcji językowych, Budowa lekcji nauki o
Budowa atomu i związki kompleksowe
Ewidencja kosztów w układzie rodzajowym oraz według miejsc powstawania
wniosek o wyrys z planu miejscowego, --Budowa wnioski
Glikoglicerolipidy (budowa, występowanie oraz aktywność farmakologiczna)
Powstanie i budowa wszechświata i Układu Słonecznego
Modele i obliczenia mechanizmów wciągarki, AGH WIMIR Mechanika i Budowa Maszyn, Rok III, II semestr,
Biologia część I, Budowa układu wydalniczego człowieka i fizjologia powstania
Miejsce powstawania pryszczy a ich
więcej podobnych podstron