
Izoenzymy – znaczenie
diagnostyczne z przykładami

Zmiany aktywności enzymów we
krwi, często są odzwierciedleniem
zmian patologicznych zachodzących
w narządach.
Diagnostyka enzymologiczna opiera się
na założeniu, że uszkodzenie narządu
pociąga za sobą uszkodzenie struktur
komórkowych lub zmianę
przepuszczalności błon komórkowych.

Enzymy narządowo
swoiste
Enzymy charakterystyczne dla obrazu
uszkodzenia danej tkanki. Odkrycie tych
enzymów stało się podstawą dla stworzenia
enzymatycznych profili narządowych
pozwalających na monitorowanie zmian
danego narządu.
Doświadczenia kliniczne wykazały jednak,
że w wielu tkankach występują białka o tej
samej aktywności enzymatycznej, co
uniemożliwia uzyskanie konkretnych wyników.
Te badania bazowały na określeniu aktywności
enzymatycznej. Okazało się jednak, że w
różnych tkankach enzymy katalizujące te
same reakcje często różnią się strukturą
cząsteczki, a co za tym idzie właściwościami
fizykochemicznymi - izoenzymy.

W płynach śródtkankowych i w osoczu zawsze
występuje mieszanina izoenzymów różnego
pochodzenia, które składają się na całkowitą
mierzoną aktywność enzymu. Niekiedy różnica
własności izoenzymów (pH, temperatura,
odmienna swoistość substratowa) pozwalają
na odrębne oznaczenie danego izoenzymu.
Z diagnostycznego punktu widzenia ważna
jest dynamika narastania zmian aktywności
enzymów. Najczęściej szybkość aktywności
enzymu tkankowego pozwala na wnioskowanie
o rozwoju procesu patologicznego w narządzie.

α-amylaza
Enzym występujący w świetle przewodu
pokarmowego, bierze udział w hydrolizie
skrobi i glikogenu dostarczanych z
pokarmem.
W wyniku działania enzymu powstają
dekstryny, a następnie maltotrioza i
maltoza.
Spośród płynów ustrojowych największą
aktywność wykazują sok trzustkowy i
ślina, mniejszą surowica i mocz.

W surowicy krwi można wykazać obecność
kilku izoenzymów:
- Trzustkowe (P1, P2, P3)
- Z gruczołów ślinowych (S1, S2, S3)
- Ze śluzówki jelita cienkiego (P2)
- Z gruczołu mlecznego (P2, S1, S2)
- Z komórek nabłonka kanalików Mϋllera
jajników i jąder (O1, O2)
Mocz zawiera takie same izoenzymy
jak surowica!

Znaczenie kliniczne:
- W ostrym zapaleniu wysoko i gwałtownie
wzrasta aktywność α-amylazy w surowicy
oraz w moczu.
- Wzrost w surowicy i moczu obserwowany
jest w zatkaniu przewodu trzustkowego lub
żółciowego wspólnego, w zaostrzeniu
przewlekłego zapalenia trzustki, urazach
trzustki.
W tych przypadkach wzrasta także
aktywność lipazy w surowicy.
- Wzrost aktywności jednak bez wzrostu
aktywności lipazy następuje także w
przypadku zapalenia ślinianek lub
przewodów ślinianek, w chorobach
jajników, jąder, nowotworach
wydzielających ektopowo amylazę.

- W niewydolności nerek oraz w
makroamylazemii wzrasta aktywność
amylazy w surowicy natomiast obniża się
w moczu.
- Aktywność amylazy w surowicy i moczu
obniża się w fazie przewlekłej chorób, w
których dochodzi do znacznego
uszkodzenia trzustki, wątroby oraz
zatruciu barbituranami.

Fosfataza zasadowa
Działanie polega na hydrolitycznym
odszczepieniu reszty ortofosforanowej z
organicznych estrów kwasu fosforowego.
W dużej ilości występuje w tkance kostnej i w
błonie śluzowej jelita. Wytwarzany jest także
przez łożysko, niektóre tkanki nowotworowe,
nerki i wątrobę.

Fosfataza zasadowa posiada izoenzymy
- Wątrobowy
- Kostny
- Jelitowy
- Łożyskowy

W osoczu ludzi zdrowych występują 3
Izoformy:
wątrobowa, kostna i jelitowa.
- Fizjologiczny wzrost występuje u ciężarnych.
W II trymestrze pojawia się w osoczu
izoenzym łożyskowy, który zanika wkrótce po
porodzie.
- U rosnących dzieci dominuje fosfataza
kostna.
- Po posiłku u osób z grupą krwi 0 i B, u kobiet
w okresie menstruacji lub u osób
zażywających estrogeny pojawia się frakcja
jelitowa ALP.
- Natomiast w okresie rekonwalescencji,
zrastania kości i po zabiegach operacyjnych
następuje wzrost izoformy kostnej.

Znaczenie kliniczne
- Markery nowotworowe – zaliczamy do nich
izoenzymy podobne do frakcji łożyskowej
(Regan, Nagao i inne). Stwierdzane u
pacjentów z rakiem płuc, żołądka, wątroby,
nerek i gruczołu krokowego.
- Choroby wątroby i dróg żółciowych
przebiegające z zastojem żółci (żółtaczka
mechaniczna, marskość zaporowa wątroby)
- Choroby kości związane ze zniszczeniem i
przebudową tkanki kostnej. Izoenzym
kostny jest markerem kościotworzenia.

Fosfataza kwaśna
Występowanie:
- Gruczoł krokowy
- Płytki krwi
- Erytrocyty
- Makrofagi
- Wątroba
- Śledziona
- Nerki

Znaczenie kliniczne
Podwyższenie aktywności w surowicy
zachodzi w następujących stanach
chorobowych:
- Rak gruczołu krokowego
- Zawał gruczołu krokowego
- Stany zakrzepowo-zatorowe, przełomy
hemolityczne
- Choroby układu kostnego
- Choroby wątroby
- Ostre uszkodzenie nerek
- Choroby układu limforetikularnego z
zajęciem wątroby lub kości
- Choroba reumatyczna

Dehydrogenaza mleczanowa
Enzym cytoplazmatyczny zbudowany z
czterech łańcuchów polipeptydowych.
Występuje we wszystkich komórkach
organizmu. Katalizuje odwracalną reakcję
utlenienia kwasu mlekowego do pirgronianu i
odwrotnie. Największą zawartość tego
enzymu wykazują tkanki cechujące się
wysokim metabolizmem energetycznym tj.
mózg, erytrocyty, serce, wątroba, płuca,
mięśnie szkieletowe.
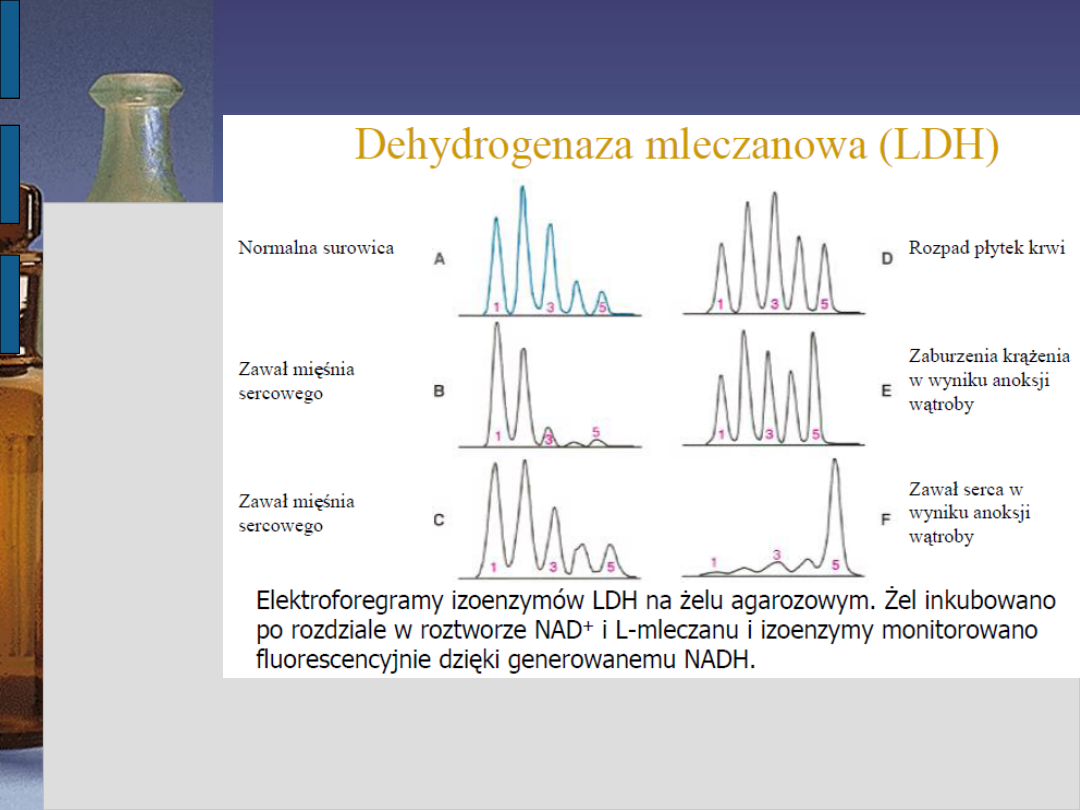
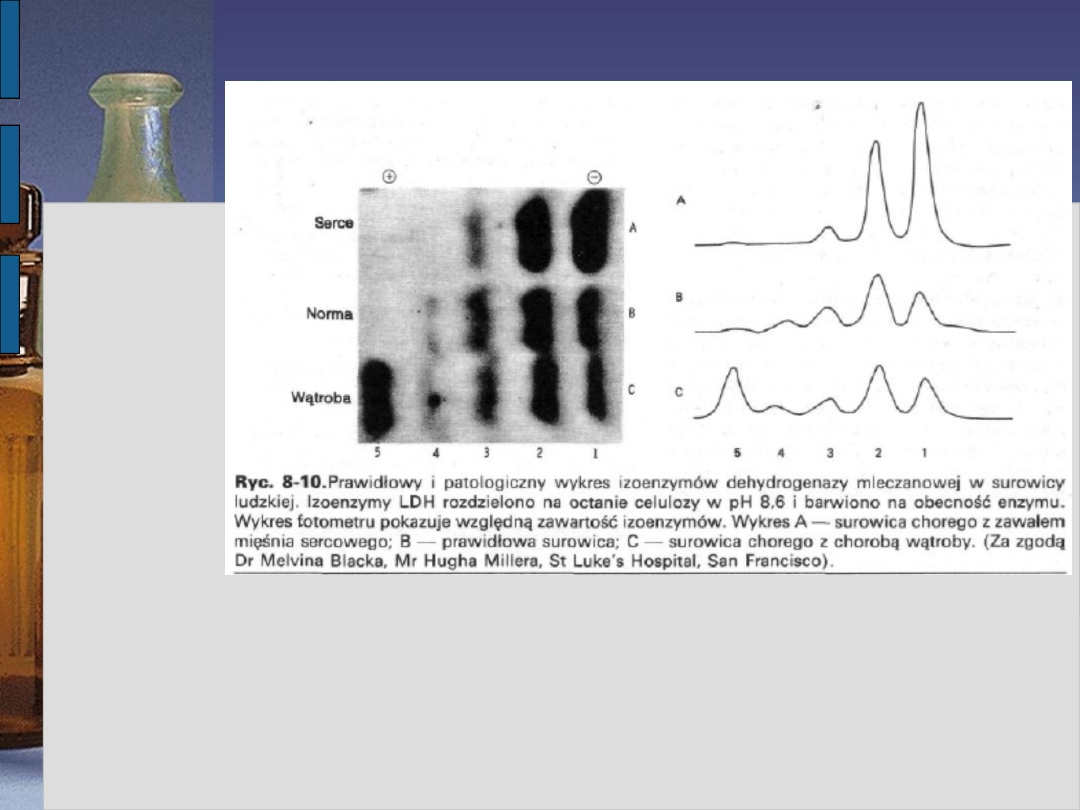
Badaniem elektroforetycznym surowicy
krwi udaje się wykazać pięć odmian
(izoenzymów) dehydrogenazy mleczanowej
różniących się budową, miejscem syntezy,
czasem półtrwania w surowicy.
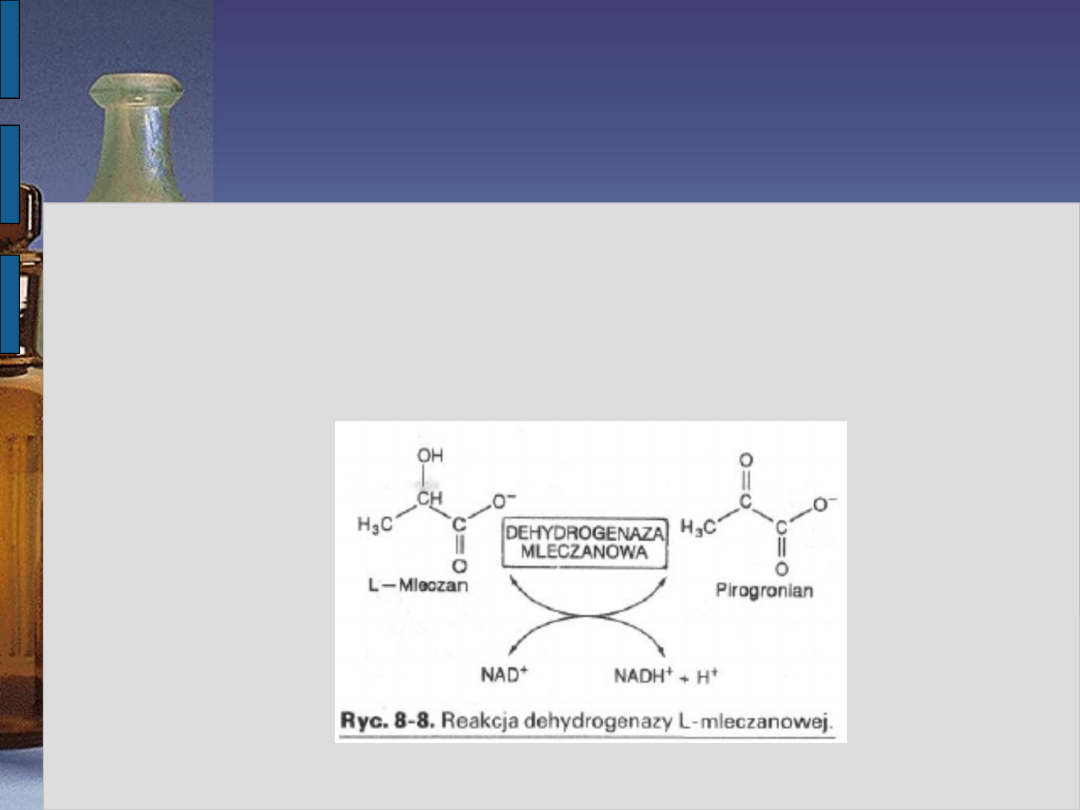
Istnieją tylko dwa rodzaje łańcuchów w tych enzymach.
- Łańcuch H (heart)
- Łańcuch M (muscle)
LDH1 ma cztery Łańcuchy H,
LDH2 - 3H i 1M,
LDH3 - 2H i 2M,
LDH4 - 1H i 3M,
LDH5 ma cztery łańcuchy M.
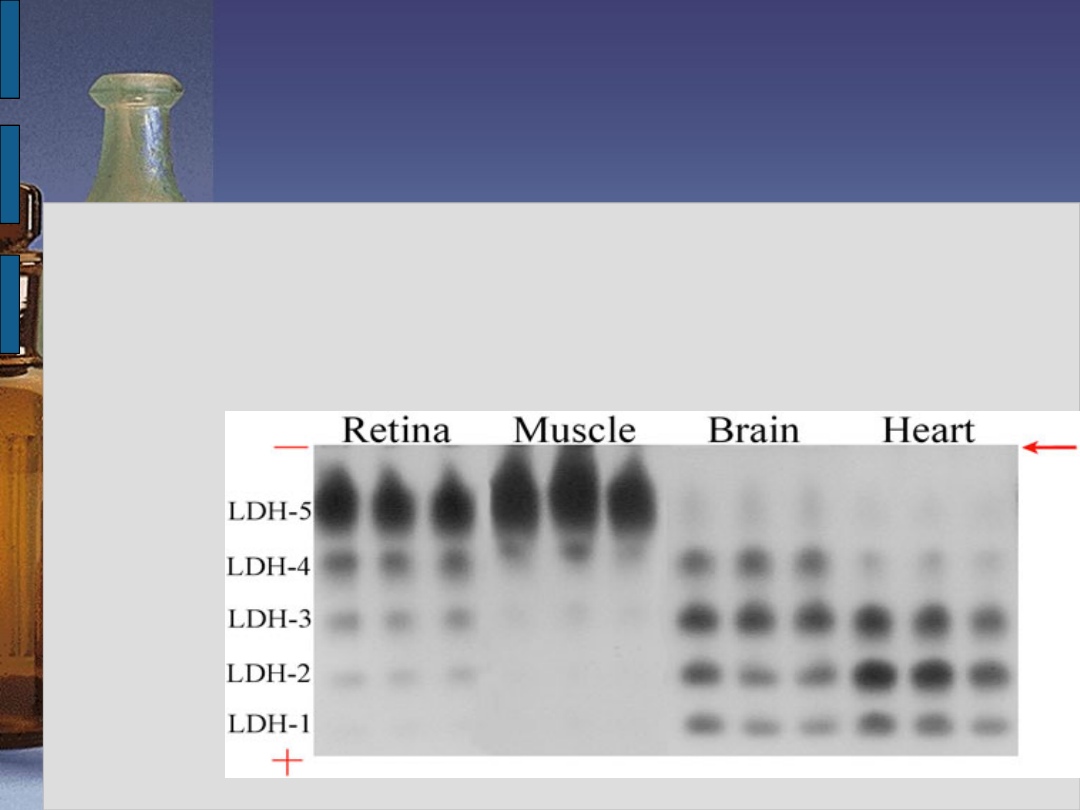
Izoenzymy LDH1 - 2 występują głównie w mięśniu
sercowym, erytrocytach i nerce,
Izoenzymy LDH4 - 5 głównie w mięśniach szkieletowych
i
wątrobie
Izoenzym LDH3 w komórkach innych tkanek lub
narządów (płuca, a także jest
produkowany przez niektóre
nowotwory).
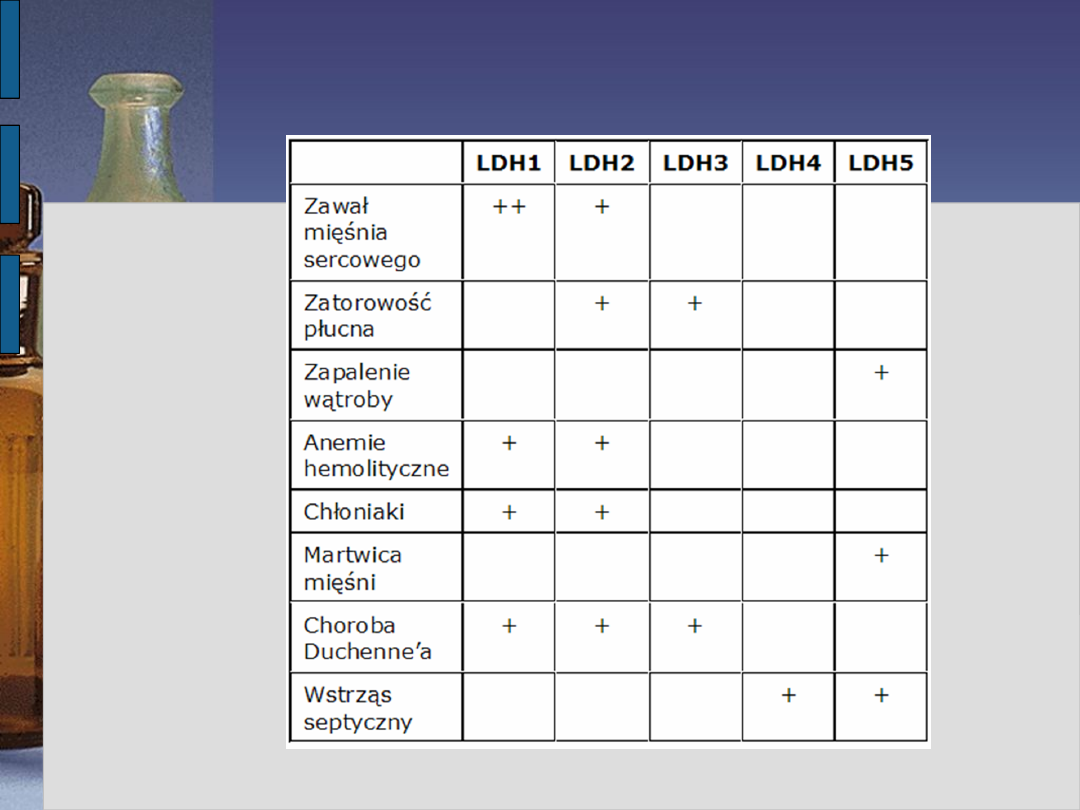
Znaczenie kliniczne
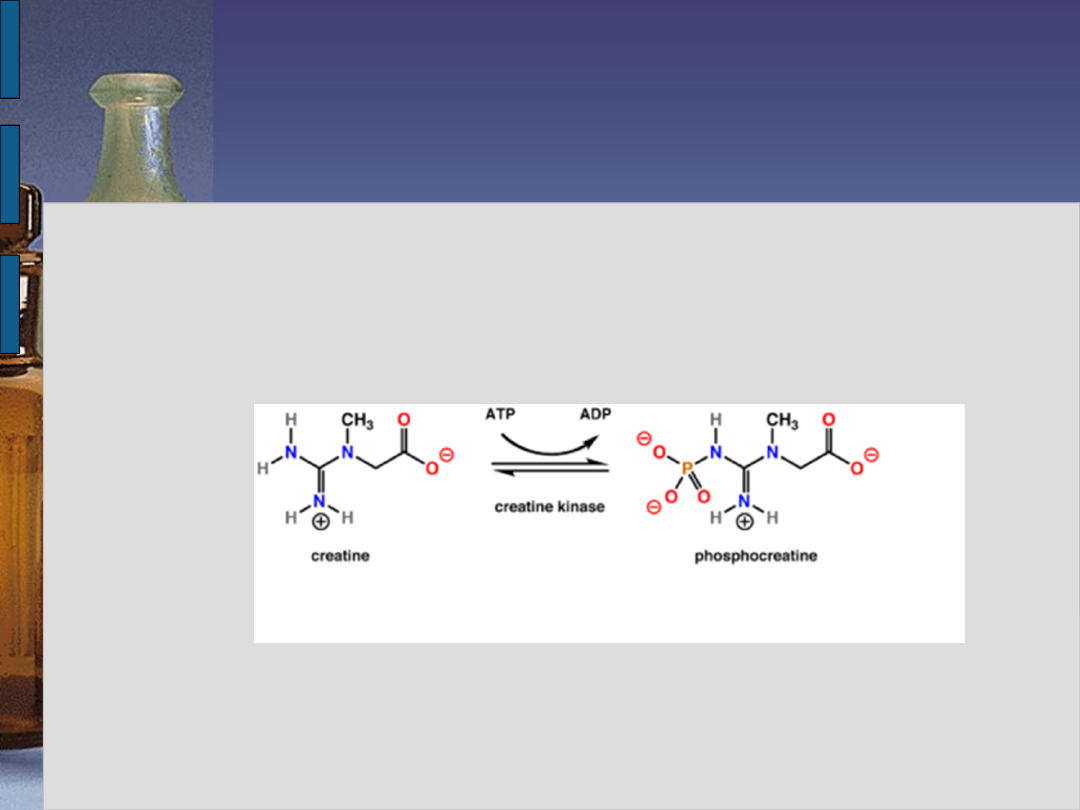
Kinaza kreatynowa
Katalizuje odwracalną reakcję fosforylacji
kreatyny. Umożliwia w ten sposób
gromadzenie związków
wysokoenergetycznych w komórce w formie
fosfokreatyny.
Enzym ten jest aktywowany przez jony
Mg2+.

Kinaza kreatynowa jest zbudowana z dwóch
podjednostek:
- Typ B (brain)
- Typ M (muscle)
Istnieją 3 izoformy enzymu:
- CPK-1: izoenzym BB charakterystyczny dla
mózgu
- CPK-2: izoenzym MB charakterystyczny dla
mięśnia sercowego i mięśni
szkieletowych
- CPK-3: izoenzym MM charakterystyczny dla
mięśni szkieletowych

Znaczenie kliniczne
Patologicznie aktywność CPK w surowicy
wzrasta:
- We wczesnej fazie zawału mięśnia
sercowego
- W chorobach mięśni ( toksyczne, zapalne
lub urazowe uszkodzenie mięśni
szkieletowych, a także w dystrofii
mięśniowej)
- W chorobach mięśnia sercowego (zapalne,
toksyczne lub pourazowe uszkodzenie)
- W chorobach OUN (wylew domózgowy,
zmiany zapalne i urazowe, nowotwory,
zespół Reya)
- W chorobach innych narządów (zator płuc,
niedoczynność tarczycy, wstrząs,
intensywna radioterapia)

Bibliografia
- „Biochemia skrypt dla studentów wydziału
lekarskiego”, Pod redakcją prof. Jana
Gmińskiego, 2003
- „Biochemia Harpera”, Murray Robert K.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
Izoenzymy znaczenie w diagnostyce z przykładami
Skrypt Studium Terapii Uzależnień, 06. Znaczenie diagnozy w terapii uzaleĹĽnienia, Znaczenie diagnoz
Znaczenie diagnostyczne i terapeutyczne endoskopii w onkolog
ZNACZENIE DIAGNOZY W EDUKACJI, studia, oligo, diagnoza psychologiczna
Kliniczne+znaczenie+diagnostyki+obrazowej, Prezentacje ELEKTRO
Znaczenie diagnostyczne i terapeutyczne endoskopii w onkolog
Znaczenie wykrywania antygenów i przeciwciał w diagnostyce inwazyjnej drożdżycy
Wzrost znaczenia Polski w XV 2wieku. Scenariusz lekcji diagnozującej, Testy, sprawdziany, konspekty
Znaczenie analizy białek PMR w diagnostyce zapalnych układu nerwowego
Otępienie semantyczne znaczenie wywiadu i oceny neurpsychologicznej w diagnostyce różnicowej 2009
diagnostyka
T 3[1] METODY DIAGNOZOWANIA I ROZWIAZYWANIA PROBLEMOW
Przedmiot PRI i jego diagnoza przegląd koncepcji temperamentu
DIAGNOSTYKA FIZJOLOGICZNA I 1
więcej podobnych podstron