Bartosz Puchalski 4.V.2005
Ćwiczenie nr 6
Wyznaczanie stałej szybkości reakcji
rozkładu nadtlenku wodoru na katalizatorze węglowym
Po uruchomieniu termostatu przygotowałem 100 ml ok. 0,3% roztworu nadtlenku wodoru i oznaczyłem jego stężenie miareczkując 5 ml próbkę z dodatkiem 1 ml 4 M H2SO4 nadmanganianem potasu (VII). Przygotowałem naważkę węgla aktywnego bezpośrednio na łopatce naczyńka reakcyjnego. Wprowadziłem 50 ml roztworu H2O2 do naczyńka reakcyjnego i umieściłem w nim łopatkę z węglem aktywnym, tak, by nie dotykała roztworu. Wyrównałem poziomy w biurecie gazowej z podziałką. Po 15 minutach termostatowania wprowadziłem węgiel aktywny do roztworu nadtlenku wodoru, uruchomiłem mieszadło, włączyłem stoper. Odczytywałem poziomy w biurecie gazowej w odpowiednich odstępach minutowych.
1. Obliczam początkową liczbę moli H2O2 ![]()
:
ponieważ podczas miareczkowania zeszło średnio 5,033 ml KMnO4 o stężeniu 0,009 mol/l to:
w 1000 ml KMnO4 było - 0,009 mola KMnO4
to w 5,033 ml było - x moli KMnO4
x = 0,0000453 mola KMnO4
biorąc pod uwagę stechiometrię reakcji nadtlenku wodoru z nadmanganianem:
2MnO4- + 5H2O2 + 6H+ ↔ 6Mn2+ + 5O2 + 8H2O
widać, że 2 mole KMnO4 reagują z - 5 molami H2O2
więc 0,0000453 mola KMnO4 reaguje z - x molami H2O2
x = 0,00011325 mola H2O2
ponieważ do miareczkowania wzięto 5 ml próbkę a w naczyńku pomiarowym było 50 ml roztworu H2O2:
w 5 ml roztworu H2O2 było - 0,00011325 mola H2O2
to w 50 ml tego roztworu będzie - x moli H2O2
x = 0,0011325 mola H2O2 = ![]()
2. Obliczam liczbę moli wydzielonego tlenu ![]()
:
korzystam z równania gazu doskonałego Clapeyrona:
![]()
; gdzie p - prężność parcjalna O2 [N m-2] (równa różnicy Pcałkowite - Ppary wodnej), V - objętość odczytana z biurety gazowej [m3], T - temperatura [K], R - stała gazowa równa 8,314 [J mol-1 K-1]
przekształcając tak, aby uzyskać wzór na liczbę moli:
![]()
obliczam prężność pary wodnej interpolując odpowiednią wartość z wykresu Ppary wodnej = f(T) na podstawie tabeli zamieszczonej w skrypcie:
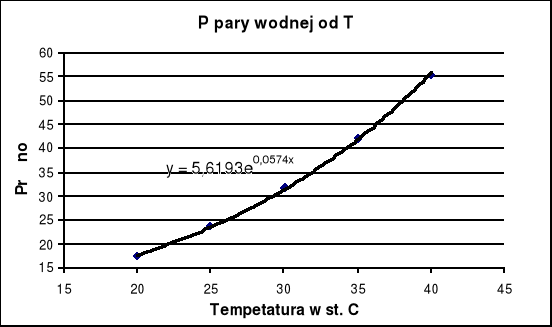
po podstawianiu do równania y = 5,6193e0,0574x za x wartość odczytanej przeze mnie temperatury równą 23,7 oC uzyskałem:
Ppary wodnej = 21,9022 [mm Hg] = 2919,33 [N m-2]
prężność parcjalna tlenu pod ciśnieniem 1008 [hPa] wynosi więc:
Pcałkowite - Ppary wodnej = 100800 - 2919,33 = 97880,67 [N m-2]
po podstawieniu wszystkich danych liczba moli tlenu dla pierwszej zanotowanej objętości równej 0,8 ml (0,0000008 m3) wynosi:
![]()
3. Wyniki obliczeń zbieram w tabeli:
Czas [s] |
V [cm3] |
V [m3] |
|
|
W |
|
k [1/s] |
120 |
0,8 |
0,0000008 |
3,174E-05 |
1,069E-03 |
5,606E-02 |
0,0576963 |
0,0004808 |
240 |
2 |
0,0000020 |
7,936E-05 |
9,737E-04 |
1,402E-01 |
0,1510074 |
0,0006292 |
360 |
2,5 |
0,0000025 |
9,920E-05 |
9,340E-04 |
1,752E-01 |
0,1926123 |
0,000535 |
480 |
3 |
0,0000030 |
1,190E-04 |
8,943E-04 |
2,102E-01 |
0,2360236 |
0,0004917 |
600 |
3,7 |
0,0000037 |
1,468E-04 |
8,388E-04 |
2,593E-01 |
0,3001508 |
0,0005003 |
720 |
4,1 |
0,0000041 |
1,627E-04 |
8,071E-04 |
2,873E-01 |
0,3387301 |
0,0004705 |
840 |
4,65 |
0,0000047 |
1,845E-04 |
7,634E-04 |
3,259E-01 |
0,3943306 |
0,0004694 |
960 |
5,15 |
0,0000052 |
2,044E-04 |
7,237E-04 |
3,609E-01 |
0,4477077 |
0,0004664 |
1200 |
6,1 |
0,0000061 |
2,420E-04 |
6,483E-04 |
4,275E-01 |
0,5577144 |
0,0004648 |
1500 |
7,15 |
0,0000072 |
2,837E-04 |
5,650E-04 |
5,011E-01 |
0,6952838 |
0,0004635 |
1800 |
8,1 |
0,0000081 |
3,214E-04 |
4,896E-04 |
5,676E-01 |
0,8385026 |
0,0004658 |
2100 |
9 |
0,0000090 |
3,571E-04 |
4,182E-04 |
6,307E-01 |
0,9961837 |
0,0004744 |
2400 |
9,9 |
0,0000099 |
3,928E-04 |
3,468E-04 |
6,938E-01 |
1,1834689 |
0,0004931 |
W = ![]()
/![]()
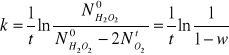
Masa węgla aktywnego = 0,08235 g
4. Obliczam wartość stałej szybkości rozkładu H2O2 w katalizatorze węglowym posługując się metodą najmniejszych kwadratów oraz arkuszem kalkulacyjnym excel.
na podstawie wykresu ln(1/(1-W)) = f(t) wyznaczyłem równanie linii trendu:
y = 0,0005x + 0,0076
na podstawie równania
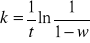
widać, że dla wartości t = 1 [s] wartość stałej jest równa wartości logarytmu naturalnego podstawiając do powyższego równania:
k = y = 0,0005 * 1 + 0,0076 = 0,0081 [1/s]
Wnioski.
Jak widać wartość stałej jest niewielka, więc reakcja zachodzi powoli. Wykres posiada współczynnik R2 = 0,9969 co obrazuje w miarę dokładne wykonanie ćwiczenia. Stałe wyznaczone dla poszczególnych ilości moli tlenu i nadtlenku wodoru są znacznie mniejsze od stałej wyznaczonej na podstawie wykresu prawdopodobnie na skutek różnicy w czasie, który dla drugiego przypadku wnosił 1 s. Reakcja rozkładu nadtlenku wodoru w katalizatorze węglowym jest dobrym przykładem reakcji kinetycznej pierwszego rzędu.
Wyszukiwarka
Podobne podstrony:
¦ćwiczenie 2 obliczenia doc
¦ćwiczenie 4 obliczenia doc
¦ćwiczenie 11 obliczenia doc
¦ćwiczenie 14 obliczenia doc
¦ćwiczenie 25 obliczenia doc
¦ćwiczenie 12 obliczenia doc
¦ćwiczenie 15 obliczenia doc
¦ćwiczenie 16 obliczenia doc
¦ćwiczenie 20 obliczenia doc
Projekt z wymiennikow obliczenia doc 5
¦ćWICZENIE NR6 doc
¦ćWICZENIE 4 CHF doc
~$ obliczenia doc
¦çwiczenie 19 (wykonanie ¦çwiczenia i obliczenia) doc
¦ćWICZENIE NR 7 doc
¦ćWICZENIE NR 5 doc
OBLICZ 1 (3) DOC
ćwiczenie 7 (opis wykonania ćwiczenia i obliczenia) doc
więcej podobnych podstron