
REAKCJE OSCYLACYJNE
Cel ćwiczenia
a.
obserwacje barwnych reakcji oscylacyjnych
b.
zbadanie wpływu temperatury na kinetykę reakcji
c.
obserwacje struktur dyssypatywnych w roztworach
Wprowadzenie:
Procesy oscylacyjne można obserwować w fizyce, chemii, astronomii i biologii.
Początkowe spostrzeżenia dotyczące oscylacji w układach chemicznych miały
charakter przypadkowy, a ich autorzy narażeni byli na zarzut niestarannego
prowadzenia doświadczeń. Nieufność ta była konsekwencją sprzeczności
obserwowanych zjawisk z klasycznymi regułami termodynamiki ujętymi w XIX w. przez
Clausiusa. Reguły te stwierdzały, że układ pozbawiony dopływu materii i energii z
otoczenia nieuchronnie zmierza do stanu równowagi, zaś entropia w miarę postępu
reakcji chemicznej wzrasta. Periodyczna zmiana własności układu, wskazująca na
okresowy wzrost uporządkowania pewnych reagentów, wydawała się zaprzeczeniem
drugiej zasady termodynamiki.
W roku 1921 William Bray ze Stanów Zjednoczonych badał stężenie jodanu IO
3
–
podczas reakcji katalitycznego rozkładu nadtlenku wodoru (jodan pełni w tej reakcji
funkcję katalizatora):
jodan
H
2
O
2
Y
½ O
2
+ H
2
O
Stężenie katalizatora w toku reakcji okresowo się zmieniało. Prace Bray'a uznano za
artefakty.
W ZSRR w roku 1958 Biełousow badał reakcję kwasu cytrynowego
z bromianem potasu w obecności soli ceru. W tym czasie chemia fizyczna była już
lepiej przygotowana do “przełknięcia pigułki” reakcji oscylacyjnych. Ilia Prirogine
z Brukseli wykazał, że klasyczna termodynamika, a więc to co postulował Clausius,
wymaga nie tylko braku wymiany materii i energii z otoczeniem, ale i bliskości stanu
równowagi. W układach dalekich od tego stanu mogą zachodzić tzw. procesy
dyssypatywne, będące z kolei przyczyną powstawania struktur dyssypatywnych.
Procesy dyssypatywne mogą to być przykładowo zmieniające się okresowo stężenia

produktów pośrednich wspomnianych powyżej reakcji chemicznych. Stężenia
substratów i produktów końcowych nie oscylują, zmierzając ku stanowi równowagi.
Systematyczne badania nad reakcją odkrytą przez Biełousowa podjął w latach
sześćdziesiątych Żabotyński. Określił on dokładnie warunki, w jakich ta reakcja
zachodzi, między innymi wpływ stężeń substratów na charakter drgań (6). Do późnych
lat sześćdziesiątych nie rozumiano właściwie tej reakcji. W uznaniu zasług obydwu
uczonych ze Związku Radzieckiego nazwano tę przemianę reakcją Biełousowa-
Żabotyńskiego. Wyjaśnienie mechanizmu reakcji w sensie chemicznym polega na
podaniu sekwencji wszystkich reakcji elementarnych składających się na cały proces,
łącznie ze stałymi równowagi i stałymi czasowymi poszczególnych etapów. W latach
siedemdziesiątych grupa uczonych amerykańskich, współpracując z Węgrami,
zaproponowała schemat mechanizmu reakcji B-Ż składający się z osiemnastu etapów
(2). Schemat ten sprawdził się m.in poprzez symulacje komputerowe odzwierciedlające
kinetykę reakcji obserwowanej w laboratorium. Wyjaśnienie reakcji B-Ż obudziło
nadzieje na głębsze zrozumienie innych procesów oscylacyjnych. Pod koniec lat
siedemdziesiątych skonstatowano, że przewidywania te nie sprawdziły się – poznano
tylko kilka podobnych reakcji, wszystkie zostały odkryte przypadkowo, nie wiadomo było
jakie są warunki konieczne i wystarczające do zaobserwowania oscylacji.
W roku 1979 podjęto próbę zdefiniowania warunków niezbędnych do wywołania
oscylacji chemicznych. Punktem wyjśnia były cechy wspólne wszystkich do tej pory
odkrytych reakcji oscylacyjnych. Oto one:
a.
układ musi być daleko od stanu równowagi
b.
w układzie musi znajdować się pętla sprzężenia zwrotnego - produkt
przynajmniej jednej reakcji powinien kontrolować tempo własnego powstawania
c.
układ musi być bistabilny - znaczy to, że w tych samych warunkach
zewnętrznych możliwe są dwa różne, stabilne stany stacjonarne

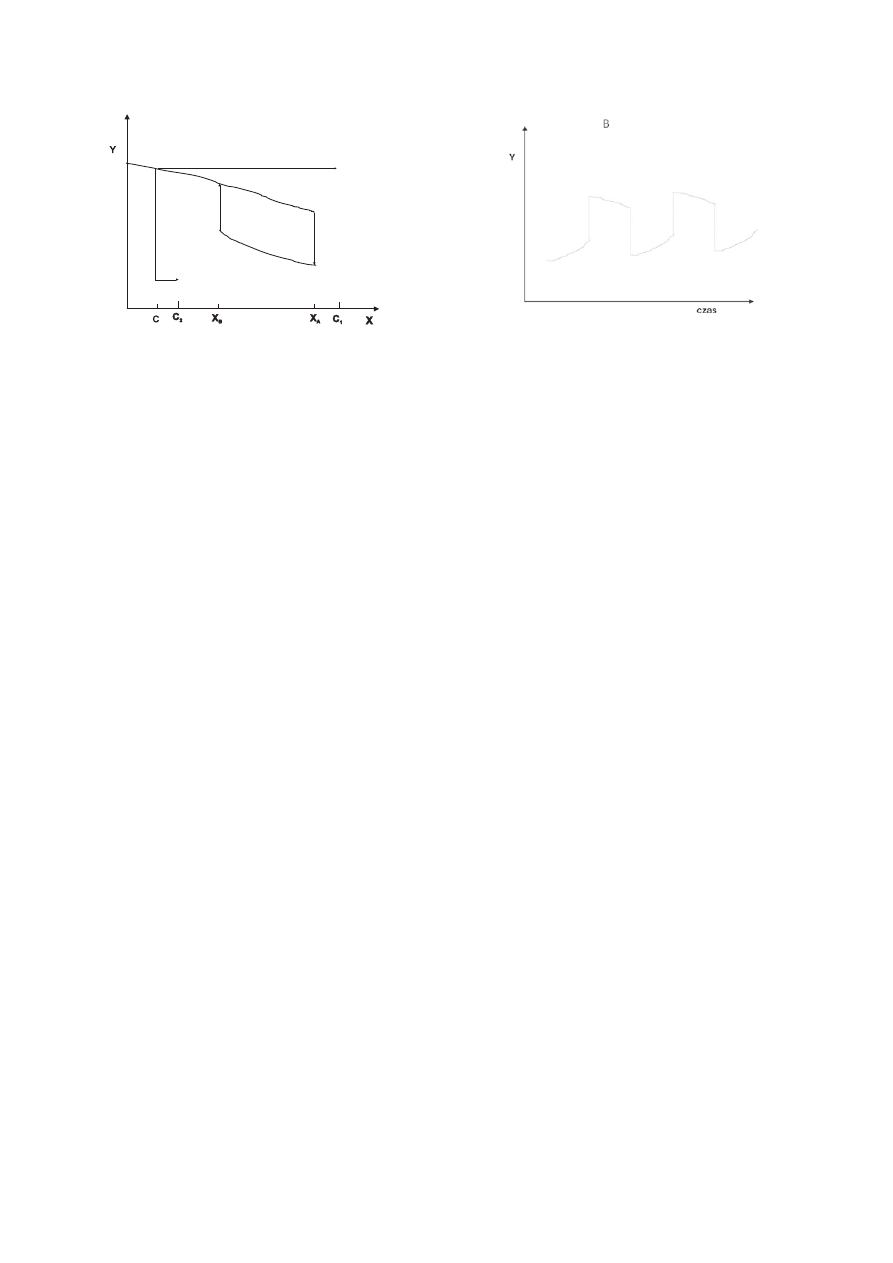
Rysunek 1. Prosty przykład układu bistabilnego
Techniką, dzięki której odkryto kilka nowych rodzin reakcji oscylacyjnych, jest
"przepływ ciągły" (w języku angielskim: "continuous flow"). Istotą tej techniki jest
przepływ substratów przez komorę reakcyjną; pozwala ona na łatwe spełnienie warunku
nie zbliżania się do stanu równowagi. Przy zmianie warunków zewnętrznych w
przypadku układu bistabilnego można zobserwować swoistą pętlę histerezy - układ
powraca do stanu wyjściowego po drodze odmiennej od drogi pierwotnej (Rysunek 2).
Obszar
bistabilny
A
Rysunek 2. Pętla histerezy w bistabilnym układzie chemicznym.
W miarę gdy stężenie X rośnie, stężenie Y spada wzdłuż krzywej górnej aż do wartości
Y
A1
, a następnie przeskakuje w punkcie X
A
na krzywą dolną. Przy dalszym zwiększaniu
stężenia X ustala się nowy stabilny stan stacjonarny wzdłuż dolnej krzywej. Podczas
zmniejszania stężenia X, po osiągnięciu punktu X
B
, stabilny stan stacjonarny
"przeskakuje" na krzywą górną (wg (2)).
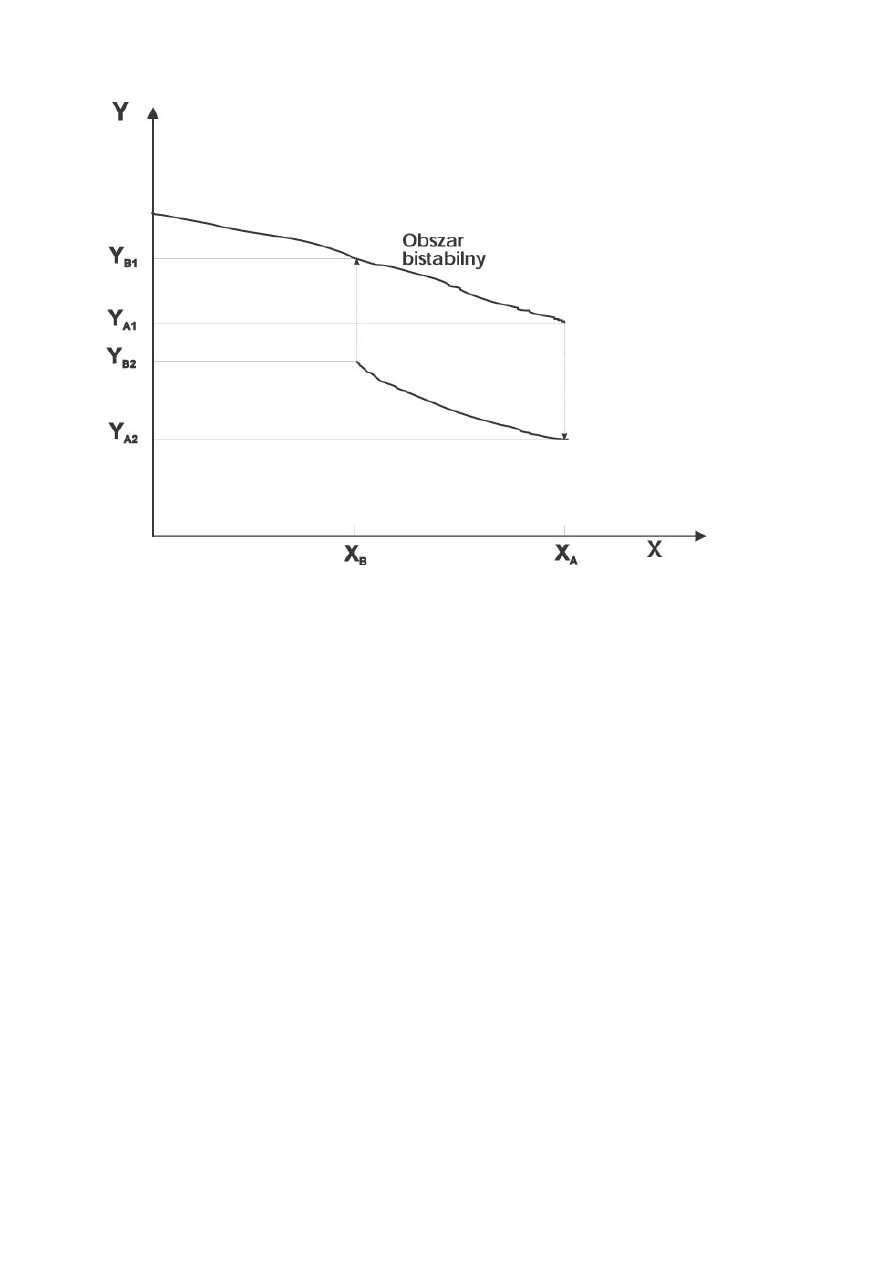
Rysunek 3. Oscylacje w bistabilnym układzie chemicznym.
Oscylacje mogą wystąpić gdy stosowna substancja Z jest dodana do bistabilnego
układu chemicznego, który wykazuje histerezę. Substancja Z wolno reaguje
z substancją Y, przekształcając ją w substancję X, i wówczas efektywne stężenie
substancji X jest wyższe od wartości początkowej, przed dodaniem substancji Z. Efekt
zwiększenia efektywnego stężenia X jest większy na krzywej górnej (przy dużym
stężeniu Y, zgodnie z prawem działania mas) niż na dolnej (A). Wyobraźmy sobie, że
reakcja zaczyna się gdy X=C. Dodajemy odpowiednią ilość Z, tak, że efektywne
stężenie X=C
1
gdy cały układ osiąga stan stacjonarny na krzywej górnej, i C
2
– gdy
"znajduje się" na krzywej dolnej. Dodanie substancji Z powoduje "przesuwanie się"
stanu stacjonarnego wzdłuż krzywej górnej (na skutek przekształcania Y w X). Układ
próbuje osiągnąć punkt C
1
, ale w punkcie A przechodzi gwałtownie do stanu
stacjonarnego na krzywej dolnej. W tym stanie efektywne stężenie X=C
2
, zatem układ
próbuje “dopasować się” do tego stężenia (strzałka w lewo na rysunku 3A). Zanim
jednak osiągnie ten nowy stan stacjonarny, w punkcie X=B wraca na krzywą górną i
cykl się zamyka. Powtórzenie całej sekwencji zdarzeń jest przyczyną oscylacji wartości
Y (Rysunek 3B) (wg 2).

Literatura
1.
O.S.Czernawski i wsp. "Co to jest biofizyka matematyczna", rozdziały I, IV;
Państwowe Wydawnictwo Naukowe, Warszawa 1974 lub jakikolwiek podręcznik
chemii fizycznej, rozdziały o kinetyce chemicznej.
Nieco wiadomości o kinetyce chemicznej i zjawiskach periodycznych.
2.
I.R.Epstein, K. Kustin, P. De Kepper,M. Orban "Oscillating Chemical Reactions"
Scientific American 248(3),1983, str. 96-108
Bardzo ciekawie napisany artykuł w renomowanym czasopiśmie. Głównie na
podstawie tego artykułu została opracowana część teoretyczna instrukcji.
3.
B. Welsh, J. Gomatam, A.E. Burgess "Three-dimensional structures in the
Belousov-Zhabotinski reaction" Nature 304(5927), 1983, str. 611-614
Autorzy prezentują udane fotografie struktur dyssypatywnych w układzie
trójwymiarowym. Niektóre z ich pomysłów posłużyły do zaprojektowania jednego
z doświadczń części praktycznej.
4.
A.T. Winfree "Chemical Systems that Oscillate between One Color and Another"
Scienctific American vol. 239(1), 1978
Artykuł "kuchenny", szereg pomysłów w części praktycznej zostało
zaczerpniętych właśnie od tego autora.
Literatura uzupełniająca:
5.
A. Górski "Indeterminizm, chaos i zjawiska nieliniowe" Problemy 8/85, 14-18,
1985
Ciekawe przedstawienie zjawiska oscylacji w pewnych działach matematyki.
6.
"Koliebatielnyje processy w biołogiczeskijich i chimiczeskich sistiemach", praca
zbiorowa wyd. Nauka, Moskwa 1967
Podstawowa praca dla wszystkich chcących poważnie zająć się studiowaniem
reakcji Biełousowa-Żabotyńskiego.
7.
A. Stasiewicz "Drapieżniki i ofiary" Komputer 3/1988

Prosty przykład programu komputerowego realizującego model "rysi i zająców"
8.
A.T. Winfree "The Geometry of Biological Time", rozdział 13, wyd. Springer-
Verlag, New York - Heidelberg - Berlin 1980, str. 300-314
Wykonanie ćwiczenia
Wariant „A” (wg 2, 3, 4)
Sprzęt laboratoryjny:
a.
spektrometr „Spekol” z wyprowadzeniem sygnału do rejestracji
b.
przystawka do miareczkowania „Micro TI” wraz z zasilaczem
c.
pH-metr
d.
kuwety do przystawki "Micro TI"
e.
małe mieszadełko magnetyczne typu „pcheka”
f.
rejestrator (czas-Y), wymagana czułość 0.5 - 5 mV/cm
g.
kondensator elektrolityczny 100 µF (zakładany pomiędzy wyprowadzenia ze „Spekola”
w celu wytłumienia drgań sieciowych)
h.
pipeta 1 ml lub pipeta automatyczna 200 µl + końcówki
i.
Pipeta automatyczna 20 µl + końcówki
Odczynniki
UWAGA: Poniższe roztwory powinny być przygotowane przed ćwiczeniami przez asystenta
a.
roztwór 0.1 M Ce(SO
4
)
2
w 1 N H
2
SO
4
lub
1.74 g Ce(NO
3
)
3
* 6 H
2
O w 750 ml H
2
0 + 1.5 ml stężonego kwasu siarkowego - 50 ml
b.
roztwór 1.2 M kwasu malonowego w wodzie - 50 ml
c.
roztwór 0.35 M bromianu potasowego w wodzie - 50 ml
d.
stężony kwas siarkowy - 1 ml
e.
stężony kwas solny - 1 ml
f.
1 N kwas siarkowy - 50 ml
Obserwacje oscylacji w różnych warunkach i przy różnych stężeniach substratów:
1.
Odmierzyć do naczynia reakcyjnego po 0.5 ml roztworów a, b i c. Czy bez mieszania
można zauważyć zmiany w barwie roztworu? Włączyć mieszanie. Jakie ma ono
znaczenie w badanym układzie?
Warunki rejestracji: λ = 415 nm, czułość rejestratora 0.5 - 1 mV/cm, szybkość zapisu
60 s/cm. Doświadczenie to uznajemy za standardowe.
2.
Zarejestrować oscylacje przy zmianie stężeń poszczególnych reagentów:
A.
Zmniejszyć dwukrotnie stężenie ceru. W jaki sposób uniknąć błędu zmiany
stężenia pozostałych reagentów? Sprawdź, konsultując swój plan
doświadczenia z asystentem.
B.
Zmniejszyć dwukrotnie stężenie kwasu malonowego.
C.
Zmniejszyć dwukrotnie stężenie bromianu potasu.
3.
Zakwaszanie kwasem siarkowym: do reagentów dodawać po 0.05 ml stężonego
H
2
SO
4
. Zapisać wyniki przy użyciu rejestratora.
4.
Zakwaszanie kwasem solnym: postępować jak wyżej, ale zamiast H
2
SO
4
użyć
stężonego HCl.
Opracowanie wyników:
1.
Na podstawie wyników z punktu 1 spróbować określić który z reagentów pełni rolę
kluczowego w badanej reakcji, uzasadnić dokonany wybór.
2.
Wykreślić zależność szybkości reakcji w zależności od pH dla każdego z kwasów. Czy
zaobserwowana zależność jest taka sama dla każdego z nich?
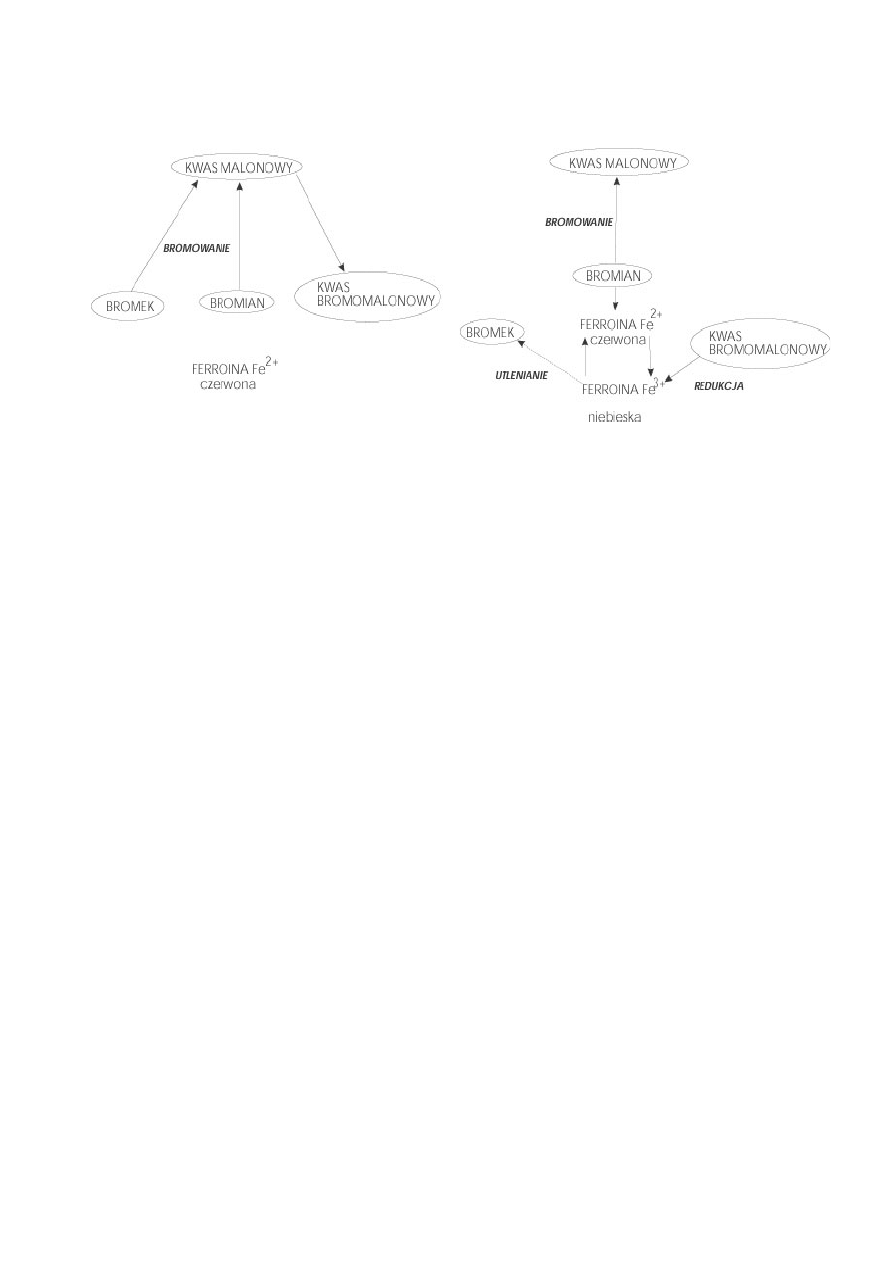
Drugi wariant ćwiczenia — „B”, bez stosowania soli ceru (wg 8)
Rysunek 4. Dwa ciągi reakcji oparte o kwas malonowy mogą wywoływać oscylacje barwne
ferroiny od czerwieni do błękitu i powrót do czerwieni.
Schemat tych reakcji podany jest na powyższych rysunkach. Reakcja zachodzi
pomiędzy bromkiem, bromianem, kwasem malonowym i fenantroliną skompleksowaną
z żelazem. Kompleks fenantroliny z żelazem pełni rolę podwójną - jest katalizatorem
i wskaźnikiem barwnym. Stężenie bromku decyduje, który z dwóch ciągów reakcji
będzie dominował. W jednym przypadku (lewa część rysunku) bromek i bromian
jednocześnie bromują kwas malanowy i tworzy się kwas bromomalonowy. Podczas
tego procesu barwnik fenantrolinowy jest czerwony, z atomem żelaza na drugim
stopniu utlenienia. Jeśli stężenie bromku spadnie poniżej pewnego poziomu, wówczas
drugi ciąg reakcji zaczyna dominować (prawa część rysunku). Bromek zostaje zużyty
do końca i bromian przejmuje bromowanie kwasu malonowego. Równocześnie utlenia
on atom żelaza we wskaźniku barwnym, powodując zmianę jego barwy z czerwonej
(Fe
2+
) na niebieską (Fe
3+
). Nagromadzony kwas bromomalonowy redukuje potem (linia
przerywana) Fe
3+
w kompleksie do Fe
2+
, na powrót pojawia się barwa czerwona.
Podczas tej reakcji uwalnia się bromek (co łatwo poczuć) i dwutlenek węgla. Wysokie
stężenie bromku hamuje tę sekwencję reakcji i powoduje przeskok do ciągu reakcji
przedstawionych po lewej stronie rysunku. Dla uproszczenia pominięto w
rozważaniach reakcje z udziałem tlenu z powietrza.

Wykonanie ćwiczenia:
Sprzęt laboratoryjny:
a.
termostatowane naczynko z mieszadełkiem
b.
łaźnia wodna połączona z termostatowanym naczyniem reakcyjnym
c.
pipety 5 ml, 2 ml i 1 ml
d.
zlewka 400 ml
e.
zlewka 50 - 100 ml - 3 szt.
f.
szklane szalki Petriego - 4 szt.
g.
probówki szklane z dopasowanymi korkami gumowymi - 6 szt.
h.
pipeta półautomatyczna 200
Fl
i.
łaźnia lodowa, lub lód w naczyniu styropianowym
j. termometr lub inny miernik temperatury
n.
stoper
Odczynniki:
a.
ferroina - 25 mM roztwór ortofenantroliny (1,10-Phenantroline) skompleksowanej z Fe
2+
z soli Mohra dodanej w nadmiarze w 1.5 N H
2
SO
4
- 30 ml
b.
roztwór bromku potasu - 5 g/50 ml
c.
roztwór kwasu malonowego - 5 g/50 ml
d.
roztwór bromianu potasu - 134 ml H
2
O + 4 ml stęż. H
2
SO
4
+ 9 g KBrO
3
e.
stężony kwas siarkowy - 1 ml
f.
stężony kwas solny - 1 ml
g.
alkohol etylowy 95% - 5 ml
Protokół doświadczeń:
1.
Odmierzyć do naczyńka reakcyjnego 6 ml roztworu bromianu potasu, 1 ml roztworu
kwasu malonowego, 0.5 ml roztworu bromku potasu. Włączyć mieszanie i poczekać
aż zaniknie całkowicie żółto-brązowy kolor roztworu reakcyjnego. Dodać 1 ml roztworu
ferroiny.
Zaobserwować zmiany barwy (z czerwonej do niebieskiej). Zanotować okres drgań.

Wyniki tego doświadczenia przyjmujemy za standardowe.
2.
Zależność okresu drgań od temperatury.
Odmierzyć do zlewki 50 ml standardowe ilości reagentów. Roztwór reakcyjny umieścić
na mieszadle magnetycznym. Przy stałej szybkości mieszania zmierzyć okresy drgań
tego samego roztworu reakcyjnego w przedziale temperatur 5
o
-50
o
C co 5 stopni. W
tym celu zlewkę z reagentami umieszczać w specjalnym termostatowanym naczyniu
lub, w przypadku braku takiego naczynia, w krystalizatorze wypełnionym wodą o
określonej temperaturze i umieszczonym na mieszadle magnetycznym.
3.
Wpływ etanolu na okres oscylacji.
Odmierzyć do naczynia reakcyjnego standardowe ilości reagentów. Zmierzyć okres
drgań po dodaniu do roztworu reakcyjnego 5 µl etanolu, następnie zwiększać ilość
etanolu do 30 µl porcjami 5 µl, po dodaniu każdej porcji mierzyć okres drgań.
4.
Obserwacje oscylacji chemicznych w układzie dwu- i trójwymiarowym.
A.
Standardowe ilości reagentów mieszać na mieszadle magnetycznym aż do
wystąpienia oscylacji. Następnie roztwór reakcyjny rozlać do szalek Petriego
(1-2 mm warstwa na dnie). Przykryć szalki wieczkami i obserwować.
B.
Powtórzyć postępowanie jak w poprzednim punkcie, lecz roztwór reakcyjny
wlać do probówek i zatkać je korkami gumowymi. Obserwować kształty
obszarów o różnym zabarwieniu.
5.
Zakwaszanie kwasem siarkowym:
Do standardowej ilości reagentów dodać 0.05 ml stężonego H
2
SO
4
.
6.
Zakwaszanie kwasem solnym:
Postępowanie jak w poprzednim punkcie ale zamiast H
2
SO
4
użyć HCl.

Opracowanie wyników:
1.
Sporządzić wykres zależności szybkości reakcji oscylacyjnej (jaki parametr może
posłużyć do tego celu?) w funkcji temperatury we współrzednych standardowych oraz
we współrzędnych Arrheniusa. Czy ciągowi reakcji oscylacyjnych można przypisać
jednoznacznie energię aktywacji?
2.
Wykreślić zależność szybkości reakcji oscylacyjnej od stężenia etanolu.
3.
Opisać zwięźle struktury dyssypatywne w układzie dwuwymiarowym i trójwymiarowym.
Pytania pomocnicze:
1.
Wymień kilka zjawisk periodycznych i postaraj się wskazać, co jest czynnikiem
determinującym ich częstotliwość.
2.
Wyszukaj w instrukcji słowa napisane pogrubioną kursywą. Czy potrafisz podać
definicje tych pojęć?
3.
Co to jest stabilność? Podaj przykłady.
4.
Podaj przykłady sprzężenia zwrotnego dodatniego i ujemnego.
5.
W jaki sposób szybkość reakcji chemicznej zależy od temperatury?
6.
Co to jest energia aktywacji? Jak można wyznaczyć energię aktywacji?

Dodatek - nowe stanowiska pracy wprowadzone do ćwiczenia REAKCJE OSCYLACYJNE
Reakcje oscylacyjne - stanowisko z programem komputerowym do symulacji oscylacji w
liczebności populacji drapieżników (rysi) i ofiar (zającow).
Program EKOLOS3 został napisany w języku QBASIC na podstawie artykułu z czasopisma BAJTEK.
Działanie programu pokazuje model zależności liczebności populacji drapieżników i ofiar w czasie.
Inspiracją do stworzenia modelu zmian liczebności poulacji w czasie była analiza liczby skór zwierząt
futerkowych skupowanych od myśliwych w XIX w. przez faktorie na terenie dzisiejszej Kanady.
1.
Na stanowisku pracy widoczne są dwa zabytkowe komputery z ubiegłego wieku. Pierwszy z
nich to Amstrad CPC128, zabytek pochodzący z lat 80 wieku XX, a drugi to Toshiba 100CS
z lat 90 XX w.
2.
Mimo tego, że komputery te są przestarzałe, można na nich uruchomić prosty program
symulujący wahania liczebności populacji drapieżników i ofiar.
3.
Niestety, Amstrad CPC128 ma uszkodzoną stację dyskietek, zatem niemożliwe jest wczytanie
programu EKOLOS zapisanego na nietypowej dyskietce o średnicy 3 cali.
4.
Program zapisany został na komputerze Toshiba S100cs (pentium I, 75 MHz, 8 mB na płycie
głównej, pamięć rozszerzona do 16 Mb)
5.
Włącz komputer poczekaj, aż system wystartuje i na ekranie pojawią się ikony programów.
6.
Uruchom program QBASIC przez dwukrotne kliknięcie na jego ikonę.
7.
Klawiszem ESC wyjdź z krótkiego menu SURVIVAL. Na górnej belce komend wybierz FILE,
a potem OPEN.
8.
Na ekranie ukaże się lista programów napisanych w BASICu. Wybierz kursorem myszy
program EKOLOS3 i otwórz go - przez kliknięcie kursorem myszy lub ENTER.
9.
Komenda RUN uruchamia program. Po podaniu początkowych liczebności drapieżników i ofiar
mamy do wyboru dwie możliwości wyświetlania wyników:
a.
wykres oscylacyjny - czyli tradycyjne liczebności populacji (na osi Y) w funkcji czasu
na osi X
b.
wykres trajektorii - czyli wyświetlanie danych na tzw. płaszczyźnie fazowej. Na osi X
odkreślana jest liczebność jednej populacji, a na osi Y - drugiej. Proszę zwrócić uwagę,
że czas nie występuje explicite (wprost) w tego rodzaju wykresie, ale można W
CZASIE śledzić przesuwanie się punktu oznaczającego liczebności populacji.
10.
Metodą prób i błędów należy tak dobrać wartości początkowe drapieżników i ofiar, aby przy

wykresie oscylacyjnym oba wykresy znajdowały się w całości na ekranie komputera.
Zanotować wartości, przy których obserwowane jest zjawisko oscylacji, zarówno na wykresie
oscylacyjnym, jaki i na wykresie trajektorii.
11.
Na wykresie oscylacyjnym zaobserwuj:
a.
Czy amplitudy zmian liczebności zająców i rysi są takie same?
b.
Czy okresy oscylacji liczebności obu populacji są takie same?
c.
Czy wykresy zmian liczebności populacji są w tej samej fazie?
12.
Zbadać jak zachowuje się układ w sytuacjach granicznych, np.
a.
brak drapieżników, dużo ofiar
b.
brak ofiar, dużo drapieżników
Czy potrafisz nazwać wykresy otrzymywane w sytuacjach granicznych?
13.
Można zmieniać wartości niektórych parametrów, poprzez skierowanie kursora do wybranej
lini programu i napisanie wartości innych niż początkowe.
UWAGA: Zmiany zapisać POD NOWĄ NAZWĄ, w przeciwnym wypadku program EKOLOS3 może
zostać zastąpiony nowym programem, inaczej działającym!
Proszę spróbować zinterpretować obserwowane wyniki i określić jakie założenia
UPRASZCZAJĄCE zostały przez twórców programu przyjęte.
Zachęcam do samodzielnych eksperymentów!

Reakcje oscylacyjne - stanowisko z elektronicznymi modelami świetlika
W krajach tropikalnych po zmierzchu obserwowane jest zjawisko świecenia świetlików
(spokrewnionych z naszymi poczciwymi robaczkami świętojańskimi) w sposób SYNCHRONICZNY.
Prawdopodobnie synchronizacja błysków osiągana jest dzieki detekcji błysków sąsiadujących owadów
i odpowiedniego „nastrajania” własnego aparatu błyskowego.
Umieszczone na stanowisku roboczym dziwne urządzenia z dużą zieloną diodą mają niezgrabnie
przypominać naturalne świetliki.
Zaobserwuj następujące zjawiska:
1.
Obejrzyj uważnie elektroniczny świetlik. Zauważ, że z każdej z czterech stron płytki
zainstalowane są fotodiody, pełniące w tym modelu funkcję fotoreceptorów.
2.
Włącz układ pojedynczego świetlika przy pomocy przełącznika na bocznej ściance modelu.
Zaobserwuj miganie dużej zielonej diody. Ogranicz ilość światła dostarczanego do
fotoreceptorów. Czy częstotliwość migania się zmienia?
3.
W przyciemnionym świetle umieść kilka elektronicznych świetlików obok siebie i włącz je
wszystkie. Pozostaw je włączone przez kilka minut. Co można powiedzieć o częstotliwości ich
błyskania?
4.
Powtórz doświadczenie przy zapalonym świetle górnym. Czy obserwujesz podobne zachowanie
układu jak w poprzednim doświadczeniu?
5.
Przeprowadź doświadczenie jak w punkcie 3, ale oddzielając poszczególne modele od siebie
kartkami papieru. Czy przebieg doświadczenia jest taki sam, jak w doświadczeniu 3?
Na podstawie dokonanych obserwacji zaproponuj pętlę sprzężenia zwrotnego do kontroli
częstotliwości świecenia świetlików. Co jest sygnałem, co jest szumem, co jest efektem w tej pętli?
Wyszukiwarka
Podobne podstrony:
06 oscylacje
oscylator, Fizyka, 06.Drgania i fale
MT st w 06
Kosci, kregoslup 28[1][1][1] 10 06 dla studentow
06 Kwestia potencjalności Aid 6191 ppt
06 Podstawy syntezy polimerówid 6357 ppt
06
06 Psych zaburz z somatoformiczne i dysocjacyjne
GbpUsd analysis for July 06 Part 1
Probl inter i kard 06'03
06 K6Z4
06 pamięć proceduralna schematy, skrypty, ramyid 6150 ppt
Sys Inf 03 Manning w 06
Ustawa z dnia 25 06 1999 r o świadcz pien z ubezp społ w razie choroby i macierz
więcej podobnych podstron