|
UNIWERSYTET ZIELONOGÓRSKI WYDZIAŁ INŻYNIERII LĄDOWEJ I ŚRODOWISKA INSTYTUT INŻYNIERII ŚRODOWISKA
|
Ćwiczenia laboratoryjne z chemii fizycznej.
Zjawiska powierzchniowe. Adsorpcja kwasu
karboksylowego na węglu aktywnym.
Dariusz GAJEWCZYK
Jakub KOSTECKI
Alicja KOSZEWAR
1. PODSTAWY TEORETYCZNE :
Adsorpcja jest jednym z podstawowych zjawisk powierzchniowych. Termin ten oznacza występowanie zmian stężenia substancji na granicy faz w stosunku do głębi fazy. Substancję ulegającą adsorpcji nazywamy adsorbatem, a substancję, na powierzchni której występuje adsorpcja- adsorbentem.
W przypadku ciała stałego, cieczy lub gazu atomy, jony lub cząsteczki znajdujące się na powierzchni graniczących faz lub w jej pobliżu podlegają działaniu niezrównoważonych sił ze strony tych faz (sił adhezji). Wypadkowe tych sił są skierowane prostopadle do płaszczyzny powierzchni granicznej. Cząsteczki lub atomy powierzchniowe znajdują się w innym stanie energetycznym aniżeli cząsteczki wnętrza fazy. Ta dodatkowa energia, zwana energią powierzchniową, powoduje szereg szczególnych właściwości obszaru powierzchniowego, różniących się znacznie od właściwości wewnętrznej części fazy.
Klasyfikację procesów adsorpcyjnych przeprowadza się zwykle według rodzaju faz tworzących powierzchnię oraz według rodzaju sił działających na tej powierzchni.
Występowanie dwóch rodzajów sił oddziaływania między adsorbentem i adsorbatem stanowi podstawę do podziału adsorpcji na dwa ogólne typy: fizyczną i chemiczną. Typ adsorpcji można poznać śledząc jej przebieg w zależności od temperatury. W przypadku adsorpcji fizycznej zależność adsorpcji od temperatury jest niewielka, ciepło adsorpcji wynosi kilkadziesiąt kJ na mol, natomiast proces adsorpcji chemicznej zależy znacznie od temperatury, a ciepło adsorpcji ma zwykle wartość kilkuset kJ na mol. Ciepło adsorpcji ulega zmniejszeniu ze wzrostem pokrycia powierzchni adsorbenta.
Zastosowanie adsorpcji:
rozdzielanie gazów toksycznych;
oddzielanie par od gazów: suszenie gazów, usuwanie wilgoci;
oddzielanie substancji rozpuszczonych od roztworów: odbarwianie roztworów, klarowanie, zatężanie substancji śladowych;
oddzielanie jonów z roztworów;
wykorzystanie adsorpcji środków powierzchniowo czynnych;
frakcjonowanie składników mieszaniny w procesach adsorpcji selektywnej.
Teoria Langmuira:
Langmuir założył, że na powierzchni adsorbentu istnieje określona liczba jednakowych centrów adsorpcji, z których każde zdolne jest do zaadsorbowania tylko jednej cząsteczki adsorbatu. Stan maksymalnej adsorpcji odpowiada obsadzeniu wszystkich centrów, tj. wytworzeniu na powierzchni adsorbentu monomolekularnej warstwy adsorbatu. Oznaczając liczbę moli substancji zaadsorbowanej przez daną masę adsorbentu jako n, liczbę moli zaś, przy której następuje obsadzenie wszystkich centrów, prze nm, można zdefiniować stopień osadzenia (pokrycia) powierzchni, θ :
θ = ![]()
Oznaczając przez a liczbę moli substancji zaadsorbowanej przez jednostkową masę adsorbentu
(a = n/m) i odpowiednio am = nm / m (m - masa adsorbentu), otrzymamy:
a = ![]()
[molּkg-1];
Zależność a(p) opisana powyższym wzorem nosi nazwę:izotermy Langmuira
Wzór Freundlicha:
Empiryczne równanie Freundlicha ma postać:
![]()
= kc1/n
gdzie:
m - masa węgla,
c - stężenie roztworu kwasu octowego poddawanego adsorpcji,
x - ilość moli kwasu octowego zaadsorbowanego na węglu aktywnym;
Po zlogarytmowaniu równanie to przybiera postać: lg ![]()
= lg k +![]()
ּ lg c
Izoterma BET:
Równanie opisujące ilość substancji zaadsorbowanej przez jednakową masę adsorbentu jako funkcję ciśnienia gazu adsorbowanego wyprowadzili S. Branauer, P. H. Emmett i E. J. Teller. Równanie to, bardzo ważne jako narzędzie do wyznaczania powierzchni właściwej ciał stałych, znane jest pod nazwą izotermy BET (od pierwszych liter nazwisk tych badaczy). Gdy adsorpcji ulega gaz jednoskładnikowy, równanie BET m postać:
a = ![]()
W równaniu tym po jest prężnością pary nasyconej adsorbatu w temperaturze, w której odbywa się adsorpcja, C zaś jest pewną funkcją temperatury, określoną przez różnicę pomiędzy ciepłem adsorpcji w pierwszej monomolekularnej warstwie i ciepłem skroplenia. Gdy ciepło skroplenia jest zaniedbania względem ciepła adsorpcji (C![]()
1), a ciśnienie gazu zaadsorbowanego znacznie mniejsze od prężności pary nasyconej, równanie BET przechodzi w równanie izotermy Langmuira.
2. CEL ĆWICZENIA :
Celem ćwiczenia było wyznaczenie izotermy adsorpcji Freundlicha dla układu: wodny roztwór kwasu organicznego - węgiel aktywny w temperaturze pokojowej.
3. METODYKA BADAŃ :
Mając do dyspozycji 0,5m roztwór kwasu octowego sporządzono pięć roztworów (po 100cm3 każdy) o następujących stężeniach: 0,3m, 0,25m, 0,15m, 0,10m, 0,20m. Otrzymane roztwory (10 cm3) dokładnie mianowano (wobec fenoloftaleiny) za pomocą 0,1m NaOH. Następnie pobrano po 50cm3 każdego roztworu, wlano do butelek na 150cm3 i wsypano do każdej z nich dokładnie odważoną ilość węgla aktywnego (ok.2g) , zamknięto szczelnie korkiem i wstrząsano przez 10 min. Następnie roztwory przesączono i mianowano jak poprzednio.
4. WYNIKI BADAŃ :
x - liczbę moli zaadsorbowanego kwasu obliczono z różnicy stężeń przed i po adsorpcji.
Empiryczne równanie Freundlicha ma postać:
![]()
= kc1/n
Gdzie:
m - masa węgla,
c - stężenie roztworu kwasu octowego poddawanego adsorpcji,
x - ilość moli kwasu octowego zaadsorbowanego na węglu aktywnym;
Po zlogarytmowaniu równanie to przybiera postać:
lg ![]()
= lg k +![]()
ּ lg c
Tabelaryczne zestawienie wyników i obliczeń:
Lp. |
V1
|
V2
|
m
|
x
|
lg |
c |
lg c |
|
[cm3] |
[cm3] |
[g] |
[mol] |
[-] |
[mol/dm3] |
[-] |
1 |
7,4 |
5,5 |
2 |
0,00095 |
-3,323 |
0,074 |
-1,131 |
2 |
10,1 |
8,7 |
2 |
0,0007 |
-3,456 |
0,101 |
-0,996 |
3 |
12,2 |
10,2 |
2 |
0,001 |
-3,301 |
0,122 |
-0,914 |
4 |
19,0 |
17,0 |
2 |
0,001 |
-3,301 |
0,19 |
-0,721 |
5 |
30,5 |
20,5 |
2 |
0,005 |
-2,602 |
0,305 |
-0,516 |
Gdzie:
V1 ,V2 - objętości [cm3] 0,1m NaOH zużyte na miareczkowanie 10 cm3 roztworu CH3COOH odpowiednio: przed i po adsorpcji,
x = 5.10-4. (V1-V2) [mol],
c = 10-2.V1 [mol/dm3],
(*) przedstawione wyniki są średnimi dla trzech oznaczeń, za każdym razem pobierano 10 cm3 badanego roztworu,
(* *) przeliczone na 50cm3 roztworu;
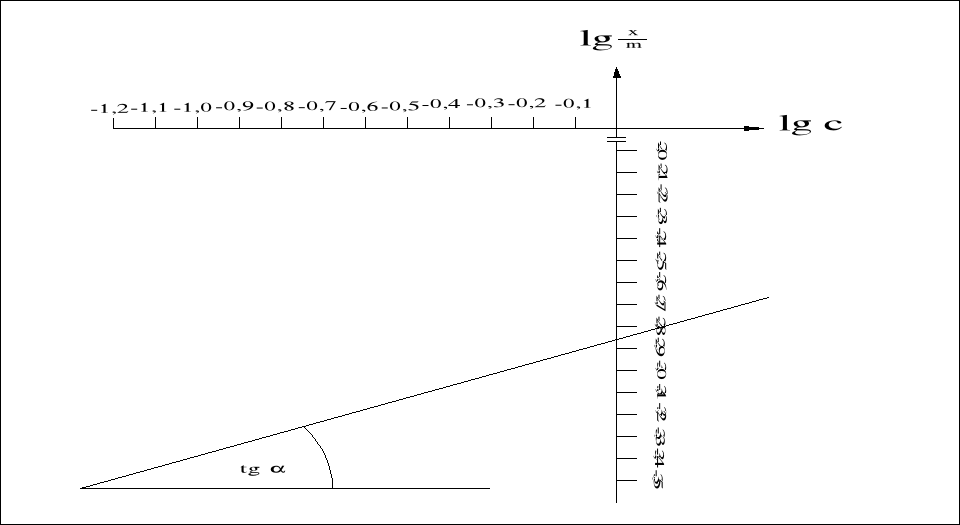
Na podstawie obliczeń sporządzono wykres zależności lg![]()
= f (lg c). Z punktu przecięcia prostej z osią rzędnych odczytano wartości lg k = -2,86, a z tangensa kąta nachylenia wartości 1/n = 0,55. Z wartości lg k wyznaczono wartość stałej k:
lg k = -2,86 ![]()
k = 10-2,86 = 0,000138
5. WNIOSKI:
Celem ćwiczenia było wyznaczenie izotermy adsorpcji Freundlicha dla układu: wodny roztwór kwasu organicznego - węgiel aktywny w temperaturze pokojowej. Został on osiągnięty dzięki zależności lg![]()
= f (lg c). Ponadto uzyskano wartość współczynników k i ![]()
(1/n = 0,55) równania Freundlicha: z punktu przecięcia prostej z osią rzędnych odczytano wartość lg k - na podstawie którego wyznaczono współczynnik k, natomiast stosunek ![]()
wyznaczono z tangensa kąta nachylenia.
Uzyskane wyniki potwierdzają przydatność równania Freundlicha do opisu adsorpcji substancji roztworu. Znaleziona wartość współczynnika n = 1,82 leży w przedziale typowym dla procesów adsorpcji na węglu aktywnym.
Na podstawie współczynnika k i zależności 1/n na podstawie możemy z łatwością wyznaczyć liczbę moli lub miarę substancji zaadsorbowanej na gram adsorbenta.
Literatura:
„Chemia fizyczna” Pigoń, Bielański, Sobczyk, Gumiński, Kamiński;
„Chemia fizyczna” Maria Jurkiewicz - Herbich;
Wyszukiwarka
Podobne podstrony:
OBLICZENIA DO ADSORBCJI, Weterynaria, Chemia
Prezentacja JMichalska PSP w obliczu zagrozen cywilizacyjn 10 2007
3 ANALITYCZNE METODY OBLICZANIA PŁYWÓW
Optymalizacja LP
Obliczanie masy cząsteczkowej
Obliczanie powierzchni
2 Podstawy obliczania
3 2 Ćwiczenie Obliczanie siatki kartograficznej Merkatora
GEOMETRIA OBLICZENIOWA I
67 Sposoby obliczania sił kształtowania plastycznego ppt
16 Dziedziczenie przeciwtestamentowe i obliczanie zachowkuid 16754 ppt
obliczenia
Podstawy obliczeń chemicznych 6
Obliczanie i pomiary parametrów obwodów prądu jednofazowego
obliczenia (4)
Oblicza Kraszewskiego
więcej podobnych podstron