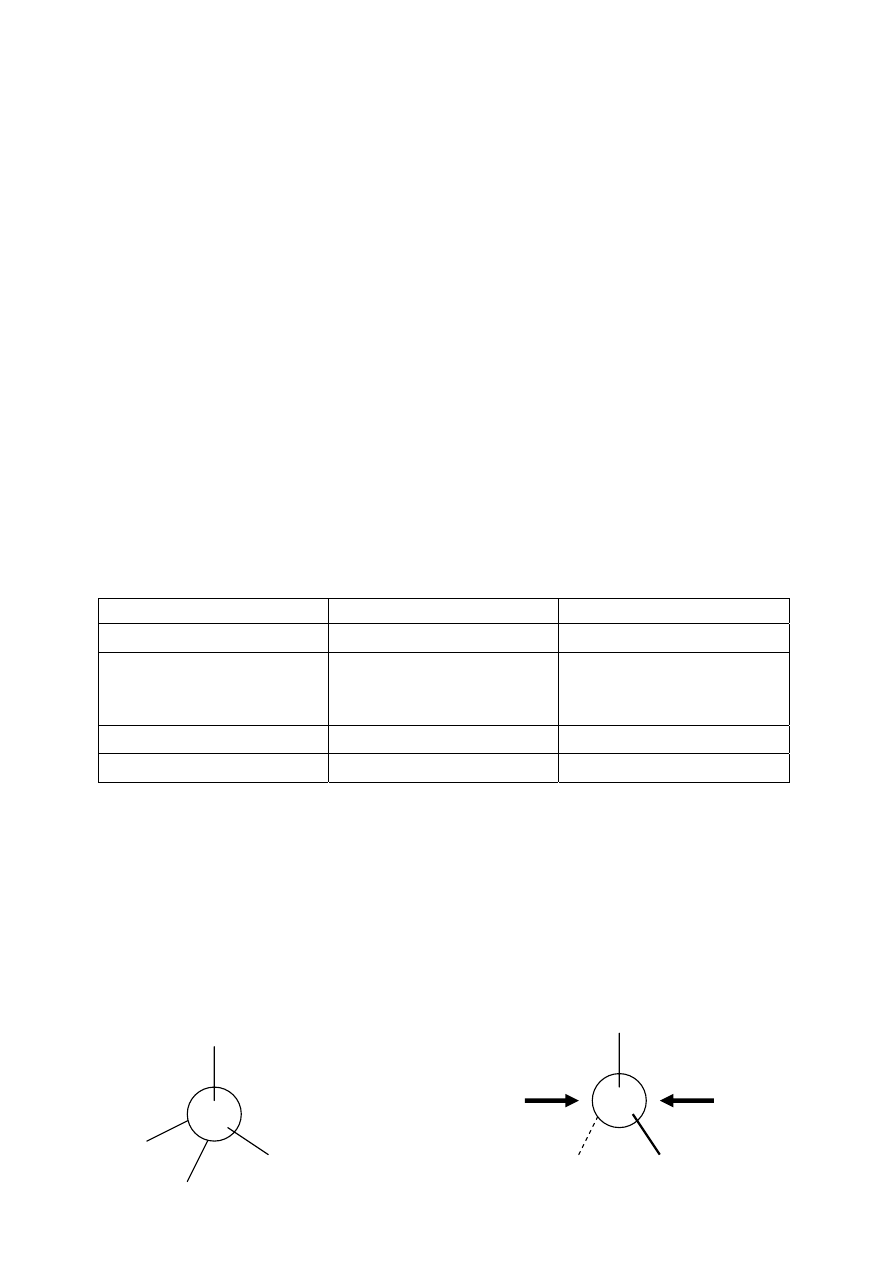
grupa 4:
1. Jakiś lek i zaznaczyć jego centrum stereogeniczne.
;)
2. Dlaczego eter etylowo metylowy ma o 90 stopni niższą temperaturę wrzenia niż
alkohol n-propylowy?
Oba związki mają identyczną masę molową (są izomerami). Masa molowa ma wpływ na
temperaturę wrzenia i topnienia.
Eter nie tworzy wiązań wodorowych które mają bardzo istotny na zwiększenie temperatury
wrzenia i topnienia, natomiast alkohol n-propylowy tworzy wiązania wodorowe, dzięki
czemu jego temperatura wrzenia jest o 90 stopni wyższa.
BTW: - kwasy karboksylowe tworzą dwa wiązania wodorowe,
-
cząsteczki będące dipolami mają wyższą temperaturę wrzenia i topnienia,
- im większa masa molowa tym większe temperatury wrzenia i topnienia,
-
cząsteczki rozgałęzione mają niższe temperatury wrzenia i topnienia.
3. 3 związki, określić, które są aromatyczne.
4. 4 związki : NH
3
, NH
4
+
, CH
3
CH
2
COOH, i jakiś alkohol (weźmy CH
3
CH
2
OH), do
każdego narysować sprzężona zasadę i sprzężony kwas.
sprzężony kwas
związek wyjściowy sprzężona zasada
NH
4
+
NH
3
NH
2
-
brak,
ew. NH
5
2+
ale raczej
nie istnieje
NH
4
+
NH
3
CH
3
CH
2
COOH
2
+
CH
3
CH
2
COOH
CH
3
CH
2
COO
-
CH
3
CH
2
OH
2
+
CH
3
CH
2
OH
CH
3
CH
2
O
-
5. Dlaczego gdy produktem przejściowym jest karbokation powstaje mieszanina
racemiczna, mimo, że substratem jest substancja chiralna.
Wredne pytanie jak dla pierwszego roku :(
Karbokation ma hybrydyzację sp
2
, co oznacza iż jest płaski. Taka geometria centrum
aktywnego sprawia iż prawdopodobieństwo ataku czynnika nukleofilowego jest takie same z
obu stron (i z lewej i z prawej). Dlatego podczas reakcji z przejściowym stanem karbokationu
gdy produkt jest chiralny, to otrzymujemy mieszaninę racemiczną.
BTW – za wprowadzenie tzw. syntezy asymetrycznej (czyli otrzymywanie w takich
reakcjach przewagi jednego enancjomeru otrzymano nagrodę Nobla).
karbokation
sp
2
– jednakowa możliwość ataku z obu stron
Nu – czynnik nukleofilowy
+
Nu Nu
Atom węgla sp
3
Wyszukiwarka
Podobne podstrony:
ZADANIE 2 grupa CZN
GRUPA 05 ZADANIA
zadania ze struktur organizacyjnych grupa 1
ZADANIE A7(5), Radzion Dorota , technologia chemiczna , rok III , grupa III
Zadania energetyka, Szkoła, Semestr III, technologia maszyn energetycznych, Materiały Skiepki, Kol 1
ZADANIE A7(3), Radzion Dorota , technologia chemiczna , rok III , grupa III
ZADANIE A7(3), Radzion Dorota , technologia chemiczna , rok III , grupa III
Zadania z WC Zadania zajęcia 4 grupa 6
ZADANIE A7(10), Radzion Dorota , technologia chemiczna , rok III , grupa III
ZADANIE A7(7), Radzion Dorota , technologia chemiczna , rok III , grupa III
GRUPA 02 ZADANIA
ZADANIE A7(6), Radzion Dorota , technologia chemiczna , rok III , grupa III
Zad 17 04 13, ZADANIA DLA I ROKU MASZYN, grupa 10
ZADANIE- egzamin chirurgia grupa D , chirurgia
Odpowiedzi grupa A, Ekonometria, Ekonometria, Egzaminy + Testy, Egzaminy, ekonometria 2009, Ekonomet
więcej podobnych podstron