
KINETYKA
CHEMICZNA
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
•
Szybkością reakcji i jej zależnością od różnych czynników
zajmuje się dział chemii zwany kinetyką chemiczną.
•
Różnice w szybkości reakcji tłumaczy teoria zderzeń.
Wśród wszystkich zderzeń tylko niektóre - zwane efektywnymi
(lub aktywnymi)
− prowadzą do reakcji chemicznej.
•
Minimalna wartość energii, jaką muszą posiadać zderzające się
atomy lub cząsteczki, aby doszło między nimi do reakcji,
nosi nazwę energii aktywacji (E
a
).
•
Liczbę atomów lub cząsteczek o energii równej lub większej
od energii aktywacji opisuje równanie zwane
rozkładem statystycznym Maxwella-Boltzmanna
T
k
E
o
B
a
e
N
N
⋅
−
=
N – liczba atomów lub cząsteczek
o energii większej od E
a
N
o
– całkowita liczba atomów lub cząsteczek
e = 2,71823 (liczba Nepera, postawa logarytmu nat.)
E
a
– energia aktywacji
k
B
= 1,38 · 10
–23
J/K - stała Boltzmanna
T – temperatura w kelwinach
A
B
N
R
k
=
„ułamek sekundy – to czas jaki upływa od zapalenia się zielonego
światła do momentu, kiedy facet za nami naciśnie klakson”
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
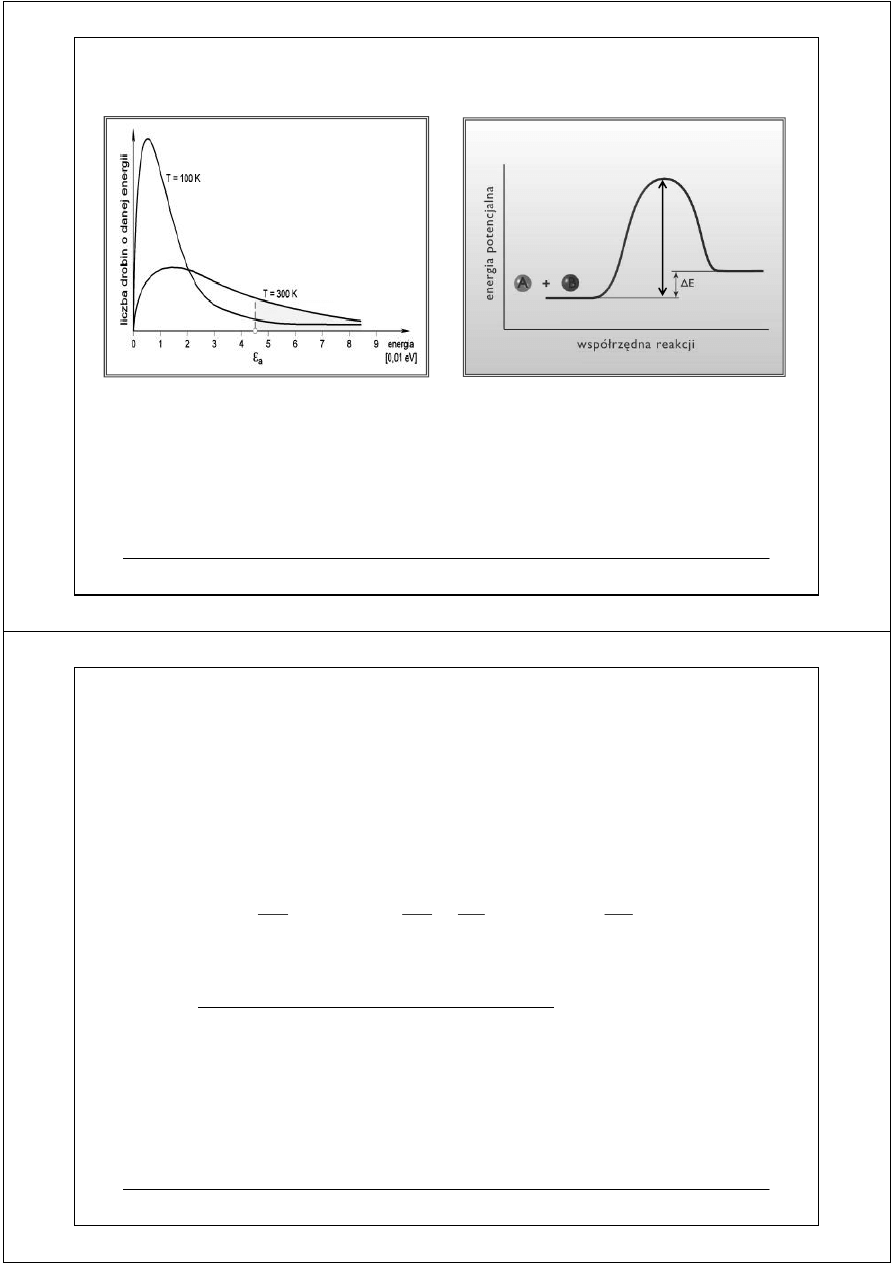
Rozkład prawdopodobieństwa występowania
cząsteczek o różnej energii.
Obszar zacieniony odpowiada liczbie
cząsteczek o energii równej lub większej
niż energia aktywacji E
a
dla dwóch
temperatur 100 K i 300 K.
E
a
Minimalna wartość energii, jaką muszą
posiadać zderzające się atomy lub cząsteczki,
aby doszło między nimi do reakcji
to energia aktywacji E
a
.
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Szybkość reakcji chemicznej v to zmiana stężenia
substratu lub produktu c w jednostce czasu t.
Czynniki decydujące o szybkości reakcji:
1) właściwości reagentów (stan skupienia, stopień
rozdrobnienia, rodzaj rozpuszczalnika),
2) stężenie reagujących substancji,
3) temperatura,
4) obecność katalizatora.
dt
dc
v
±
=
Szybkość reakcji chemicznej v jest proporcjonalna
do liczby zderzeń aktywnych N, czyli v = k · N
k – stała szybkości reakcji
t
c
v
Δ
Δ
±
=
dt
dc
=
Δ
Δ
→
Δ
t
c
lim
0
t

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Ad. 1)
♦ reakcje homogeniczne (jednofazowe)
2 NO + O
2
→ 2 NO
2
2 H
2
+ O
2
→ 2 H
2
O
CH
3
COOH + C
2
H
5
OH
→ CH
3
COOC
2
H
5
+ H
2
O
♦ reakcje heterogeniczne (wielofazowe)
2 Fe + O
2
→ 2 FeO
2 Na + Cl
2
→ 2 NaCl
Hg + S
→ HgS
♦ szybkość korozji Fe
(bryła)
a Fe
(proszek)
♦ reakcje w wodzie a w środowisku niewodnym
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Ad. 2)
a A + b B
→
c C
Rząd reakcji - suma wykładników potęg wszystkich reagentów,
których stężenia występują w równaniu kinetycznym
(tu rząd reakcji wynosi: R.r. =
α
+
β
).
k - stała szybkości reakcji lub szybkość właściwa
(zależy ona od temperatury i prawie we wszystkich
przypadkach rośnie z jej wzrostem)
♦
dla reakcji:
2 N
2
O
5
= 4 NO
2
+ O
2
β
B
α
A
c
c
k
v
⋅
⋅
=
5
2
O
N
c
k
v
⋅
=
a rząd tej reakcji: R.r. = 1
♦
reakcja:
2 NO
2
= 2 NO + O
2
2
NO
2
c
k
v
⋅
=
rząd reakcji: R.r. = 2
♦
reakcja:
H
2
+ I
2(g)
= 2 HI
2
2
I
H
c
c
k
v
⋅
⋅
=
rząd reakcji: R.r. = 2

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
♦
reakcja:
H
2
O
2
+ 2 HI
→
I
2
+ 2 H
2
O
zachodzi w dwóch etapach:
1 etap H
2
O
2
+ HI
→
HIO + H
2
O
(wolny)
2 etap HIO + HI
→
I
2
+ H
2
O
(szybki)
równanie kinetyczne dla tego procesu (1 etap):
HI
O
H
c
c
k
v
2
2
⋅
⋅
=
a rząd tej reakcji: R.r. = 2
R.r. = 4
♦
reakcja: 5 Br
−
+ BrO
3
−
+ 6 H
+
→
3 Br
2
+ 3 H
2
O
jest reakcją wieloetapową, a równanie kinetyczne najwolniejszego etapu:
2
H
BrO
Br
c
c
c
k
v
3
-
+
−
⋅
⋅
⋅
=
„O szybkości reakcji decyduje szybkość jej najwolniejszego etapu”
Cząsteczkowość - liczba cząsteczek, które muszą się zderzyć
w etapie decydującym o szybkości reakcji.
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
♦
Czy są reakcje ujemnego rzędu ?
♦
Czy są reakcje zerowego rzędu ?
Tak, np. rozkład amoniaku na gorącym drucie platynowym !
2 NH
3
→
N
2
+ 3 H
2
v = k
Są to reakcje, których szybkość jest niezależna od stężenia,
przebiegają ze stałą szybkością do momentu wyczerpania
substratu.
Tak, np. rozkład ozonu zachodzący w górnych warstwach atmosfery !
2 O
3
→
3 O
2
Równanie kinetyczne ma postać:
Ujemny rząd reakcji oznacza, że szybkość reakcji zmniejsza się
wraz ze wzrostem stężenia substancji – tu tlenu.
[Amoniak rozkłada się ze stałą szybkością, aż zostanie wyczerpany.]
-1
O
2
O
O
2
O
2
3
2
3
c
c
k
c
c
k
v
⋅
⋅
=
⋅
=
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Reakcja I rzędu:
A
→ B
można obliczyć wartość:
dt
dc
v
−
=
c
k
v
⋅
=
∫
∫
=
−
t
0
c
c
dt
k
c
dc
o
]
]
t
k
c
ln
t
0
c
c
o
⋅
=
−
t
k
)
c
ln
c
(ln
o
⋅
=
−
−
o
c
ln
t
k
c
ln
+
⋅
−
=
c
k
dt
dc
⋅
=
−
ln c
t
ln c
o
α
y = -a · x + b
tg
α = −k
c
c
ln
t
1
k
o
⋅
=
oraz tzw. czas połowicznej
przemiany (t
1/2
), tj. czas gdy:
o
c
c
2
1
=
k
0,693
k
2
ln
t
1/2
=
=
oraz
t
α
1
c
o
1
c
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Reakcja II rzędu:
2 A
→
B + C
można obliczyć wartość:
dt
dc
v
−
=
y = a · x + b
tg
α = k
oraz tzw. czas połowicznej
przemiany (t
1/2
), tj. czas gdy:
o
c
c
2
1
=
oraz
2
c
k
v
⋅
=
2
c
k
dt
dc
⋅
=
−
∫
∫
=
−
t
0
c
c
2
dt
k
c
dc
o
]
t
k
c
1
t
0
c
c
o
⋅
=
⎥⎦
⎤
t
k
c
1
c
1
o
⋅
=
−
o
c
1
t
k
c
1
+
⋅
=
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
−
⋅
=
o
c
1
c
1
t
1
k
o
1/2
c
k
1
t
⋅
=
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Ad. 3)
Równanie Arrheniusa:
A - stała charakteryzująca daną reakcję
(dla reakcji I rzędu ~10
14
s
−
1
)
E
a
- energia aktywacji
Reguła van't Hoffa - podwyższenie temperatury o 10 stopni powoduje
2
÷
4 - krotny wzrost szybkości reakcji.
T
R
E
a
e
A
k
⋅
−
⋅
=
T
R
E
A
ln
k
ln
a
⋅
−
=
α
ln k
T
1
R
E
tg
a
−
=
α
y = -a · x + b
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Ad. 4)
• kataliza homogeniczna
Katalizator - zmienia szybkość reakcji, jego rola polega na obniżeniu
energii aktywacji.
Inhibitor - (katalizator ujemny) substancja zmniejszająca szybkość reakcji.
Kataliza - zjawisko przyspieszania reakcji chemicznych przez katalizatory.
• kataliza heterogeniczna
CH
3
COOH + C
2
H
5
OH CH
3
COOC
2
H
5
+ H
2
O
2 H
2
O
2
2 H
2
O + O
2
MnO
2
H+
Autokataliza - szczególny przypadek katalizy, kiedy to jeden
z reagentów reakcji jest katalizatorem, np.:
2 MnO
4
−
+ 5 H
2
C
2
O
4
+ 6 H
+
→ 2 Mn
2+
+ 10 CO
2
+ 8 H
2
O
Enzymy - białka proste lub złożone pełniące w organizmach
żywych rolę biokatalizatorów, np.:
a-amylaza - katalizuje hydrolizę skrobi do glukozy
dehydrogenaza alkoholowa - etanol w aldehyd octowy
lipaza - hydroliza tłuszczów
zymaza - fermentacja glukozy
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
CH
2
= CH – CH = CH
2
ZnO, Cr
2
O
3
400
o
C
CH
3
COOH, H
2
, CO
CH
3
CHO, H
2
(C
2
H
5
)
2
O , H
2
O
C
2
H
5
OH
Cu
Cu
230
o
C
Al
2
O
3
350
o
C
Struktura typowego konwertora spalin w
układzie wydechowym samochodu.
Gazy przepływają przez pokryty
katalizatorem porowaty ceramiczny nośnik
o strukturze podobnej do plastra miodu.
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
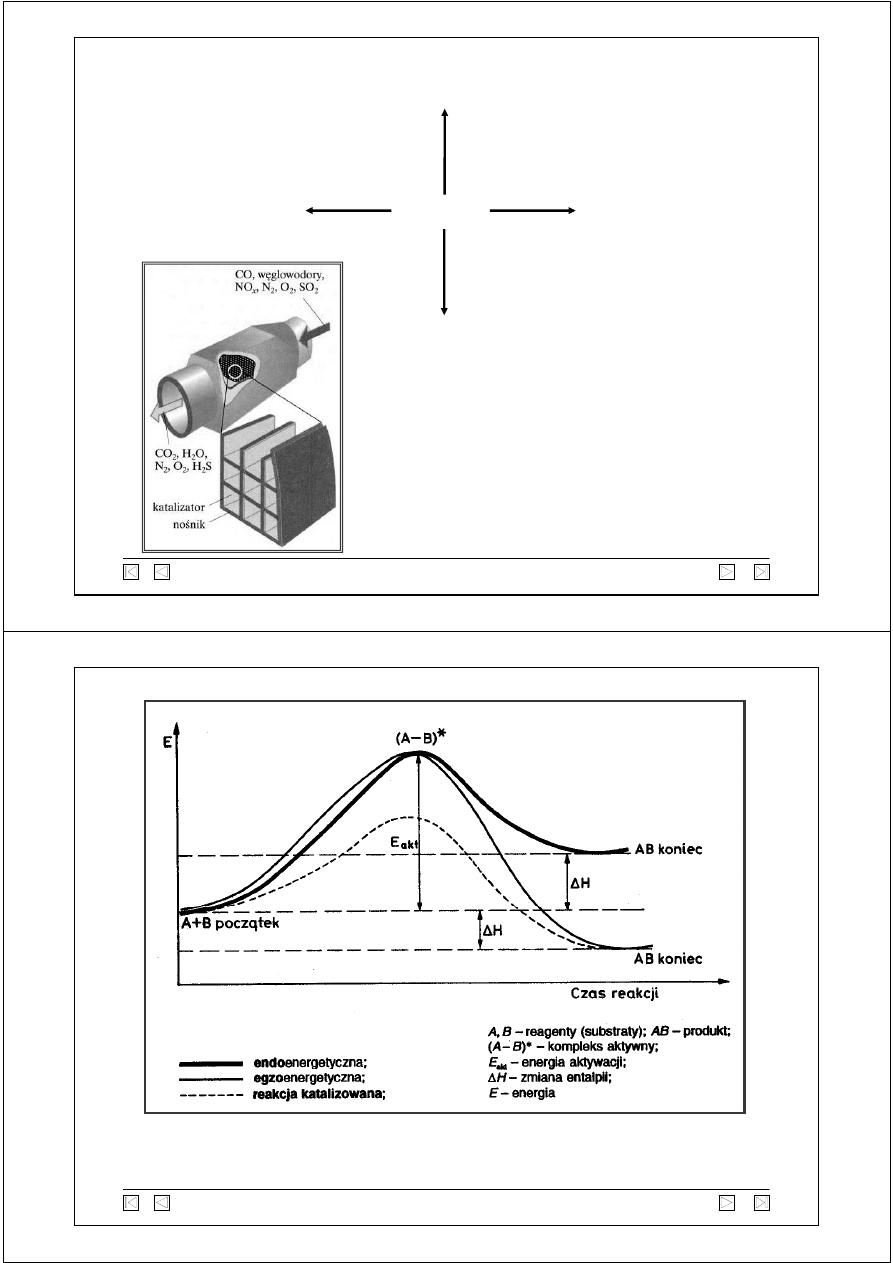
Profil energetyczny reakcji
(przebieg reakcji chemicznej pod względem energetycznym).
Wyszukiwarka
Podobne podstrony:
10 Kinetyka chemicznaid 10897 ppt
10 Kinetyka chemiczna i kataliza
10 wykad Statyka kinetyka chemiczna[F 2006]
Kinetyka Chemiczna
kinetyka chemiczna
4) Kinetyka chemiczna
Kinetyka chemiczna, CHEMIA, semestr 1, chemia ogólna, wykłady
10 wiązania chemiczne
chemia, kinetyka chemiczna, KINETYKA CHEMICZNA- 1
Kinetyka chemiczna
Laboratorium nr 9-10, Technologia chemiczna, Chemia ogólna i nieorganiczna, semestr 3, Laboratorium
Ćwiczenie 10.6, technologia chemiczna, Fizyczna, Labolatorium
więcej podobnych podstron