MATERIAŁY DO ĆWICZEŃ
CHEMIA ŻYWNOŚCI - I ROK DIETETYKA
Temat: Twardość wody, jej oznaczanie i usuwanie
1.
Wstęp
1.1.
Wskaźniki jakości wody przeznaczonej do spożycia
Woda pitna i przeznaczona na cele gospodarcze musi być bezpieczna pod względem
sanitarnym i zdrowotnym oraz wykazywać odpowiednie cechy sensoryczne. Woda nie
powinna zawierać drobnoustrojów chorobotwórczych, pasożytów ani innych żywych
organizmów w ilościach niebezpiecznych dla zdrowia. Nie może także zawierać
zanieczyszczeń chemicznych lub substancji naturalnego pochodzenia w ilościach
zagrażających zdrowiu człowieka, żadnych substancji w ilościach wpływających na jej smak,
zapach, barwę, mętność oraz nie może zawierać widocznych zanieczyszczeń stałych.
Zalecenia WHO dotyczące wody pitnej obejmują głównie wskaźniki:
- bakteriologiczne,
- substancje chemiczne o zdrowotnym znaczeniu (organiczne i nieorganiczne),
- pestycydy,
- składniki radioaktywne,
- substancje chemiczne niemające wpływu na zdrowie w stężeniach normalnie
występujących w wodzie,
- substancje i wskaźniki, które nie mają znaczenia zdrowotnego, ale mogą obniżać jakość
sensoryczną wody.
Parametry objęte monitoringiem kontrolnym
Woda pochodząca z ujęć powierzchniowych
Woda pochodząca z ujęć podziemnych
PARAMETRY FIZYCZNE I ORGANOLEPTYCZNE
Barwa
Barwa
Mętność
Mętność
pH
pH
Przewodność
Przewodność
Zapach
Zapach
Smak
Smak
PARAMETRY CHEMICZNE
Amonowy jon
Amonowy jon
Azotany (V)
Azotany (V)
Azotany (III)
Azotany (III)
Chlor wolny
Chlor wolny
Suma chloranów i chlorynów
Suma chloranów i chlorynów
Glin
Glin
Mangan
Ż
elazo
PARAMETRY MIKROBIOLOGICZNE
Escherichia coli
Escherichia coli
Enterokoki
Enterokoki
Bakterie grupy coli
Bakterie grupy coli
Clostridium perfringens łącznie ze sporami

1.2.
Twardość wody i sposoby jej wyrażania
Twardość wody wywołana jest obecnością rozpuszczalnych w wodzie soli wapniowych i
magnezowych. Sole wapnia i magnezu dostają się do wody w wyniku kontaktu zawartego w
niej dwutlenku węgla z glebą i skałami zawierającymi wapienie i magnezyty. Wówczas
trudno rozpuszczalne w wodzie wapienie i magnezyty przekształcają się w dobrze
rozpuszczalne w wodzie wodorowęglany wapnia i magnezu.
Przebieg reakcji zwanej wietrzeniem wapieni:
CaCO
3
+ CO
2
+ H
2
O = Ca(HCO
3
)
2
MgCO
3
+ CO
2
+ H
2
O = Mg(HCO
3
)
2
Wodorowęglany wapnia i magnezu powodują tzw. twardość węglanową wody zwaną
twardością przemijającą (Tw
w
), natomiast siarczany i chlorki wapnia i magnezu (CaSO
4
,
MgSO
4
, CaCl
2
, MgCl
2
) powodują twardość trwałą (stałą) wody (Tw
n
). Suma twardości
przemijającej i trwałej stanowi ogólną twardość wody Tw
og
. Twardość przemijająca
powodowana
zawartością
wodorowęglanów
zanika
podczas
gotowania,
kiedy
wodorowęglany przechodzą w nierozpuszczalne węglany.
Twardość wody ogólna = twardość wody przemijająca + twardość wody stała
Wszystkie wody naturalne zawierają większe lub mniejsze ilości chlorków, które mogą
pochodzić z gruntu, z pokładów naturalnych soli oraz zanieczyszczeń ściekami lub różnymi
odpadami pochodzenia zwierzęcego. W wodzie chlorki występują w postaci jonów
pochodzących z dysocjacji najczęściej obecnego w wodzie chlorku sodowego, potasowego i
chlorku wapnia. Według wymagań sanitarno-epidemiologicznych zawartość chlorków w
wodzie do picia nie powinna przekraczać 250 mg/dm
3
.
Sposoby wyrażania twardości wody – do określania ilości soli wapnia i magnezu
służy jednostka zwana stopniem twardości. Obowiązującą w Polsce jednostką twardości wody
jest miligramorównoważnik (miliwal) jonów wapniowych lub magnezowych zawarty w 1dm
3
wody.
1º twardości miliwalowej = 20mg jonów Ca
2+
/dm
3
lub = 12 mg jonów Mg
2+
/dm
3
H
2
O
1º twardości (niemiecki) = 10mg CaO/dm
3
H
2
O
1º twardości (francuski) = 10mg CaCO
3
/dm
3
H
2
O
1º twardości (niemieckiej) = 0,357 miliwali CaO/dm
3
H
2
O
1 miliwal CaO/dm
3
H
2
O = 2,8ºn.
Twardość wód naturalnych waha się w szerokich granicach od 3 do 30ºn. Wody uzdatniane
mogą mieć twardość bliską 0.
Opisowe określenia skali twardości wody
TWARDOŚĆ OGÓLNA
SKALA TWARDOŚCI
mval/dm
3
STOPIEŃ TWARDOŚCI
0 - 1.78
0 - 5
bardzo miękka
1.78 - 3.57
5 - 10
miękka
3.57 - 5.35
10 - 15
o średniej twardości
5.35 - 7.13
15 - 20
o znacznej twardości
7.13 - 10.70
20 - 30
twarda
> 10.70
> 30
bardzo twarda
1.3.
Metody usuwania twardości wody
Wodorowęglany wapnia i magnezu powodujące twardość przemijającą łatwo można usunąć z
wody przez gotowanie. Zachodzi wówczas rozkład wodorowęglanów zgodnie z reakcjami:
Ca(HCO
3
)
2
= CaCO
3
↓+ H
2
O + CO
2
↑
Mg(HCO
3
)
2
= MgCO
3
↓
+ H
2
O + CO
2
↑
MgCO
3
+ H
2
O = Mg(OH)
2
↓
+ CO
2
↑
Ten jednak sposób usuwania twardości przemijającej nie jest korzystny dla wody do celów
przemysłowych, gdyż wytrącanie się trudno rozpuszczalnego CaCO3 jest przyczyną
powstawania kamienia kotłowego. Kamień kotłowy jest mieszaniną różnych substancji, w
której obok węglanu wapnia występuje węglan magnezu, wodorotlenek magnezu,
siarczan(VI) wapnia, odwodniony kwas krzemowy czyli tzw. krzemionka oraz tlenki żelaza.
W zależności od tego, który rodzaj związku występuje w przeważającej ilości wyróżnia się
następujące jego odmiany: kamień węglanowy, kamień siarczanowy, kamień krzemianowy.
Zmiękczanie wody polega na usuwaniu z niej jonów powodujących twardość tj. jonów Ca
2+
,
Mg
2+
a także jonów innych metali jak Fe
2+
, Mn
2+
, Al
3+
. Główne metody zmiękczania wody:
- destylacja,
- metody termiczne,
- metody chemiczne,
- metody fizyko-chemiczne.
Destylacja daję wodę idealnie zmiękczoną, pozbawioną wszelkich soli.
Metody termiczne polegają na podgrzaniu wody do 100ºC, bowiem wówczas następuje
rozkład wodorowęglanów wapnia i magnezu, z wydzieleniem trudno rozpuszczalnego
węglanu wapnia, węglanu magnezu i wodorotlenku magnezu.
Metody chemiczne polegają na strącaniu nierozpuszczalnych osadów. Jedną z metod jest
metoda sodowo-wapienna, twardość przemijająca usuwana jest wapnem (1), soda natomiast
usuwa twardość trwałą (2) reakcja z siarczanem wapnia i chlorkiem magnezu.

(1)
Ca(HCO
3
)
2
+ Ca(OH)
2
= 2CaCO
3
↓
+ 2H
2
O
Mg(HCO
3
)
2
+ Ca(OH)
2
= MgCO
3
↓
+ CaCO
3
↓
+ 2H
2
O
MgCO
3
+ Ca(OH)
2
= Mg(OH)
2
↓
+ CaCO
3
↓
(2)
CaSO
4
+ Na
2
CO
3
=CaCO
3
↓
+ Na
2
SO
4
MgCl
2
+ Na
2
CO
3
= MgCO
3
↓
+ 2NaCl
W obu reakcjach zmiękczania powstają nierozpuszczalne węglany wapnia i magnezu w
postaci osadu odfiltrowywanego.
Do metod chemicznych zalicza się także metodę z mocnymi kwasami
Ca(HCO
3
)
2
+ 2HCl = CaCl
2
+ 2H
2
O + 2CO
2
↑
Mg(HCO
3
)
2
+ 2HCl = MgCl
2
+ 2H
2
O + 2CO
2
↑

2.
Wykonanie ćwiczenia
Ocena chemiczna jakości wody.
Ć
wiczenie 1. Sprawdzanie zasadowości wody
Do zlewki pobrać około 50 cm
3
analizowanej wody, zanurzyć elektrodę pehametru i wykonać
pomiar. Po każdym pomiarze dokładnie osuszyć elektrodę przy pomocy bibuły filtracyjnej.
Ć
wiczenie 2. Oznaczanie zawartości chlorków metodą Mohra
Azotan (V) srebra z jonami chlorkowymi (Cl
-
) strąca trudno rozpuszczalny w wodzie chlorek
srebra. W roztworze obojętnym w obecności chromianu (VI) potasowego chlorki początkowo
strącają się jako AgCl i gdy zostaną całkowicie wytracone, dalsze dodawanie azotanu srebra
spowoduje powstawanie czerwonego osadu chromianu srebra (Ag
2
CrO
4
), przy czym powstaje
brunatne zabarwienie roztworu. Zmiana zabarwienia roztworu wskutek powstawania
chromianu srebra świadczy o zakończonym miareczkowaniu. Oznaczenie utrudnia znacznie
obecność siarkowodoru, siarczków, siarczanów i fosforanów.
Ag
+
+ Cl
-
→
AgCl
2Ag
+
+ CrO
4
→
Ag
2
CrO
4
Wykonanie oznaczenia:
Pobrać do kolby stożkowej 100 cm
3
wody, dodać 1 cm
3
roztworu chromianu potasowego
(K
2
CrO
4
) jako wskaźnika i miareczkować roztworem azotanu srebra (AgNO
3
).
Miareczkowanie kończy się w momencie pojawienia się brunatno-czerwonego zabarwienia
roztworu.
Zawartość jonów chlorkowych w wodzie oblicza się ze wzoru:
X = V
AgNO
3
/M
Cl
gdzie:
V
AgNO
3
– objętość azotanu srebra zużyta do miareczkowania analizowanej próby
M
Cl
– masa molowa chloru (35.46 g/mol)
Ć
wiczenie 3. Oznaczanie twardości ogólnej metodą wersenianową
Jony wapnia i magnezu tworzą trwałe kompleksy z wersenianem sodowym (EDTA).
Wskaźnikiem w reakcji jest czerń erichromowa, która w środowisku zasadowym pH ok. 10
daje z jonami wapnia i magnezu nietrwałe kompleksy o barwie fioletowej. W czasie
miareczkowania roztworem EDTA następuje rozkład kompleksów ze wskaźnikiem i barwa
zmienia się na niebieską (barwa wskaźnika).
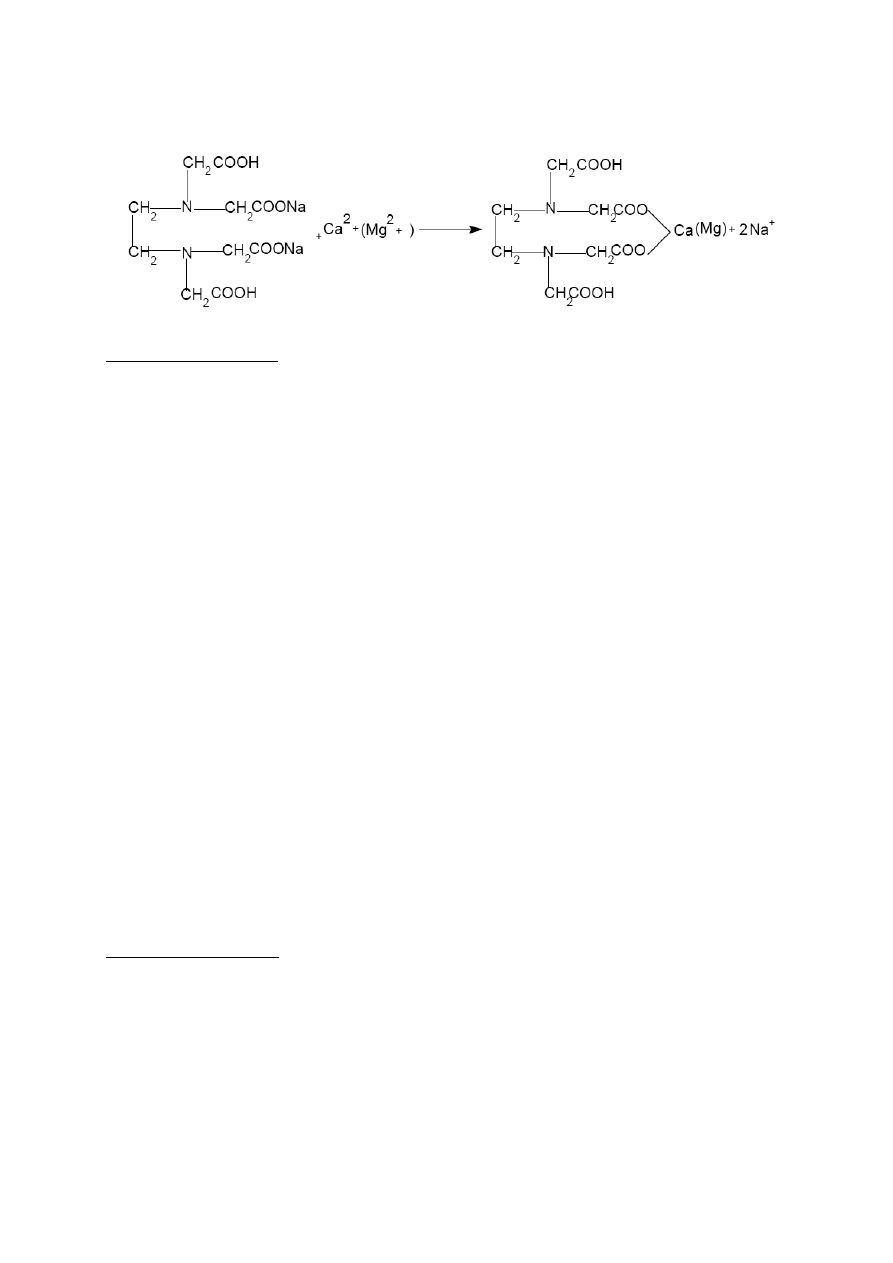
Reakcja jonów wapnia i magnezu z wersenianem disodowym.
Wykonanie oznaczenia:
Do kolby stożkowej pobrać 100 cm
3
wody, dodać 1 cm
3
buforu amoniakalnego o pH 10 i 5
kropli czerni erichromowej i natychmiast rozpocząć miareczkowanie roztworem 0.02M
EDTA. Z chwilą pojawienia się fioletowo-niebieskiego zabarwienia roztworu, dodawać
EDTA powoli kroplami, energicznie mieszając. Trwała zmiana barwy na niebieską świadczy
o zakończeniu reakcji.
Twardość wody ogólną (Tw
og
) oblicza się ze wzoru:
Tw
og
= (A x C x 56.8 x 100)/V
gdzie:
A – ilość roztworu EDTA zużyta do miareczkowania (cm
3
)
C – stężenie roztworu EDTA (mol/l)
V – ilość wody wzięta do oznaczenia (cm
3
)
56.8 – masa molowa CaO (g/mol)
Ć
wiczenie 4. Oznaczanie zawartości wapnia
Wskaźnikiem używanym w reakcji jest sól amonowa kwasu purpurowego (mureksyd), która
w środowisku silnie zasadowym (pH > 13) tworzy z jonami Ca
2+
nietrwały kompleks o
barwie różowo-czerwonej. W czasie miareczkowania roztworem EDTA następuje wypieranie
wapnia z kompleksu ze wskaźnikiem, co powoduje zmianę zabarwienia roztworu na
niebiesko-fioletowe.
Wykonanie oznaczenia:
Do 100 cm
3
wody dodać 10 cm
3
1M NaOH oraz 5 kropli wskaźnika – mureksydu (pojawi się
barwa różowo-czerwona), natychmiast rozpocząć miareczkowanie roztworem 0.02M EDTA
do zmiany barwy na fioletowo-niebieską.
Zawartość wapnia w g/ dm
3
oblicza się ze wzoru:
m
Ca
= (40 x A x c)/V

gdzie:
A – ilość roztworu EDTA zużyta do miareczkowania (cm
3
)
c – stężenie roztworu EDTA (mol/l)
V – ilość próbki wody wzięta do analizy (cm
3
)
40 – masa molowa Ca (g/mol)
Ć
wiczenie 5. Oznaczanie zawartości magnezu
Zawartość magnezu w analizowanej próbie wody wyznacza się z różnicy ilości moli EDTA
zużytego do związania sumy jonów wapnia i magnezu w oznaczaniu Tw
og
a ilością moli
EDTA wiążącą jony wapniowe w tej samej objętości próby.
Zawartość magnezu w g/ dm
3
oblicza się ze wzoru:
m
Mg
= (24 x (A-B) x c)/ 100
gdzie:
A – ilość roztworu EDTA zużyta w czasie oznaczania Tw
og
(cm
3
)
B – ilość roztworu EDTA zużyta w czasie oznaczania zawartości wapnia (cm
3
)
c – stężenie roztworu EDTA (mol/l)
24 – masa molowa Mg (g/mol)
Wyszukiwarka
Podobne podstrony:
Cw 3 WODA
cw 4 Woda w glebie
Cw.3 WODA
dietetyka cw 1
Cw 3 WODA
cw 4 Woda w glebie(1)
konspekt ćw. 9, Udostępnione, Dietetyka
podstawy cw 3, Studia - materiały, semestr 7, Podstawy żywienia, Dietetyka, Laborki
NEUROFIZJOLOGIA ćw. 1 - zagadnienia opracowane, Dietetyka CM UMK, Fizjologia
Ekologia laboratoeium woda ćw 2popr
Konspekt ćw. 4, Udostępnione, Dietetyka
SKJZ Z1 CW 29.09, Dietetyka 2012,2013, Systemy kontroli jakości żywności
woda, studium- kosmetyka, Dietetyka
diet-cw-1-sciąga, weterynaria, 5 rok semestr 1, dietetyka
cw 2, Dietetyka CM UMK, Chemia ogólna i żywności
cw 2 Dietetyka zrebiat
więcej podobnych podstron