Analiza Instrumentalna
2012/2013
Dr hab. Bożena Tyrakowska, prof. nadzw. UEP
Dr. hab. Ewa Sikorska, prof. nadzw. UEP
Literatura (podstawowa)
1. W. Szczepaniak: Metody instrumentalne w analizie chemicznej.
PWN, Warszawa 2002, 2005, 2008.
2. A. Koziołowa: Analiza instrumentalna. Wybrane metody optyczne.
Skrypty do wykładów i ćwiczeń. Poznań 1993-1999.
3. A. Cygański: Metody spektroskopowe w chemii analitycznej. WNT,
Warszawa 2002.
4. A. Gliszczyńska, K. Melski, P. Szafer, M.M. Szafran: Wybrane
metody instrumentalne. AE w Poznaniu, Pomocnicze materiały
dydaktyczne Nr 72, Poznań 1995.
5. Z. Witkiewicz: Podstawy chromatografii. WNT, Warszawa 2000,
2005.
6. D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch: Podstawy chemii
analitycznej, 2. Przekład pod red A. Hulanicki, PWN, W-wa 2006
Charakterystyka przedmiotu
Celem wykładu jest:
• zapoznanie studentów z powszechnie
stosowanymi metodami instrumentalnymi,
aparaturą, metodyką pomiarów i
zastosowaniem metod,
• kształtowanie umiejętności zastosowania
poszczególnych metod w ocenie jakości i
bezpieczeństwa surowców i wyrobów
.
• Wstęp do metod spektroskopowych.
Spektrofotometria UV VIS - ilościowe
metody absorpcjometryczne
• Spektrofotometria w podczerwieni (IR)
• Fluorymetria
• Nefelometria i turbidymetria
• Spektrometria atomowa.
• Chromatografia gazowa (GC)
• Wysokosprawna chromatografia
cieczowa (HPLC)
• Pomiar barwy
• Refraktometria
• Polarymetria
Program wykładów
Analiza Instrumentalna.Wstęp
Literatura (metody spektroskopowe)
:
1.
W. Szczepaniak: Metody instrumentalne w analizie chemicznej. PWN,
Warszawa 2002, 2005, 2008
2.
A. Koziołowa: Analiza instrumentalna. Wybrane metody optyczne.
Skrypt do wykładów. AE, Poznań 1999.
3.
Z. Kęcki: Podstawy spektroskopii molekularnej. PWN, Warszawa 1998.
4.
A. Cygański: Metody spektroskopowe w chemii analitycznej. WNT,
Warszawa 2002.
Wstęp do metod optycznych
(spektroskopowych)
• Klasyfikacja metod instrumentalnych
• Wstęp do metod spektroskopowych:
- promieniowanie EM, jednostki i ich wzajemne zależności,
- rejony absorpcji promieniowania EM.
- nieabsorpcyjne i absorpcyjne oddziaływanie światła z materią,
- absorpcja i emisja promieniowania,
- energia cząsteczek, poziomy energetyczne,
przejścia elektronowe, oscylacyjne, rotacyjne, widma absorpcji,
- powstawanie i parametry pasm spektroskopowych (absorpcji),
Plan wykładu:
Klasyfikacja metod analitycznych
• klasyczne –
opierają się na reakcjach chemicznych
• instrumentalne –
opierają się na charakterystycznej dla
badanej substancji właściwości fizycznej/fizykochemicznej
analiza jakościowa - CO?- identyfikacja-
na podstawie określonej
liczbowo właściwości fizykochemicznej
analiza ilościowa – ILE?- stężenie –
na podstawie zależności pomiędzy
mierzoną właściwością fiz-chem.
a stężeniem oznaczanej substancji
Właściwości fizyko-chemiczne wykorzystane w metodach instrumentalnych
Charakterystyczne właściwości
Metody instrumentalne
absorpcja promieniowania
spektrofotometria i fotometria
(rentgenowska, UV, VIS, IR); jądrowy
rezonans magnetyczny (NMR); elektronowy
rezonans magnetyczny (EPR) \
emisja promieniowania
spektroskopia emisyjna (rentgenowska, UV,
VIS); fluorescencja, fosforescencja
rozproszenie promieniowania
turbidymetria; nefelometria; spektroskopia
Ramana
załamanie promieniowania
refraktometria; interferometria
ugięcie promieniowania
spektrometria rentgenowska
skręcenie promieniowania
polarymetria
potencjał elektryczny
potencjometria
prąd elektryczny
polarografia
opór elektryczny
konduktometria
stosunek masy do ładunku
spektrometria masowa
szybkość reakcji
metody kinetyczne
Rodzaje metod instrumentalnych
•
METODY OPTYCZNE (spektroskopowe)
•
METODY ELEKTROCHEMICZNE
•
METODY CHROMATOGRAFICZNE
•
METODY INNE: np.:
SPEKTROMETRIA MAS
METODY TERMOANALITYCZNE
METODY RADIOIZOTOPOWE
Klasyfikacja metod instrumentalnych
Metody optyczne
= spektroskopowe
Metody oparte na oddziaływaniu promieniowania
elektromagnetycznego z materią
Zachodzi wymiana (zmiana)
energii promieniowania
- zmienia się zarówno energia substancji
jak i energia promieniowania EM
Nie zachodzą zmiany energii
promieniowania EM, a jedynie
zmiany kierunku
Metody:
- większość pomiarów analitycznych
szczególnie związane z
absorpcją i emisją
Metody:
- refraktometria,
- interferometria,
- mikroskopia optyczna,
- polarymetria,
- nefelometria
Częstość -
(częstotliwość) -
ν
(cykle/sek), np. w Hz (1 Hz = s
-
dla VIS
ν
≈ 10
14
Hz
Liczba falowa
- (ilość pełnych drgań/jedn.długości),
np. na 1 cm
dla VIS -
≈ 20,000 cm
-1
Długość fali -
λ
(jedn.długości)
dla VIS
λ ≈ 5x10
-5
m = 500 nm
U w a g a : długość fali nie jest
proporcjonalna do energii
Jednostki promieniowania EM
( )
ν
liczbą falową
:
prędkością światła w
próżni (C - w cm/sek) i
częstością :
ν
C
λ
=
( )
ν
;
ν
1
λ
=
Związek długość fali (
λ) z:
Energię promieniowania
można przeliczyć również na inne jednostki energii, np. cal, J i in.
λ
C
ν
=
λ
1
ν
=

Inny sposób opisu promieniowania elektromagnetycznego:
promieniowanie EM jako strumień cząstek – fotonów.
Fotony niosą ze sob
ą
ściśle określoną energię, którą wyraża
równanie Plancka:
E = h
ν = h· c/λ = hνc
E – energia promieniowania
h – stała Plancka (energia razy czas), h = 6,626·10
–34
J· s
ν - liczba falowa [cm
–1
]
Równanie Plancka łączy falową i korpuskularną naturę promieniowania
elektromagnetycznego poprzez określenie cechy korpuskularnej, którą jest energia
fotonu, za pomocą cechy falowej, którą jest częstość
ν, liczba falowa
i długość fali
λ.
λ
C
ν
=
( )
ν
Rejony promieniowania EM
Warunek : interakcja pola elektrycznego lub magnetycznego promieniowania
polem elektrycznym lub magnetycznym cząstek.
Oddziaływanie wynika z rayleighowskiego (Rayleigh) rozpraszania światła
pojawienia się indukowanego momentu dipolowego (
μ
ind
):
μ
ind
=
αE
indukowany dipol drga z częstością
padającego promieniowania
Jeśli częstość prom. nie odpowieda poziomom energetycznym cząsteczki nie
zachodzą zmiany energii promieniowania dipol staje się natychmiast (10
-
15
s) źródłem promieniowania wtórnego, we wszystkich kierunkach, o częstości =
padającego promieniowania
Promieniowanie wtórne – podstawą zjawisk: załamanie, odbicie, rozproszenie
Oddziaływanie promieniowania EM z materią
•
nieabsorpcyjne – uniwersalne, sprężyste
•
absorpcyjne – selektywne
Oddziaływanie nieabsorpcyjne
Oddziaływanie absorpcyjne (selektywne)
Wynika z pochłonięcia energii promieniowania
odpowiadającej energii skwantowanych poziomów energetycznych
(o ściśle określonej energii) w poszczególnych systemach
elementarnych (jądro, atom, cząsteczka).
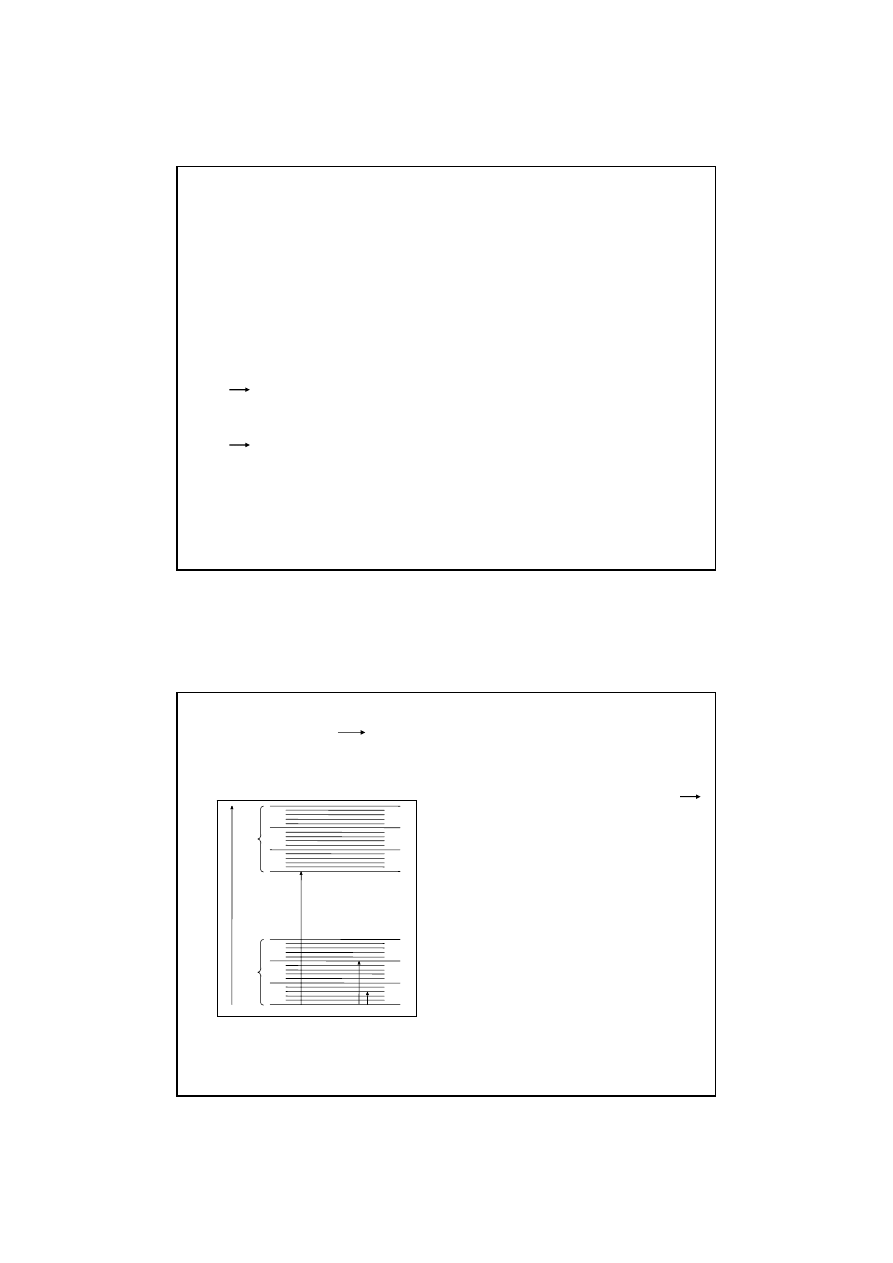
Poziomy energetyczne
Energie elektronów przyjmują jedynie określone wartości tzn. nie mogą się zmieniać
w sposób ciągły. (np..energia piłki).
Atom posiada szereg poziomów energetycznych. Stan o najniższej energii – stan
podstawowy (E
0
),
pozostałe są stanami wzbudzonymi
Rys. Rozkład poziomów energetycznych w atomie
Atom może znaleźć się w stanie wzbudzonym (np. E
1
,E
2
) pobierając (absorbując)
energię
(tylko określonymi porcjami = kwantami).
Powrót do stanu podstawowego – emisja
kwantu prom.EM.
E
0
E
1
E
2
E
3
absorpcja
emisja
Na całkowitą energię cząsteczki składają się energie związane z
różnymi rodzajami ruchu:
• Energia translacji
przemieszczenie molekuł w przestrzeni
• Energia rotacji
wirowanie/obrót molekuły wokół własnej osi
(model mechaniczny: wirujący bąk)
• Energia oscylacji
drgania atomów wokół położenia równowagi (drganie
kulek połączonych sprężynami)
• Energia elektronowa
związana z położeniem elektronów, rodzajem
utworzonych wiązań i odl. pomiędzy jadrami atomów w
cząsteczce
E = E rot + E osc + E el
E el
> > E osc > > E rot
Formy energii cząsteczek
Układy makroskopowe zmieniają swoją energię w sposób ciągły
W mikroświecie energia jest skwantowana
Wszystkie formy energii cząsteczek przyjmują określone wartości –
są skwantowane - cząsteczka może znajdować się na ściśle
określonym poziomie energetycznym
energia cząsteczki zmienia się skokowo
pobieranie/oddawanie E odbywa się porcjami = kwantami
Tylko kwanty energii charakterystyczne dla danej cząsteczki mogą
zostać przez nią pochłonięte (absorbowane).
Kwanty
< lub > w ogóle nie są pochłaniane
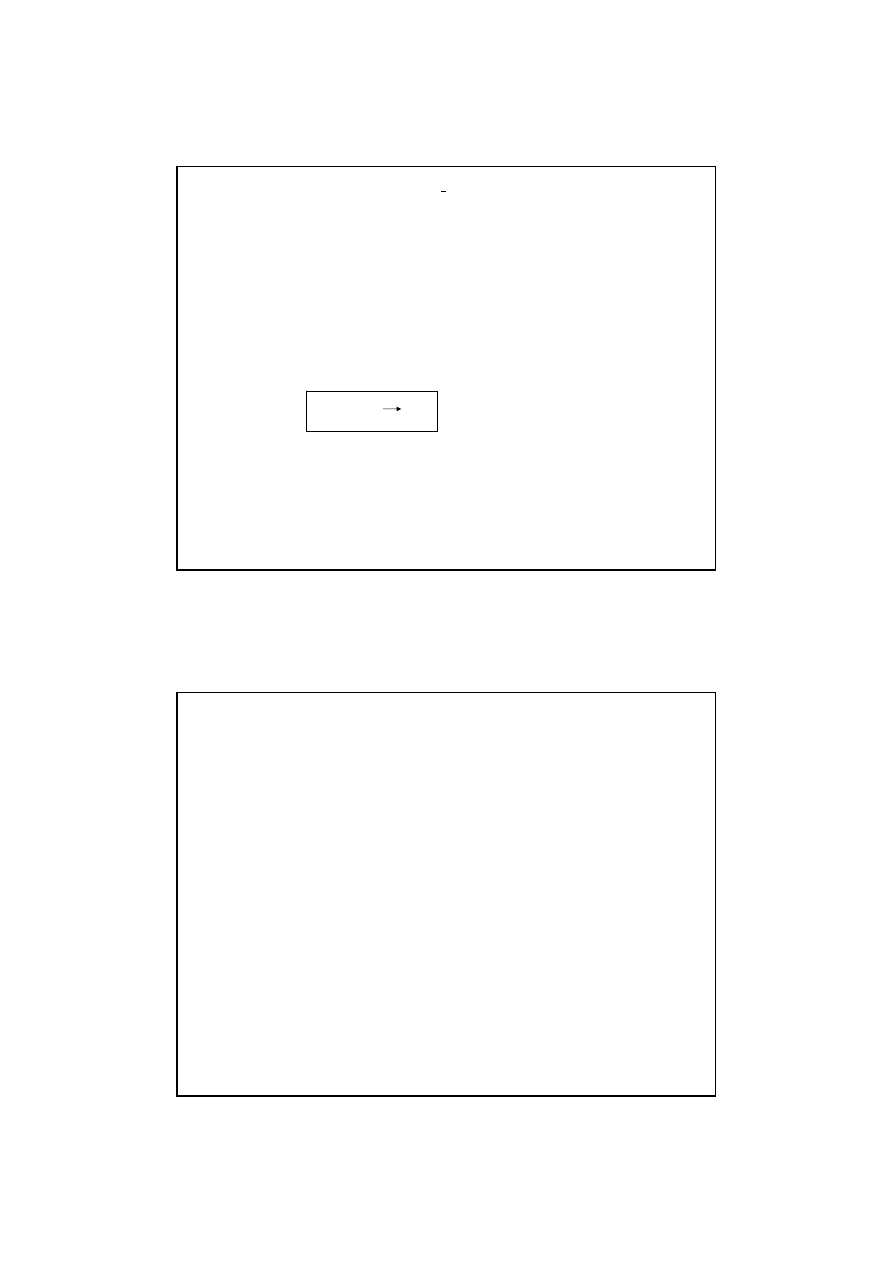
Poziomy energetyczne cząsteczek
Kwantowanie energii istnienie dozwolonych poziomów energetycznych
Cząsteczka/atom może się znajdować tylko na określonym, charakterystycznym
dla niej poziomie energetycznym (Rys.)
v
0
v
1
v
3
v
2
E
1
v
0
v
1
v
3
v
2
E
0
a
b c
en
er
gi
a
ΔΕ
1
Pochłanianie (absorpcja) energii
przejście na wyższe poziomy energet.
= wzbudzenie cząsteczki
Cząsteczka nie może znaleźć się w stanie
odp. wartości energii między poziomami
Odpowiednio do pochłoniętej energii
obserwujemy przejścia (rys):
• rotacyjne (c)
• oscylacyjno-rotacyjne (b)
• elektronowe (a)
Rys. Diagram poziomów elektronowych,
oscylacyjnych i rotacyjnych w cząsteczce i
odpowiadające im przejścia
Efektem są widma (wykresy zmian A):
• rotacyjne (zakres mikrofal),
• oscylacyjno-rotacyjne (podczerwień=IR)
• elektronowe (UV VIS, NIR)
Oddziaływanie absorpcyjne
(selektywne)
Wynika z pochłonięcia energii promieniowania odpowiadającej
energii skwantowanych poziomów energetycznych w poszczególnych
systemach elementarnych (atomy, czasteczki).
Ogólne warunki absorpcji:
-
interakcja pola elektrycznego lub magnetycznego promieniowania z polem
elektrycznym lub magnetycznym cząstek.
- kwant padającego promieniowania (h
ν) musi odpowiadać różnicy
poziomów energetycznych (
ΔE) atomu lub cząsteczki.
X + h
ν
X*
absorpcja energii
gdzie: h
ν
= E
k
– E
p
-------------------------- Ek
↑
Ek - Ep =
ΔE = h
ν
↓
--------------------------- Ep
X – atom, cząsteczka w stanie podstawowym, X* - w stanie wzbudzonym
Skala czasowa oddziaływania:
absorpcja energii: X + h
ν →X* - ok. 10
-15
s
•
degradacja energii
- w zderzeniach: X* → X + ciepło – ok. 10
-12
sek
- na drodze promienistej – emisja: X
*
→ X + h
ν - ok. 10
-9
sek
X – atom, cząsteczka w stanie podstawowym, X* - w stanie wzbudzonym
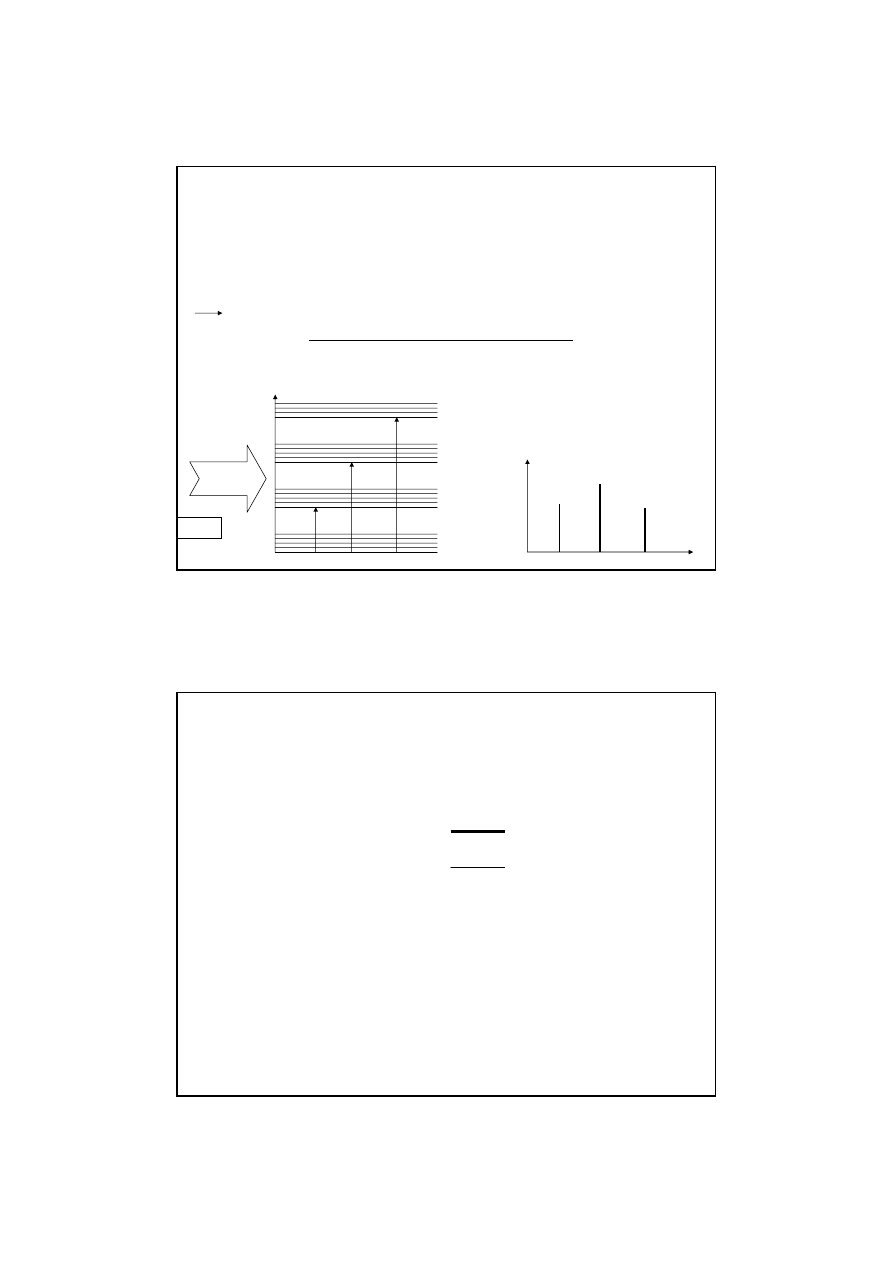
Metody spektroskopowe opierają się na absorpcji lub emisji kwantów energii
dokładnie odpowiadających
ΔE między dwoma poziomami energetycznymi
niższym i wyższym
cząsteczka ze zbioru fotonów na nią padających, o różnych
częstościach (
ν
n
) może zaabsorbować tylko określone fotony np.
ν
1
,
ν
2
,
ν
3
,
inne fotony nie są przez cząsteczkę pochłonięte
Teoretyczny zapis widma
Abs
ν
Powstawanie i kształt pasm spektroskopowych
0
1
2
3
ν
1
ν
2
ν
3
E
ν
1
,
ν
2
,
ν
3
ν
4
...
ν
n
ν
1
ν
2
ν
3
E = h
ν
Kształt pasm spektroskopowych
ABS
tło
ν
3
ν
2
ν
1
Widmo teoretyczne
Widmo uzyskiwane
Rozmywanie linii w krzywe dzwonowe jest nieodłączną cechą
oddziaływania promieniowania EM z materią.
Wynika z:
¾Zasady nieoznaczoności Heisenberga,
¾Efektu Dopplera
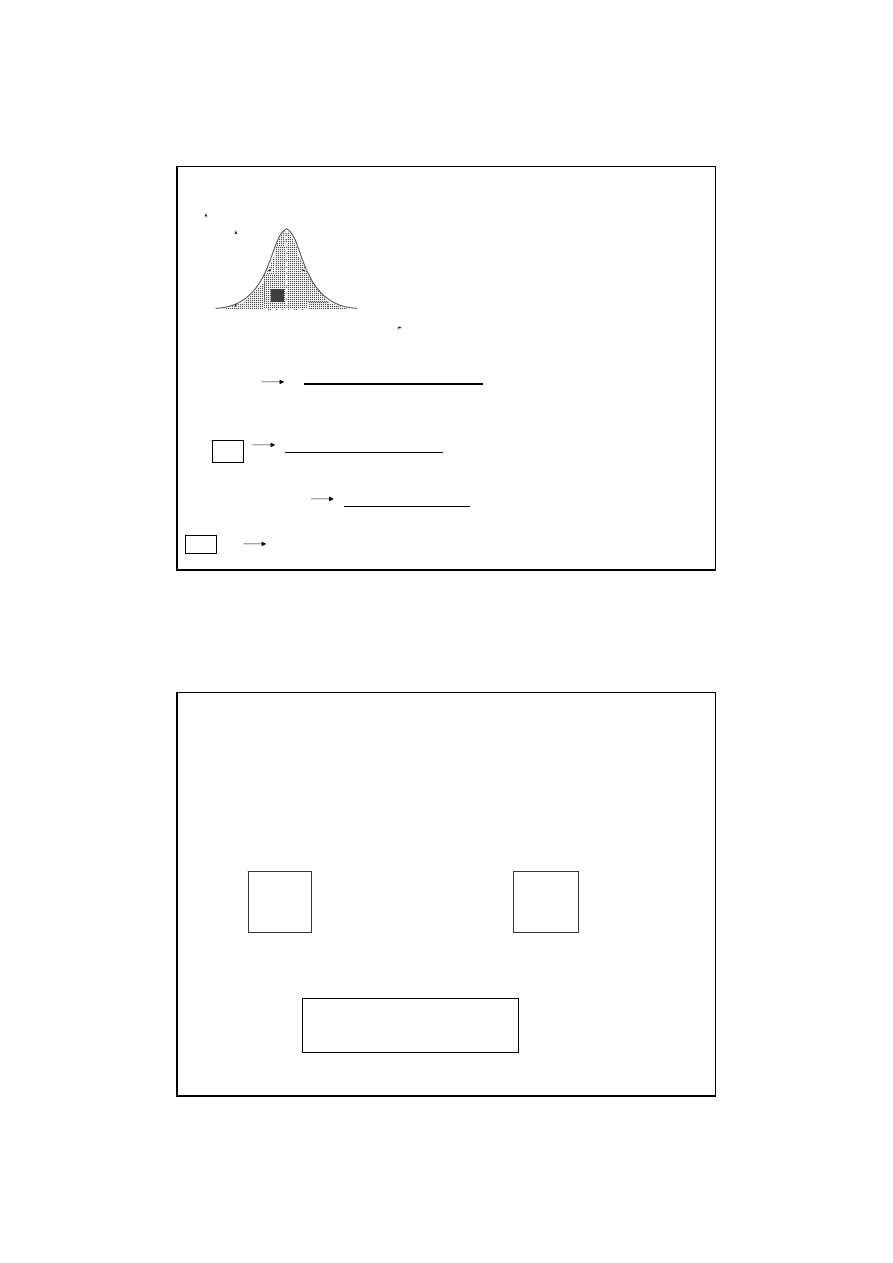
szerokość połówkowa- szerokość pasma absorpcji w połowie
jego wysokości
Parametry pasm spektralnych
I
tło
ν
ο
Δν
1/2
I
o
ν
1
ν
2
ν
I
∞
I = f(
ν
)
lub
I = f(
λ)
Częstotliwość
(l
falowa, dł fali) - częstotliwość osi symetrii konturu-
charakteryzuje położenie pasma względem innych w widmie; określa wielkość
kwantu energii (h
ν) potrzebnej do przejścia z jednego poziomu na drugi
−
0
0
0
,
,
λ
ν
ν
intensywność w maksimum - wysokość konturu - proporcjonalna do
liczby cząstek przeniesionych z niższego o na wyższy poziom energetyczny.
2
/
1
2
/
1
2
/
1
2
/
1
,
,
,
ν
λ
ν
ν
Δ
Io/C
intensywność molowa (Io/C =
ε
, gdzie C - stężenie próby,
ε
- absorpcyjność
molowa); uniezależnia wysokość pasma od stężenia próby (pozwala porównywać pasma).
I
0
Kontur pasma odpowiadający danemu
przejściu jest symetryczną krzywą
dzwonową, którą opisuje funkcja:
liczbą falową
:
prędkością światła w
próżni (C - w cm/sek) i
częstością :
ν
C
λ
=
( )
ν
;
ν
1
λ
=
Związek długość fali (
λ) z:
E = h
ν = h· c/λ = hνc
energią fotonu
ZAGADNIENIA EGZAMINACYJNE
WSTĘP DO METOD INSTRUMENTALNYCH
1. Klasyfikacja metod instrumentalnych..
2. Natura promieniowania elektromagnetycznego.
3. Absorpcyjne i nieabsorpcyjne oddziaływanie światła
z materią.
4. Absorpcja i emisja promieniowania.
5. Powstawanie i parametry pasm spektroskopowych
(pasm absorpcji).
Literatura (spis szczegółowy)
OPRACOWANIA OGÓLNE
1. W. Szczepaniak: Metody instrumentalne w analizie chemicznej. PWN,
Warszawa 2002, 2005, 2008.
2. A. Koziołowa: Analiza instrumentalna. Wybrane metody optyczne.
Skrypty do wykładów i ćwiczeń. Poznań 1993-1999.
3. D.A. Skoog, F.J. Holler, T.A. Nieman: Principles of Instrumental
Analysis. Saunders College Publishers, Philadelphia 1998, 2006.
4. H.H. Willard, L.L. Merritt Jr., J.A. Dean, F.A. Settle: Instrumental
Methods of Analysis. Wadsworth Publishing Company, Belmont,
California 1999.
METODY SPEKTROSKOPOWE
1. Z. Kęcki: Podstawy spektroskopii molekularnej. PWN, Warszawa 1998.
2. R.M. Silverstein, G.C. Bassler: Spektroskopowe metody identyfikacji
związków organicznych. PWN, Warszawa 1970 i nowsze wydania.
3. A. Cygański: Metody spektroskopowe w chemii analitycznej. WNT,
Warszawa 2002.
4. Praca zbiorowa pod red. W. Zieliński: Metody spektroskopowe i ich
zastosowanie do identyfikacji związków organicznych. WNT, Warszawa
2000.
SPEKTROMETRIA MASOWA
1. R.A.W. Johnstone, M.E. Rose: Spektrometria mas. Podręcznik dla
chemików i biochemików. PWN, 2001.
FOTOMETRIA I KOLORYMETRIA
1. A. Gliszczyńska, K. Melski, P. Szafer, M.M. Szafran: Wybrane metody
instrumentalne. AE w Poznaniu, Pomocnicze materiały dydaktyczne Nr 72,
Poznań 1995.
METODY ELEKTROCHEMICZNE
1. A. Cygański: Podstawy metod elektroanalitycznych. WNT, Warszawa 1999.
2. A. Kisza: Elektrochemia Tom I – Jonika. WNT, 2000.
3. A. Kisza: Elektrochemia Tom II – Elektrodyka. WNT, 2001.
CHROMATOGRAFIA
1. Z. Witkiewicz: Podstawy chromatografii. WNT, Warszawa 2000,2005.
2. Z. Witkiewicz, J. Hetper: Chromatografia gazowa. WNT, Warszawa 2001.
3. R. Rosset: Współczesna chromatografia cieczowa. Ćwiczenia i zadania.
PWN 2003.
Wyszukiwarka
Podobne podstrony:
badania operacyjne, w1 Wstęp
ćw 4 [ genom chloroplastowy ] bez tła
W1 Wstep
Tranzystory cz23 WERSJA DO WYDRUKU BEZ TŁA
Czwarty wykład 2014 bez tła
io w1 wstęp
Pierwszy wyklad 2014 bez tła
Tranzystory cz7 WERSJA DO WYDRUKU BEZ TŁA
SMED współczesne bez tła
Drugi wykład 2014 bez tła
w1 wstep, antropologia, notatki
Czwarty wykład cd 2014 bez tła
Metodyka wpajania dzieciom bezpiecznych zachowan bez tla
ewolucja czy statycznosc życia bez tła
kod do zegara bez tła
Szósty wykład 2014 bez tła
SO W1 Wstęp do systemów operacyjnych
w1 Wstęp
więcej podobnych podstron