
AKADEMIA ROLNICZA W SZCZECINIE
Wydział Nauk o śywności i Rybactwa
Zakład Opakowalnictwa i Biopolimerów
I N S T R U K C J A
Ć
W I C Z E N I E 7
Aminokwasy, peptydy, białka
(podstawowe właściwości i wybrane reakcje charakterystyczne)
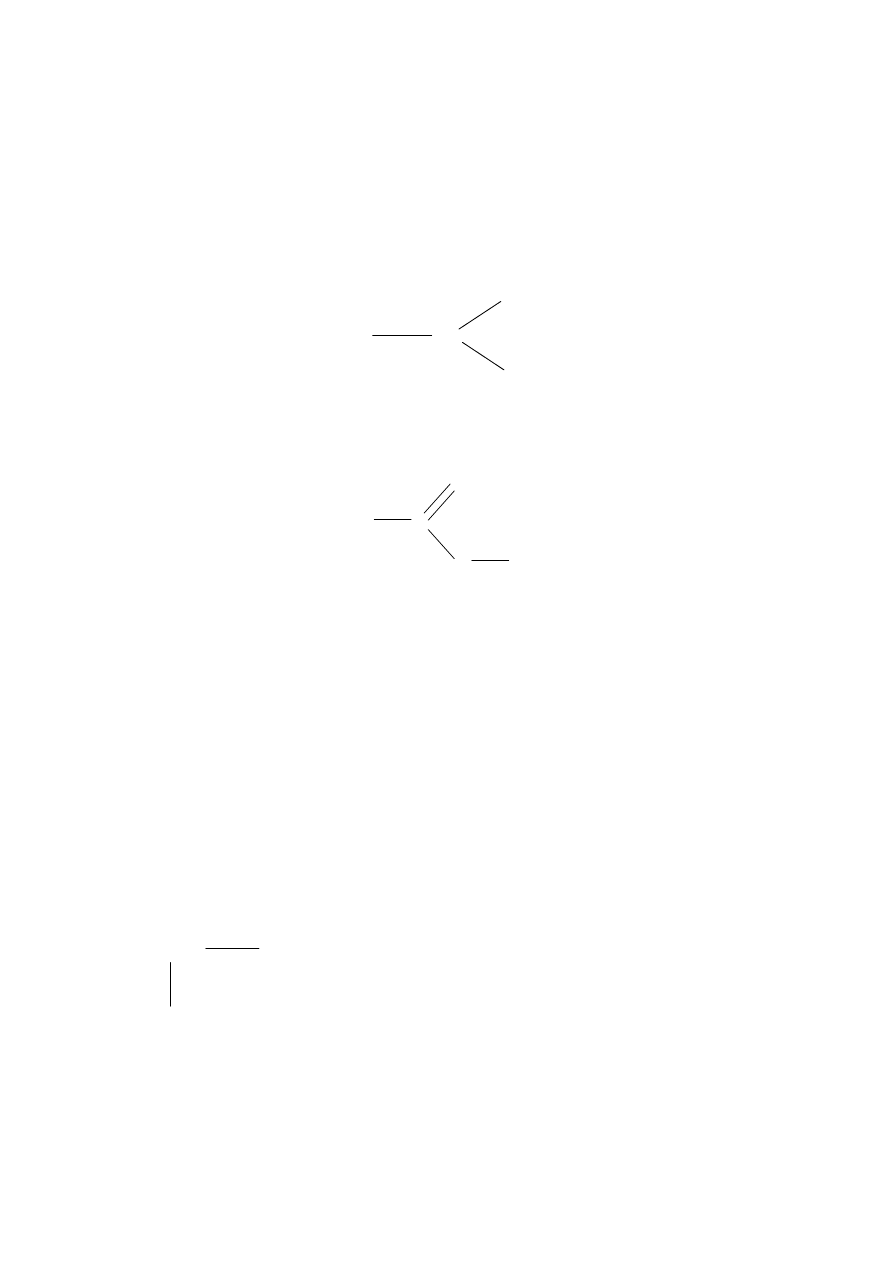
Białka
Aminokwasy
Aminokwasy są to związki dwufunkcyjne, których cząsteczki zawierają grupy
karboksylowe i aminowe:
grupa aminowa:
N
H
H
grupa karboksylowa:
C
O
O
H
Nomenklatura aminokwasów:
Naturalne aminokwasy posiadają nazwy zwyczajowe tworzone poprzez dodanie do nazwy
macierzystej przedrostka amino
−
:
np. NH
2
−
CH
2
−
COOH kwas aminooctowy (glicyna)
Nazewnictwo zwyczajowe tworzy się podobnie jak fluorowco
−
lub hydroksokwasów; np.
NH
2
−
CH
2
−
COOH kwas aminoetanowy, kwas
α−
aminooctowy
Podział
Ze względu na skład chemiczny
•
obojętne (zawierają jedną grupę karboksylową i jedną aminową)
np.:
C H
2
C O O H
NH
2
glicyna (Gly)
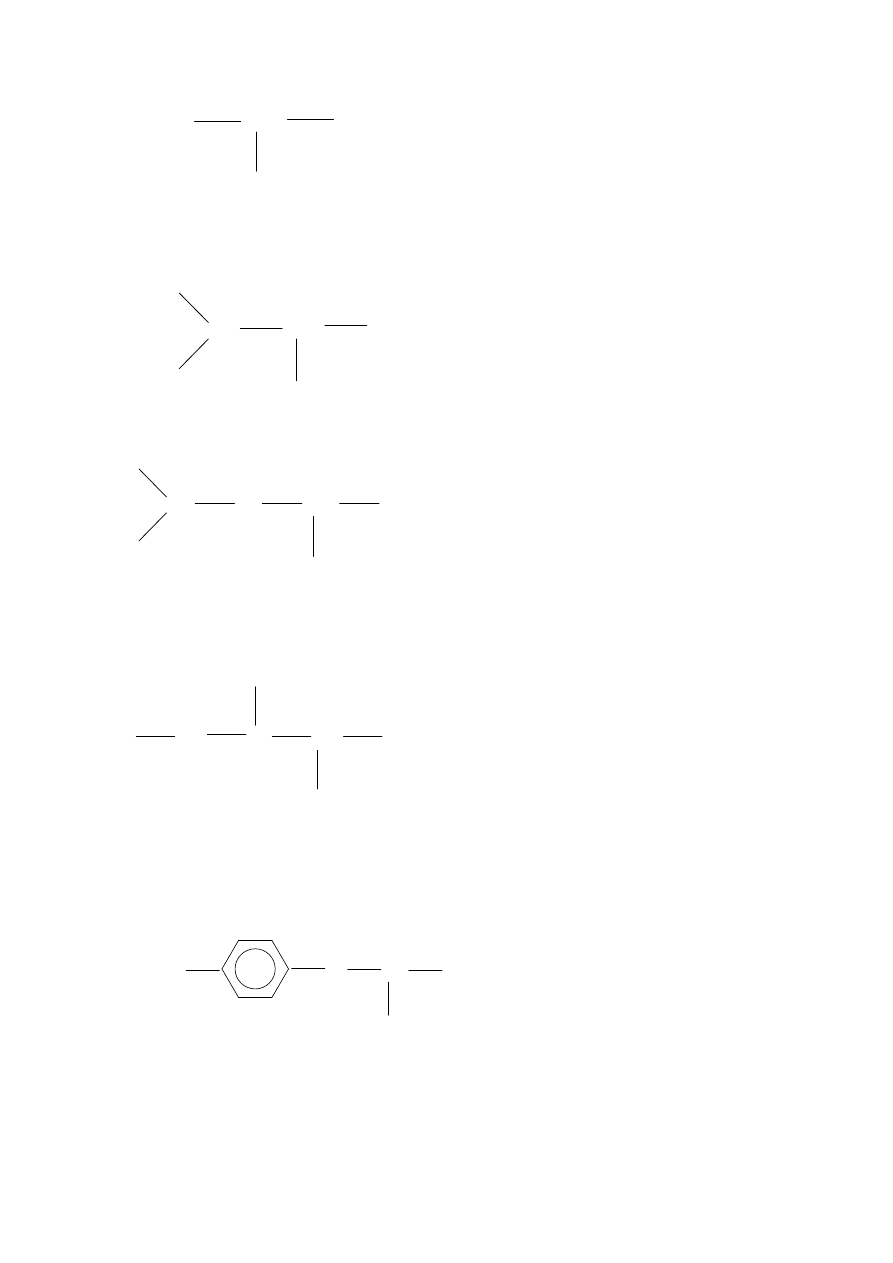
C H
2
C O O H
NH
2
C
H
3
Alanina (Ala)
CH
2
COOH
NH
2
H
C
C
H
3
C
H
3
Walina (Val)
H
C
C
H
3
C
H
3
CH
2
COOH
NH
2
CH
2
Leucyna (Leu)
CH
2
COOH
NH
2
H
C
2
CH
C
H
3
C
H
3
Izoleucyna (Ile)
•
obojętne, ale zawierające jeszcze inne grupy funkcyjne;
CH
COOH
NH
2
H
C
2
HO
Tyrozyna (Tyr)
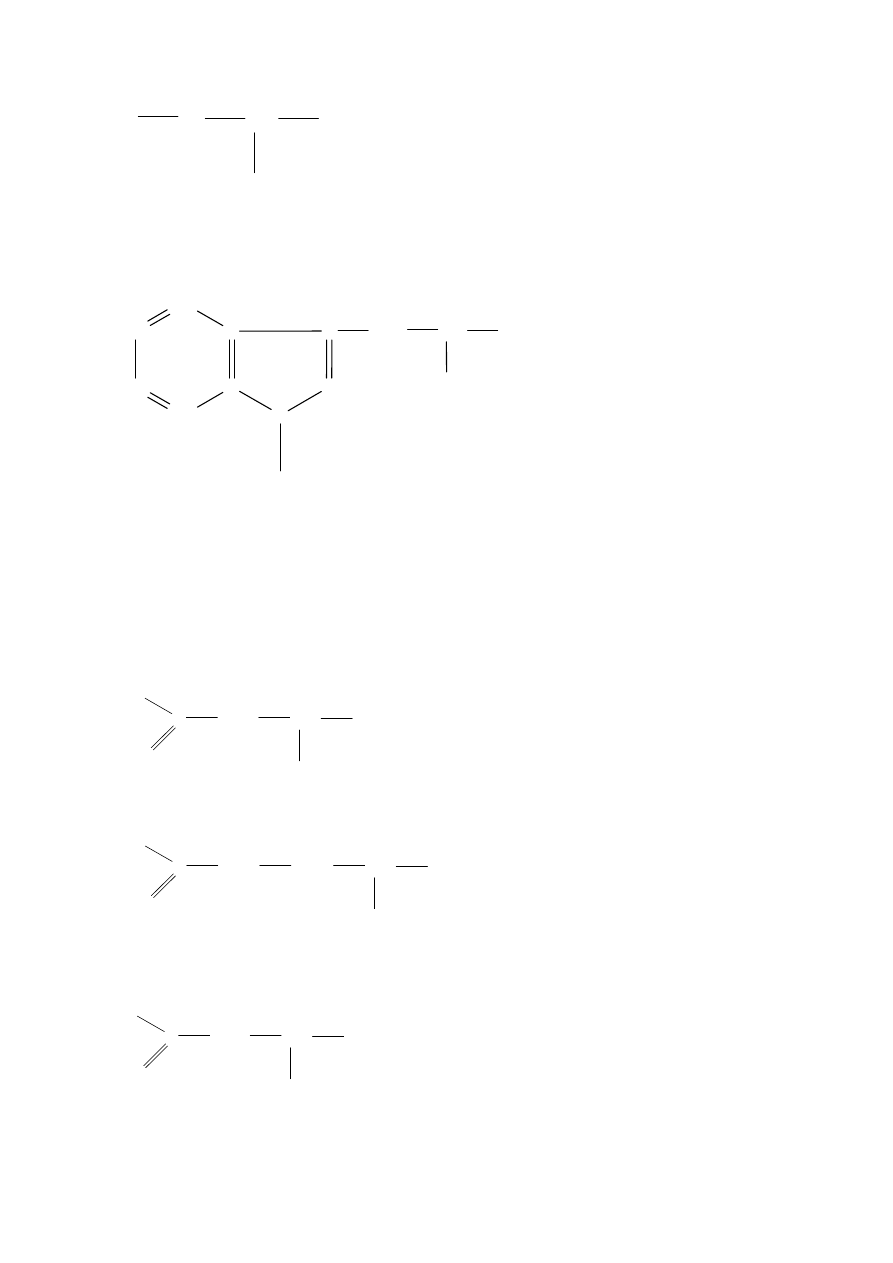
CH
COOH
NH
2
H
C
2
HO
Seryna (Ser)
CH2
COOH
NH2
CH
CH
C
C
C
N
CH
HC
HC
CH
H
Tryptofan (Trp)
HS
CH
2
CH
COOH Cysteina (Cys)
NH
2
CH2
COOH
NH2
CH
C
H2N
O
Asparagina (Asn)
CH2
COOH
NH2
CH
C
H2N
O
CH2
Glutamina (Gln)
•
kwasowe charakteryzują się dodatkową grupą karboksylową
COOH
NH2
CH
C
HO
O
CH2
Kwas asparaginowy (Asp)
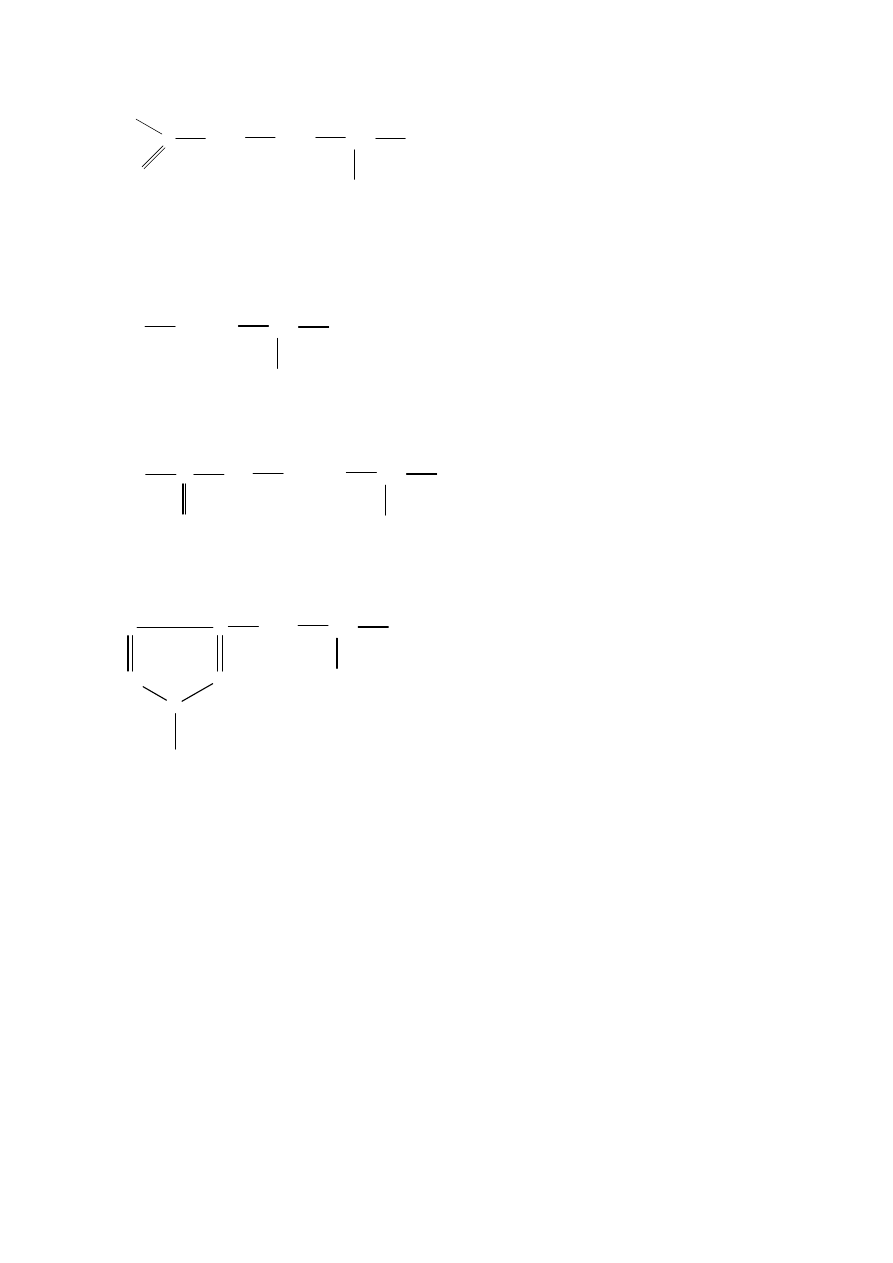
CH2
COOH
NH2
CH
C
HO
O
CH2
Kwas glutaminowy (Glu)
•
zasadowe charakteryzują się dodatkową grupą aminową
(CH
2
)
4
COOH
NH2
CH
H
2
N
Lizyna (Lys)
(CH
2
)
3
COOH
NH2
CH
NH
C
NH
H2N
Arginina (Arg)
CH2
COOH
NH2
CH
CH
C
N
HC
N
H
Histydyna (His)
Podział w zależności od ustawienia grupy aminowej w stosunku do grupy karboksylowej;
•
aminokwas
α
CH
3
CH
2
CH
COOH kwas
α−
aminomasłowy
NH
2
•
aminokwas
β
CH
3
CH
CH
2
COOH kwas
β−
aminomasłowy
NH
2
•
aminokwas
γ
CH
2
CH
2
CH
2
COOH kwas
γ−
aminomasłowy
NH
2
Podział aminokwasów w zależności od możliwości syntezy aminokwasu w organizmie
na:
•
endogenne (organizm potrafi je syntetyzować)
•
egzogenne (muszą być dostarczane z zewnątrz wraz z pożywieniem),
należą do nich: fenyloalanina, izoleucyna, leucyna, lizyna, metionina,
tryptofan, treonina, walina.
Metody otrzymywania aminokwasów
1)
Hydrolityczny rozkład białka:
•
enzymatyczny
−
przy użyciu enzymów proteolitycznych
•
hydroliza kwasowa
−
działanie wyższej temperatury na preparaty białkowe
znajdujące się w 6M HCl lub 25% H
2
SO
4
. Rozkładowi ulegają tryptofan i
treonina.
•
hydroliza zasadowa
−
w obecności stężonego NaOH lub Ba(OH)
2
. Rozkładowi
ulegają cysteina i arginina
2)
Reakcja fluorowcokwasów z amoniakiem
CH3
COOH
+Br2, T
-HBr
COOH
CH2
Br
NH2
CH2
COOH
+2NH
3
-NH
4
Br
3)
Reakcja aldehydów z cyjankiem amonowym ( reakcja cyjanohydrynowa)
CH3CHO
+NH
3
, +HCN
-H
2
O
CN
CH
CH3
NH2
CH
COOH
+2H
2
O
-NH
3
CH3
NH2
Właściwości fizyczne
Aminokwasy występują przede wszystkim jako substancje stałe, krystaliczne. Posiadają
słodki smak. Rozpuszczalność w wodzie jest dobra, posiadają wysokie temperatury topnienia,
natomiast nie rozpuszczają się w rozpuszczalnikach organicznych.
Właściwości chemiczne
1)
Aminokwasy jako substancje amfoteryczne
W roztworach wodnych aminokwasy wykazują odczyn prawie obojętny a w wyniku
dysocjacji powstaja jony:
NH
R
COO
CH
3
-
+
H O
2
COO-
R
NH3+
+ H
+
NH2
R
COOH
CH
Jon obojnaczy to wewnątrzcząsteczkowe zobojętnienie grupy aminowej (
−
NH
2
)
resztą karboksylową co powoduje utworzenie wewnętrznej soli amoniowej. Taka sól posiada
jednocześnie ładunek dodatni jak i ujemny, ilości tych jonów równoważą się. W zależności od
ś
rodowiska w jakim znajduje się aminokwas ( środowisko kwaśne H
+
lub środowisko
zasadowe OH
−
) może występować w formie kationu bądź anionu.
Gdy będzie to środowisko kwaśne wówczas grupa ujemna aminokwasu przyjmuje H
+
co
powoduje cofnięcie dysocjacji grupy karboksylowej i wówczas dany aminokwas posiada
ładunek dodatni.
W przypadku odwrotnym (środowisko zasadowe) następuje przesunięcie reakcji w
kierunku powstawania anionu (odłączenie koordynacyjnie związanego protonu i przyłączenie
z jonem OH
−
−
powstanie wody).
NH
R
COO
CH
3
+
H
-
NH
R
COO
CH
3
+
-
NH
R
COO
CH
2
+
[ ]
H
+
[ ]
H
+
-
+
]
-
O H
[
- ]
-
O H
[
Punkt izoelektryczny
−−−−
pI:
Dla każdego aminokwasu istnieje takie pH, w którym nie obserwuje się wędrówki jonów w
polu elektrycznym. W punkcie izoelektrycznym aminokwas występuje jako jon obojnaczy.
Aminokwasy ze względu na swoją amfoteryczność ( występowanie jonu obojnaczego) dają
jonowo zbudowane sole pod wpływem kwasów jak i zasad.
NH2
R
COOH +HCl
COOH]
+
Cl
-
R
[NH3
NH2
R
COOH + NaOH
COO
-
+ Na
+
+ H
2
O
R
NH
2
2)
Tworzenie wiązań peptydowych
CH2
COOH +
NH2
CH
H2N
COOH
CH3
CH3
COOH
HN
CH
CH2
C
NH2
O
-H2O
3)
Reakcje grupy karboksylowej:
•
reakcja estryfikacji
−
polega ona na reakcji aminokwasu wraz z alkoholem powstają
wówczas estry ( nie posiadaja one właściwości amfoterycznych), a wykazują właściwości
aminy.
CH
NH2
COOH + HOC2H5
R
+ H+
-H
2
O
[R
COOC2H5]
+
NH2
CH
+ OH
-
-H
2
O
CH
NH2
COC2H5
R
•
dekarboksylacja
−
aminokwasy mogą przekształcić się w aminy gdy na nie zadziałamy
podczas ogrzewania roztworem Ba(OH)
2
CH
NH2
COOH
R
T
R
+ CO2
NH2
CH2
•
tworzenie kompleksów
−
α−
aminokwasy tworzą kompleksy z kationami metali (głównie
miedzi). Powstają wówczas barwne sole kompleksowe.
4)
Reakcje grupy aminowej:
•
Deaminacja
−
aminokwasy posiadające I
−
rzędową grupę aminową pod wpływem kwasu
azotowego (III) utleniają się do hydrokwasu i uwalniają grupę aminową w postaci azotu.
CH
NH2
COOH + HONO
R
R
+ N2 + H2O
CH
OH
COOH
Są różne rodzaje deaminacji:
hydrolityczna
hydrolityczna z dekarboksylacją
przez redukcję
desaturatywna
•
Utlenianie
Utlenianie aminokwasów prowadzi do powstawania ketokwasów.
NH2
R
COOH
CH
+
+
-
NH
R
COOH
C
R
COOH
C
O
NH3
+
[ ]
O
[ ]
2H
H O
2
•
Zasady Schiffa
Aminokwasy, które są powiązane w postaci zasady Schiffa mogą ulegać różnym
przemianom biochemicznym tj. transaminacja, dekarboksylacja.
+
NH2
R
COOH
CH
O
C
H
R
R
CH
N
CH
R
COOH
+ H O
2
Ba(OH)
2
Wykrywanie aminokwasów
1.
Reakcja ninhydrynowa
Aminokwasy w tej reakcji wraz z ninhydryną dają fiołkowoniebieskie zabarwienie.
R
COOH
NH2
CH
O
OH
OH +
O
2
Zasada
O O
O
O
N
+ Zasada. H + 3 H2O + R
C
O
H
2.
Reakcja ksantoproteinowa
Reakcja te służy do wykrywania aminokwasów aromatycznych (fenyloalanina,
tyrozyna, tryptofan). Dodanie stężonego kwasu azotowego (V) powoduje
występowanie żółtego zabarwienia, spowodowanego powstaniem pochodnych
nitrowych aminokwasów.
Peptydy
Są to związki powstające w wyniku kondensacji aminokwasów. Wiązanie peptydowe
wygląda następująco:
C
NH
O
Podział peptydów:
1.
Dipeptydy
CH2
COOH +
NH2
CH
H2N
COOH
CH3
CH3
COOH
HN
CH
CH2
C
NH2
O
-H2O
2.
Tripeptydy np.: glutation
3.
Tetrapeptydy
4.
Polipeptydy: polimery aminokwasów o masie cząsteczkowej do 10000.

Glutation:
Zbudowany jest z trzech aminokwasów: kwasu glutaminowego, cysteiny i
glicyny.Glutation pełni rolę układu odpowiadającego za utrzymanie na odpowiednim
poziomie potencjału oksydoredukcyjnego komórek. W postaci zredukowanej zawiera grupę
tiolową
−
SH, a w postaci utlenionej ditiogrupę
−
S
−
S
−
.
Niektóre hormony są peptydami np.: wazopresyna (zbudowana z 9 aminokwasów i
jednego mostka disiarczkowego), oksytocyna (zbudowana również z 9 aminokwasów).
Białka
Białka są to polimery aminokwasów białkowych połączone wiązaniami peptydowymi.
Są to polipeptydy zbudowane z więcej niż 100 reszt aminokwasowych, posiadające masę
cząsteczkową wyższą niż 10000.
Budowa białek
Budowa białek jest złożona. W celu jej określenia podaje się tzw. struktury:
1.
Struktura I
−
rzędowa określa ona sekwencję aminokwasów w cząsteczce białka czyli
kolejne ułożenie aminokwasów w białku.
2.
Struktura II
−
rzędowa mówi nam o układzie przestrzennym wynikającym z obecności
wiązań wodorowych. Są dwie konformację łańcucha polipeptydowego. Pierwsza z nich
mówi o kształcie łańcucha w formie prawoskretnej linii śrubowej tzw.
α−
heliks. Druga
nazywana jest strukturą
β−
harmonijką, mówimy o niej wówczas, gdy łańcuchy
peptydowe układają się równolegle do siebie i łączą się wiązaniami wodorowymi.
Konformację
α−
heliksu posiadają białka globularne a
β
białka budulcowe.
3.
Struktura III
−
rzędowa charakteryzuje pofałdowanie łańcuchów peptydowych w
przestrzeni ( skręcenie łańcucha polipeptydowego). Bardzo ważną rolę odgrywają tutaj
wiązania siarczkowe
−
S
−
S
−
tworzące się między resztami cysteiny. Dzieki tym
wiazaniom białka sa bardziej odporne na czynniki denaturujące. Innymi ważnymi
połączeniami wewnątrz białka są siły Wan der Waalsa.
4.
Struktura IV
−
rzędowa, określa ilość i wzajemne ułożenie podjednostek cząsteczkowych
(pojedyńczych łańcuchów) białek. Są to struktury bardzo złożone.
Właściwości fizyko
−−−−
chemiczne białek
Białka są na ogół rozpuszczalne w wodzie, niektóre rozpuszczają się w rozcieńczonych
roztworach kwasów i zasad a inne w rozpuszczalnikach organicznych. Ulegaja hydratacji
poprzez wykazanie zdolności do wiązania cząsteczek wody. Początkowo pęcznieją a
następnie się rozpuszczają. Tworzą cząstki koloidalne. Na ich rozpuszczalność ma też wpływ
stężenie soli nierganicznych. Niewielkie stężenie wpływają dodatnio, ale przekroczenie
pewnego stężenia powoduje oddzielenie wody i wypadanie ich z roztworu (wysalanie)
−
jest to
proces odwracalny i nie narusza ich struktury, niszczy jedynie ich otoczkę solwatacyjną.
Białka ulegają procesowi koagulacji i procesowi odwrotnemu - peptyzacji. Koagulacja jest to
przejście zolu w żel, a peptyzacja jest to przejście żelu w zol.
Denaturacja białka
−
jest to zniszczenie struktury II, III, IV
−
rzędowej bez naruszenia
struktury I
−
rzędowej. Czynikami deneturującymi są:
mocne kwasy i zasady
wysoka temperatura
sole metali ciężkich

alkohole,aldehydy
promieniowanie UV i X
Dzięki obecności w cząsteczce białka ładunków elektrycznych posiadają one właściwość
poruszania się w polu elektrycznym. Przy warunkach sprzyjających tworzeniu ładunków (+)
białko przesuwa się w stronę katody, natomiast w odwrotnych warunkach przesuwa się w
stronę anody. Wykorzystano tą właściwość do rozdzielenie miesznin białek na drodze
elektoforezy.
Podział białek
Podstawowy podział białek:
1.
Białka proste
−
proteiny, które po hydrolizie dają wyłącznie aminokwasy
2.
Białka złożone
−
proteidy, zawierają one oprócz aminokwasów inne niebiałkowe
składniki np.: grupę prostetyczną
Białka proste:
1.
Protaminy
2.
Histony
3.
Albuminy
4.
Globuliny
5.
Prolaminy
6.
Gluteiny
7.
Skleroproteiny
Białka złożone:
1.
Fosfoproteidy
2.
Nukleoproteidy
3.
Chromoproteidy
4.
Metaloproteidy
5.
Glikoproteidy
6.
Lipoproteidy

Zagadnienia do przygotowania:
Aminokwasy
−
wzory, definicja, nazewnictwo, klasyfikacja, wykrywanie.
Właściwości chemiczne aminokwasów
−
reakcje charakterystyczne.
Klasyfikacja i budowa peptydów.
Właściwości fizyko
−
chemiczne białek.
Napisać reakcje alaniny z:
a)
HNO
2
b)
HCl
c)
H
2
O
d)
CH
3
OH
e)
KOH
Podaj równania reakcji dla powyższych syntez:
a)
etan
−
alanina
b)
metan
−
glicyna
c)
etan
−
glicyloalanina
Podać zawartość procentową azotu w kwasie
α−
aminopropinowym.
Związek organiczny zawiera 48,6% węgla, 8,1% wodoru, 43,3% tlenu. W reakcji z
bromowodorem daje on bromopochodną o masie molowej większej o 79 g/mol od
związku wyjściowego. Bromopochodna ta reaguje z amoniakiem tworząc aminokwas.
Podaj nazwę aminokwasu i związku.
Podać strukturalny wzór związku zawierającego 77,4% węgla, 7,5% wodoru i 15,1%
azotu. Masa cząsteczkowa związku wynosi 93 g.

Ćwiczenie 1. Badanie właściwości kwasu aminooctowego.
Kwas aminooctowy (glicyna) to biała krystaliczna substancja stała, która dość dobrze
rozpuszcza się w wodzie. Odczyn powstałego roztworu jest obojętny.
Przebieg ćwiczenia:
a)
Część pierwsza doświadczenia
1.
Przygotować roztwór glicyny !
−
0,5g glicyny (odważyć na wadze w naczyńku wagowym) rozpuścić w
3 cm
3
H
2
O destylowanej (czynność wykonać w probówce ).
2.
Do małej kolbki stożkowej wlać niewielką ilość 5% NaOH, wkroplić kroplę
fenoloftaleiny.
3.
Do probówki z roztworem glicyny dodawać kroplami 5% roztwór NaOH zabarwiony
fenoloftaleiną (znajdujący się w kolbce stożkowej).
Nazwa
wskaźnika
Barwa w środowisku
Zakres pH
zmiany barwy
Ilość kropli
dodawana do
roztworu
kwaśnym
zasadowym
fenoloftaleina
-
czerwono -
fioletowa
8,2 – 10,0
1
b) Część druga doświadczenia
1.
Przygotować roztwór glicyny !
−
0,5g glicyny (odważyć na wadze w naczyńku wagowym) rozpuścić w
3 cm
3
H
2
O destylowanej (czynność wykonać w probówce).
2.
Do drugiej probówki wlać 3 cm
3
H
2
O destylowanej.
3.
Do każdej z nich dodać po 0,5 cm
3
5% HCl.
4.
Zbadać odczyn w próbówkach papierkiem uniwersalnym.
Zadania i pytania:
1. Opisać obserwacje i spostrzeżenia z przeprowadzonego doświadczenia.
Ćwiczenie 2. Wykrywanie aminokwasów
Alfa
−
aminokwasy tworzą z ninhydryną barwne połączenia. Wykorzystuje się to w
chromatografii bibułowej, aby rozdzielić składniki mieszaniny aminokwasów. Po
„rozwinięciu” chromatogram suszy się i spryskuje odczynnikiem ninhydrynowym.
Przebieg ćwiczenia:
1.
Odważyć w naczyńku wagowym na wadze analitycznej 0,2g
α−
aminokwasu.
2.
Zawartość przesypać do probówki następnie dodać 2 cm
3
wody.
3.
Zawartość probówki wymieszać.
4.
Następnie dodać 3
−
5 kropli roztworu ninhydryny.
5.
Mieszaninę ogrzewać nad palnikiem gazowym do wrzenia.
6.
Powstanie niebieskiego zabarwienia świadczy o obecności
α−
aminokwasu.
Zadania i pytania
1. Opisać obserwacje i spostrzeżenia z przeprowadzonego doświadczenia.

Ćwiczenie 3. Badanie właściwości fizycznych białek
Białko jaja kurzego (albumina) rozpuszcza się wodzie tworząc roztwór koloidalny. Duże
cząsteczki białek z uwagi na obecność silnie polarnych grup:
−
COOH,
−
NH
2
,
−
OH ulegają
solwatacji. Dodanie mocnego elektrolitu niszczy otoczkę solwatacyjną. Wówczas nastąpi
wytrącenie białka z roztworu zwane wysoleniem. Jest to proces odwracalny. Pod wpływem
soli metali ciężkich, mocnych kwasów, formaliny itp. zachodzi wytrącenie białka z
roztworów w sposób nieodwracalny
−
denaturacja.
Przebieg ćwiczenia:
Przygotowanie roztworu białka !
1.
5g białka jaja (oddzielić białko od żółtka, odważyć 5g białka na wadze analitycznej w
naczyńku wagowym)
2.
Przelać białko do kolby miarowej na 200 cm
3
(przy użyciu lejka) dodać
195 cm
3
wody destylowanej (odmierzyć cylindrem miarowym) dodać do kolby miarowej
zamknąć korkiem i wymieszać.
Wysalanie białka
1.
Do probówki wlać 2 cm
3
roztworu białka
2.
Następnie do probówki dodać 2 cm
3
nasyconego roztworu (NH
4
)
2
SO
4
.
3.
Dodać do probówki 10 cm
3
wody destylowanej i wstrzasnąć.
Denaturacja białka
1.
Przygotować 5 próbówek,
2.
Do każdej probówki dodać 2 cm
3
roztworu białka,
3.
Do pierwszej dodać kilka kropli 5% Pb(NO
3
)
2
,
4.
Do drugiej dodać kilka kropli 5% HgCl
2
,
5.
Do trzeciej dodać kilka kropli stężonego H
2
SO
4
,
6.
Do czwartej dodać kilka kropli formaliny,
7.
Ostatnią probówkę wstawić do wrzacej łaźni wodnej i ogrzewać do wrzenia,
8.
Na koniec do każdej z probówek dodać 10 cm
3
wody destylowanej i wstrząsnąć.
Zadania i pytania:
1. Opisać obserwacje i spostrzeżenia z przeprowadzonego doświadczenia.
Ć
wiczenie 4. Wykrywanie białek
Do wykrywania białek stosuje się poniższe reakcje:
−
reakcja biuretowa, polega ona na powstawaniu fioletowoniebieskiego kompleksu
białka z wodorotlenkiem miedzi (II). Reakcja ta daje pozytywne efekty w przypadku białek (
od tetrapaptydów ) a także dają ją również niektóre substancje niebiałkowe np.:biuret,
−
reakcja ksantoproteinowa
−
jest to nitrowanie (działanie stężonych kwasem
azotowym (V) związków posiadajacych pierścień aromatyczny występujących w białkach
np.: fenyloalanina i tworzeniu żółtego zabarwienia,
−
reakcja cystynowa
−
wykrywa ona białka zawierające związki siarki. Po zasadowej
hydrolizie tworzy się siarczek (II) sodu, który reaguje z solami ołowiu (II), tworząc czarny
osad siarczku ołowiu,
−
reakcja ninhydrynowa
−
aminokwasy reagują z ninhydryną tworząc barwne
związki.

Przebieg ćwiczenia:
Reakcja biuretowa
1.
Przygotować dwie probówki
2.
Do pierwszej probówki dodać 2 cm
3
mleka
3.
Do drugiej probówki dodać 2
cm
3
roztworu białka (wcześniej przygotowanego patrz
ć
wiczenie 3).
4.
Do obu probówek dodać po 2 cm
3
stężonego NaOH oraz kilka kropli CuSO
4
.
Reakcja ksantoproteinowa
1.
Przygotować dwie probówki
2. Do pierwszej probówki dodać 2 cm
3
mleka
3.
Do drugiej probówki dodać 2
cm
3
roztworu białka (wcześniej przygotowanego patrz
ć
wiczenie 3).
4.
Do obu probówek wlać po 1 cm
3
stężonego HNO
3
.
5.
Probówki ogrzewać w łaźni wodnej przez 3 minuty aż roztwór zabarwi się na żółto.
6.
Probówki ochłodzić pod zimną wodą.
7.
Do
każdej
probówki
dodać
1
cm
3
stężonego
roztworu
NaOH
[ OSTROśNIE! Dodaje prowadzący!!!]
Reakcja ninhydrynowa
1.
Do probówki wlać 1 cm
3
mleka i 1 cm
3
0,1% roztworu ninhydryny .
2.
Probówkę ogrzać w łażni wodnej.
Zadania i pytania:
1. Opisać obserwacje i spostrzeżenia z przeprowadzonego doświadczenia
Wyszukiwarka
Podobne podstrony:
8 AMINOKWASY, PEPTYDY, BIA id 4 Nieznany (2)
Æwiczenie 7 Aminokwasy, peptydy i bia³ka
Æwiczenie 7 Aminokwasy, peptydy i bia³ka
Biochemia aminokwasy, peptydy i bia éka
Chemia 3 - ściąga (aminokwasy białka peptydy), Inne
C6wiczenie 16 Wska=BFniki pH=2E Barwniki=2Epdf =
C6wiczenie 11 =2D Alkohole=2Epdf =
C6wiczenie14 Aldehydy=2C ketony=2C kwasy aromatyczne=2Epdf =
bia c5 82ka i aminokwasy
C6wiczenie 17 Polimery=2Epdf = Nieznany
AMINOKWASY I PEPTYDY
01 Aminokwasy, peptydy, białka, enzymyid 3054 ppt
Aminokwasy, peptydy 2
Kopia 3 AMINOKWASY, PEPTYDY, BIAŁAKA
68 Aminokwasy peptydy i bialka(1)
AMINOKWASY I PEPTYDY protokól
68 Aminokwasy peptydy i bialka
więcej podobnych podstron