1
Chemia wybranych zwi
Chemia wybranych zwi
Chemia wybranych zwi
Chemia wybranych zwiąąąązk
zk
zk
zkóóóów
w
w
w
koordynacyjnych
koordynacyjnych
koordynacyjnych
koordynacyjnych
Wiązanie koordynacyjne
σ
(
π
)
σ
(
π
)*
"zwykłe” wiązanie
nakładają się dwa częściowo
zapełnione orbitale atomowe
(mogą być zhybrydyzowane)
σ
(
π
)
σ
(
π
)*
wiązanie koordynacyjne
nakładają się orbitale
atomowe: pusty i zapełniony
(mogą być zhybrydyzowane)
Tworzenie się wiązania koordynacyjnego jest
reakcją
kwasowo
-
zasadową
(w sensie Lewisa)
Związki koordynacyjne
Składają się z atomu centralnego, który jest
kwasem
Lewisa
i ma wolne orbitale zdolne do wytworzenia
wiązań z ligandami, które są
zasadami Lewisa
.
W roztworach atomem centralnym jest "prawdziwy
jon", w ciałach stałych atom o odpowiednim stopniu
utlenienia. Ligandy muszą posiadać elektrony zdolne
do wytworzenia wiązań ...
kwadrat
4
dsp
2
bipiramida pent.
7
d
3
sp
3
oktaedr
6
d
2
sp
3
bipiramida tryg.
5
dsp
3
tetraedr
4
sp
3
trójkąt
3
sp
2
liniowa
2
sp
Kształt jonu lub
cząsteczki
Liczba wiązań
(L.K.)
Hybrydyzacja
Akwakompleksy (1)
W przypadku akwakompleksów w roztworach wodnych rolę
ligandów mogą pełnić cząsteczki wody (
H
2
O
) lub jony
hydroksylowe (
OH
-
). Rodzaj utworzonego kompleksu zależy
nie tylko od jonu centralnego, ale np. także od pH (możliwa
wymiana ligandów!).
Na ogół tworzenie akwakompleksów jest bardzo szybkie, ale
ich trwałość dość niska ...
+
+
+
+
↔
+
O
H
OH]
O)
[Fe(H
O
H
]
O)
[Fe(H
3
2
5
2
2
3
6
2
+
+
+
+
↔
+
O
H
]
(OH)
O)
[Fe(H
O
H
OH]
O)
[Fe(H
3
2
4
2
2
2
5
2
+
+
+
↓
↔
+
O
H
Fe(OH)
O
H
]
(OH)
O)
[Fe(H
3
3
2
2
4
2
Usuwanie jonów hydroniowych (podwyższanie pH) prowadzi do
wymiany ligandów i wytrącania wodorotlenku ...
Akwakompleksy (2)
Dla innych jonów metali (Al
3+
, Zn
2+
, Cr
3+
itd.)
w roztworach wodnych istnieją podobne
równowagi - o wytrącaniu się osadu
wodorotlenku decyduje stała trwałości
akwakompleksu (z cząsteczkami H
2
O) ...
Kompleksy z jonami OH
-
są trwalsze niż z
cząsteczkami wody...
Ponieważ hydratacja towarzyszy
rozpuszczaniu, zatem tworzenie kompleksów z
innymi ligandami w środowisku wodnym jest
zawsze reakcją wymiany ligandów
Aminakompleksy (1)
Ligandem w aminakompleksach jest najczęściej
cząsteczka amoniaku
NH
3
, ale ligandem może być
też jon amidkowy
NH
2
-
lub aminy organiczne
R-NH
2
,
R
2
-NH
,
R
3
-N
. Pary wiążącej dostarcza atom
azotu:
NH
3
N
H
H
H
Trwałość aminakompleksów
przewyższa trwałość
akwakompleksów, zarówno
z H
2
O, jak i OH
-
, są one też
zazwyczaj dobrze
rozpuszczalne w wodzie
2
Aminakompleksy (2)
+
+
+
↓
↔
+
+
4
2
2
3
2
2NH
Zn(OH)
O
2H
2NH
Zn
−
+
+
↔
+
2OH
]
)
[Zn(NH
4NH
Zn(OH)
2
4
3
3
2
+
+
+
↓
↔
+
+
4
3
2
3
3
3NH
Cr(OH)
O
3H
3NH
Cr
−
+
+
↔
+
3OH
]
)
[Cr(NH
6NH
Cr(OH)
3
6
3
3
3
−
+
→
+
Cl
]
)
[Ag(NH
2NH
AgCl
2
3
3
.
nrp
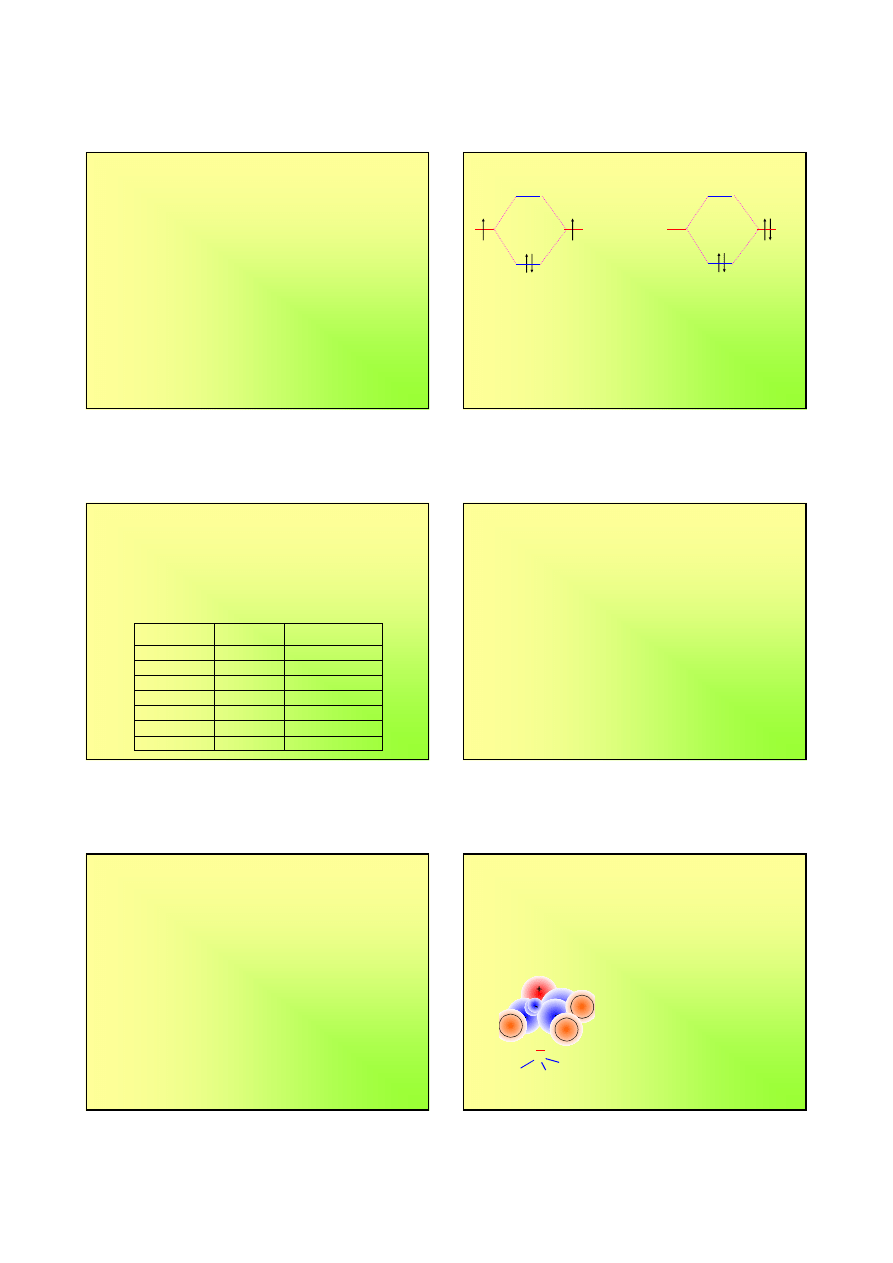
Orbitale molekularne w aminakompleksie
Kompleks
[Cr(NH
3
)
6
]
3+
Konfiguracja
Cr 3d
5
4s
1
, jonu
Cr
3+
3d
3
Hybrydyzacja
Cr
3+
d
2
sp
3
, oktaedr
orbitale t
3d
NH
3
××××
6
3d
σ
σ*
6
×→
×→
×→
×→
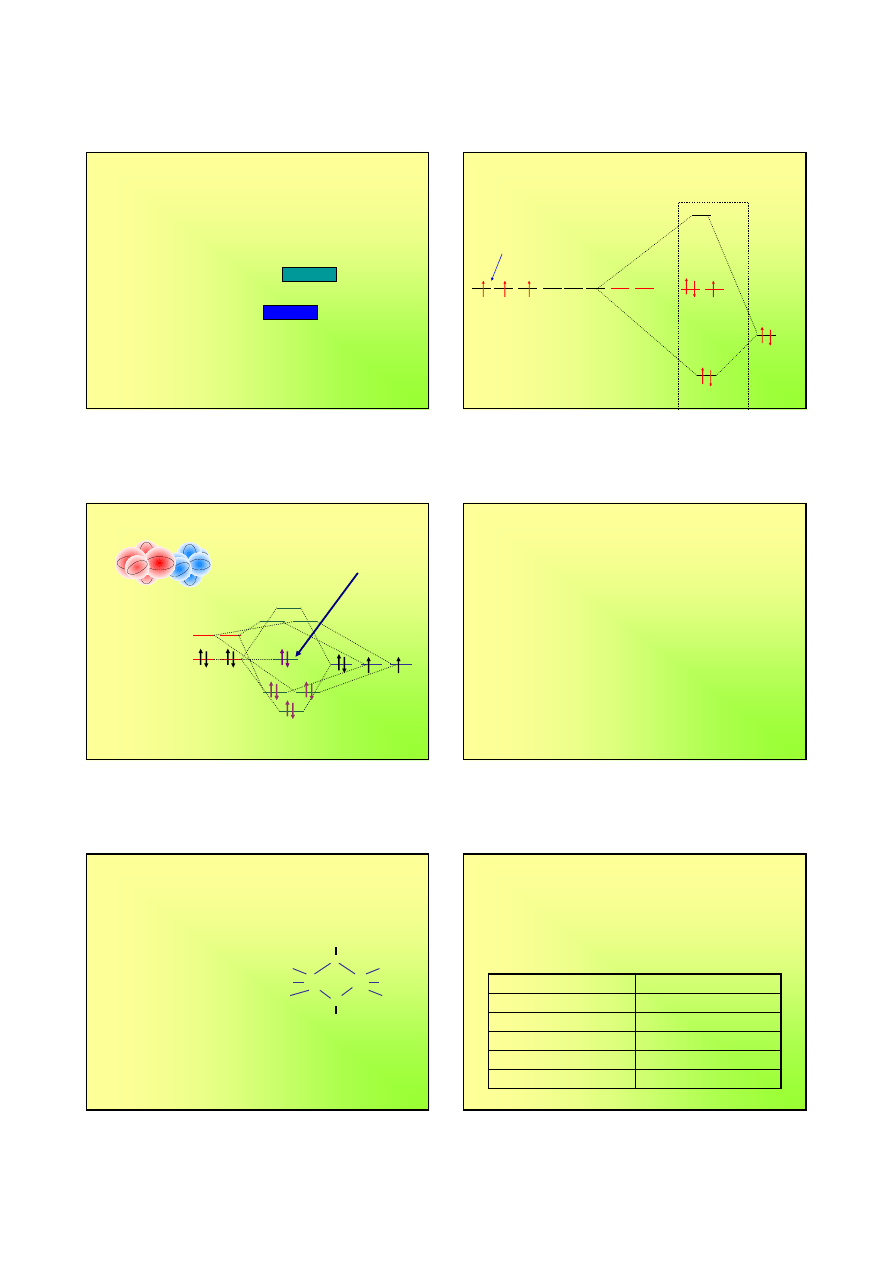
CO jako ligand – karbonylki metali
t
2
t
1
2p
z
2p
y
C
2p
x
2p
y
2p
z
O
CO
σ
σ
*
π
y
π
y
*
π
z
π
z
*
„wolna para”
elektronowa przy
atomie węgla
ze strunktury
elektronowej
CO
wynika, że jest on
zasadą Lewisa i
może być ligandem
w kompleksach
2p
z
2p
y
2p
x
O
t
2
2p
y
2p
z
C
-
:C
≡≡≡≡
O
Karbonylki metali przejściowych
☻
Stopień utlenienia metalu w kompleksach z CO
wynosi zwykle 0 (
!!
)
☻
Otrzymywanie kompleksów odbywa się na drodze
bezpośredniej syntezy ...
4
Ni(CO)
4CO
Ni
→
+
5
Fe(CO)
5CO
Fe
→
+
1890, świeży proszek Ni,
T i p - normalne
470 K, 10 MPa
... albo redukcji tlenków:
2
10
2
0
7
2
VII
7CO
(CO)
Re
17CO
O
Re
+
→
+
+
Kompleksy „mieszane” dwurdzeniowe:
4
5
5
4
MnCo(CO)
(CO)
NaBr
Br
Mn(CO)
NaCo(CO)
+
→
+
Klasyfikacja kompleksów karbonylkowych
Kompleksy jednordzeniowe:
Kompleksy wielordzeniowe:
M(CO)
6
V(CO)
6
Cr(CO)
6
Mo(CO)
6
W(CO)
6
M(CO)
5
Fe(CO)
5
Ru(CO)
5
Os(CO)
5
M(CO)
4
Ni(CO)
4
M
2
(CO)
8
Co
2
(CO)
8
M
2
(CO)
9
Fe
2
(CO)
9
M
2
(CO)
10
Fe
2
(CO)
10
Tc
2
(CO)
10
, Re
2
(CO)
10
M
3
(CO)
12
M = Fe, Os, Ru
M
4
(CO)
12
M = Co, Rh, Ir
M
6
(CO)
12
M = Co, Rh
O─
C
C
─O
O─
C
C
─O
O─
C
C
─O
O
C
C
O
M
M
Kompleksy π – elektronowe
Związki metaloorganiczne – związki, w których
pierwiastek o elektroujemności niższej niż węgiel jest
połączony bezpośrednio z atomem węgla lub rodnikiem.
Związki metaloorganiczne, w których występuje
wiązanie koordynacyjne tworzą się na ogół z udziałem
związków zawierających
wiązanie(a) typu π
:
6
pirol
5
cyklopentadien
4
butadien, cyklobutadien
3
π - allil (CH=C=CH)
2
alkeny, alkiny
Liczba elektronów π
Ligand organiczny (π)
3
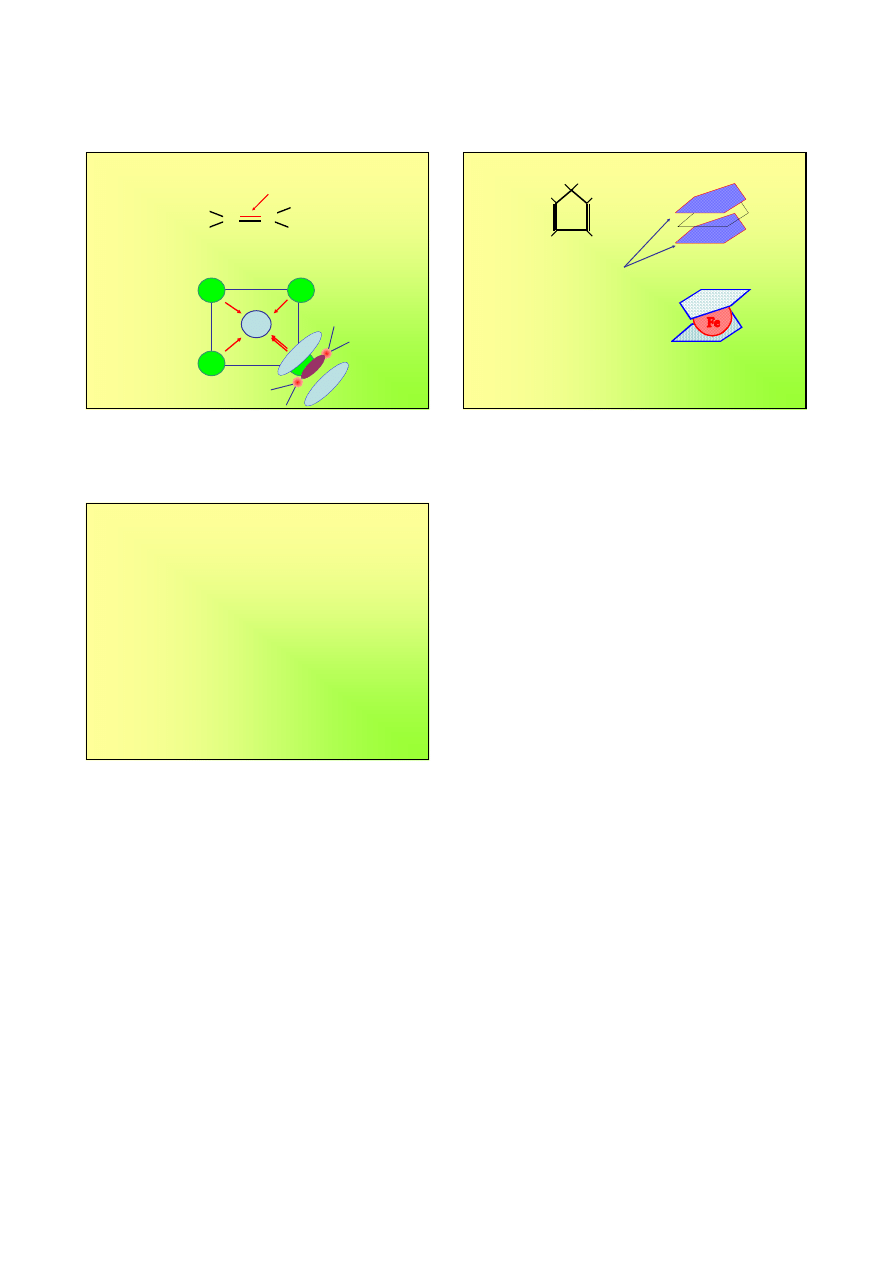
Etylen jako ligand
C
C
H
H
H
H
para elektronów π
−
−
−
+
→
+
Cl
)]
(
[PtCl
]
[PtCl
4
2
3
4
2
2
4
H
C
H
C
Pt
2+
Cl
-
Cl
-
Cl
-
Cl
-
Kompleksy „sandwichowe” (kanapkowe)
cyklopentadien C
5
H
6
,
5 elektronów
zdelokalizowanych
+
+
→
+
2
6
5
2
6
5
)]
H
[Fe(C
Fe
H
2C
Ferrocen
KONIEC
KONIEC
KONIEC
KONIEC
Wyszukiwarka
Podobne podstrony:
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 06 09 10
chemia lato 05 09 10
chemia lato 07 09 10
chemia lato 08 09 10
chemia lato 12 09 10
chemia lato 03 09 10
chemia lato 01 09 10
chemia lato 02 09 10
chemia lato 13 07 08
bud szereg rozw 13.09.10, Audit energetyczny
rozw szereg z egz 13 09 10
rozw szereg z egz 13 09 10
rj lato 13 tab 10 v3
więcej podobnych podstron