Tlenowce
Pierwiastki grupy 16
(grupy VI A, „głównej”)
Tlenowce
Konfiguracja elektronowa powłoki walencyjnej ns
2
np
4
X
2
Elektro-
ujemność
Energia
jonizacji I
[kJ▪mol
-1
]
A
e
(
X
X
2-
)
[kJmol
-1
]
Promień
atomowy
[pm]
Promień
jonowy
X
2-
[pm]
O
S
Se
Te
Po
3,5
2,44
2,48
2,01
1,76
1314
999,6
940,9
869,3
812
-780
-590
-420
73
102
117
135
164
126
170
184
207
(230)
Charakter chemiczny tlenowców
Tlenowce tworzą najczęściej wiązania kowalencyjne,
tlen występuje w sieci niektórych tlenków jako jon
O
2-
(rzadziej pojawia się jon S
2-
...);
Tlen ma inne właściwości niż pozostałe pierwiastki w
tej grupie i tworzy związki z praktycznie wszystkimi
pierwiastkami;
Tlen występuje na stopniach utlenienia -II, -I, -½, w
wyjątkowych wypadkach +½, +I, +I
;
Pozostałe pierwiastki na stopniach utlenienia od -2
do + VI, a nawet +VIII
Alotropia tlenu
Alotropia to zjawisko, które polega na występowaniu tego
samego pierwiastka w kilku formach różniących się strukturą,
liczbą atomów w cząsteczce itp. – z czego wynika różnica
właściwości fizycznych różnych odmian alotropowych
„Zwykły” tlen cząsteczkowy O
2
:
2s
2s
2p
x
y
z
x
y
z
σ
2s
σ
*
2s
σ
2p
π
2p
π
*
2p
π
2p
π
*
2p
O
t
1
t
2
t
3
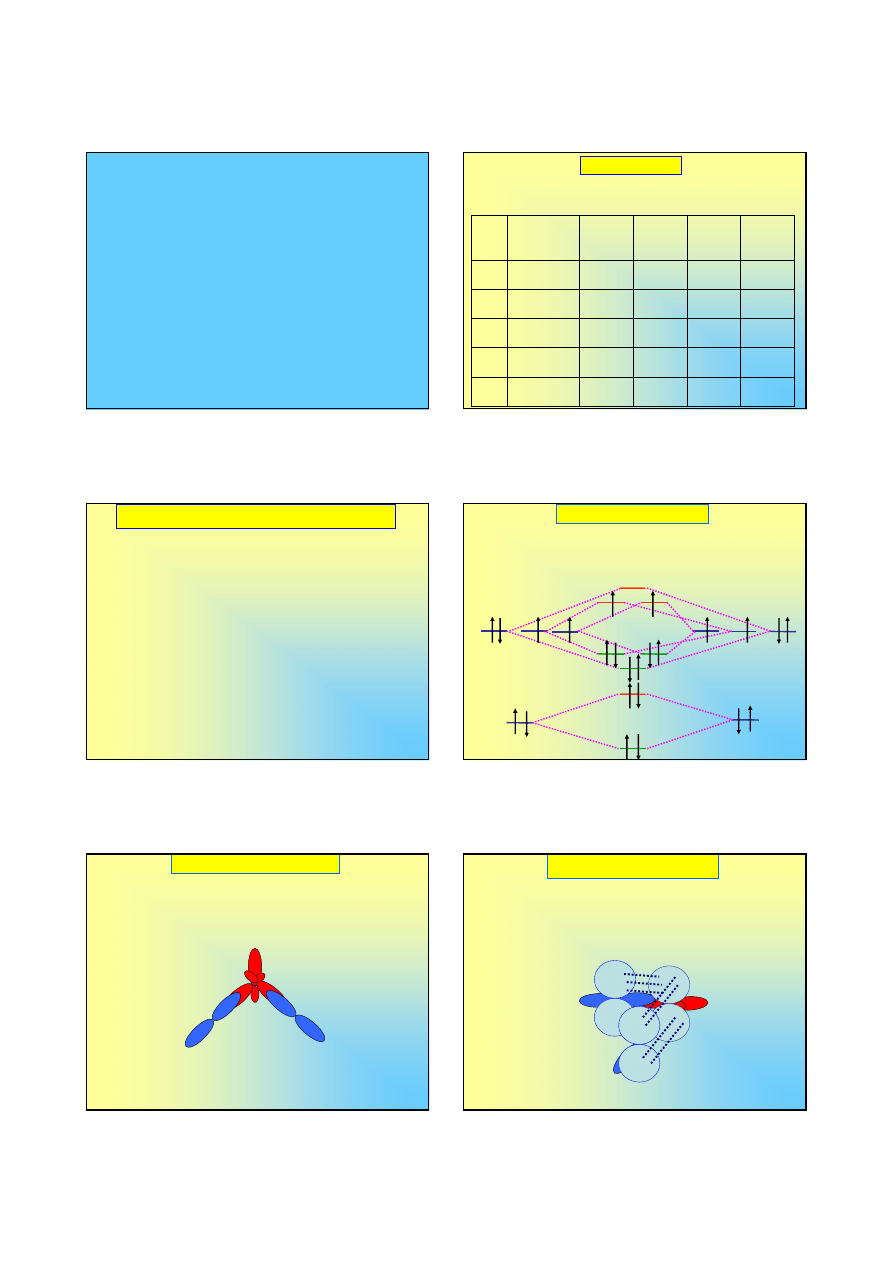
Alotropia tlenu (2)
Tlen występuje również jako mniej trwała odmiana –
ozon – którego cząsteczki składają się z 3 atomów
.
Cząsteczka ma kształt kątowy, który tłumaczymy
hybrydyzacją sp
2
srodkowego atomu tlenu:
O
O
O
O
O
Alotropia tlenu (3)
o
Prostopadle do płaszczyzny wiązań typu σ
znajdują się 3 orbitale 2 p
z
, których nakładanie
się prowadzi do wytworzenia trójcentrowego
orbitalu zdelokalizowanego (typu π)
.
o
Orbitale 2s i 2p
y
skrajnych atomów tlenu nie
biorą udziału w tworzeniu się wiązań:
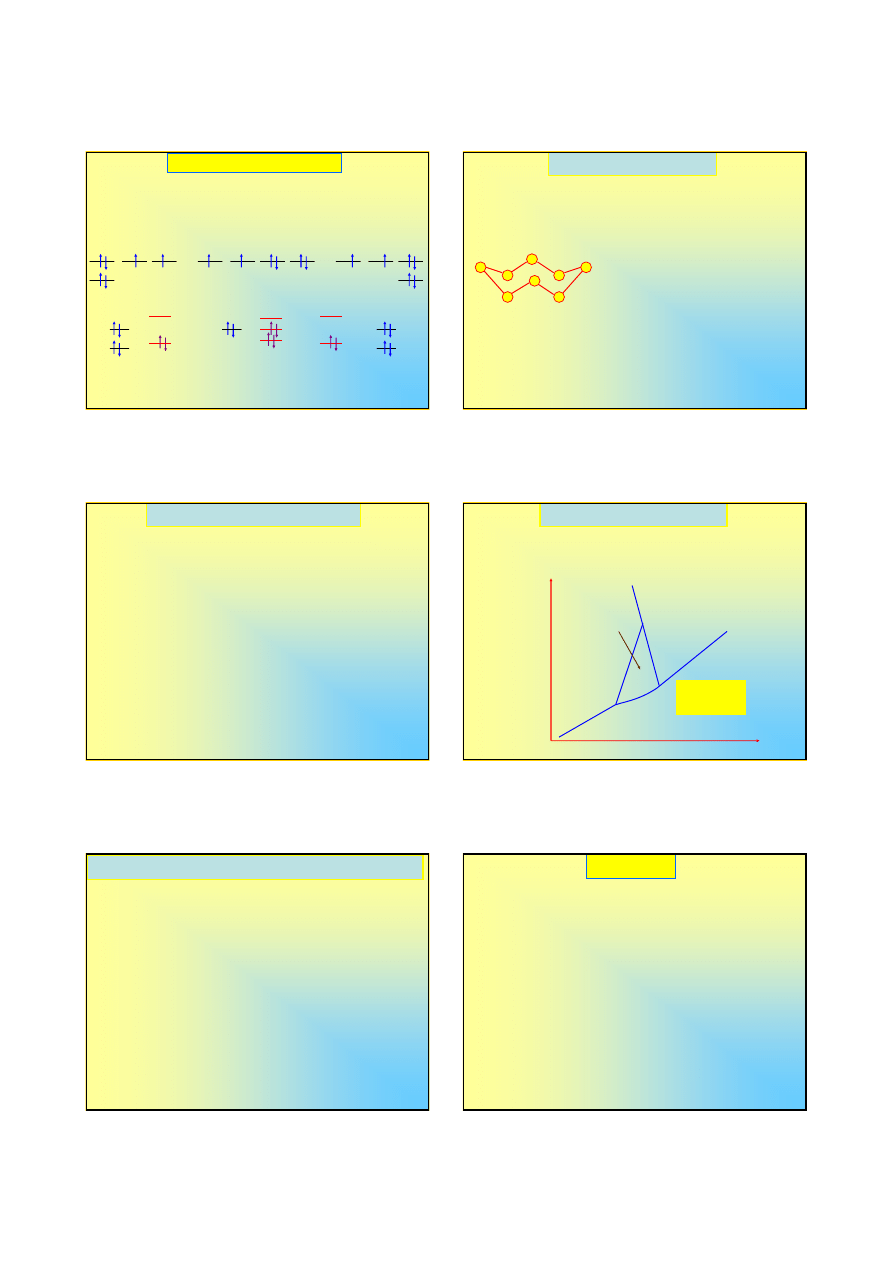
Alotropia tlenu (4)
Struktura elektronowa ozonu wynika z poziomów,
które tworzą się wskutek nakładania orbitali
wszystkich trzech atomów;
Przed wytworzeniem wiązań:
2s
O
2p
y
x
z
2s
O
y
2p
x
z
O
t
1
t
2
t
3
2p
z
Po wytworzeniu wiązań:
2s
2p
y
2s
2p
y
σ
*
σ
σ
*
σ
π
π
0
π
*
Mamy 3•6=18 elektronów
t
3
2p
x,1
+ t
1
2p
x,3
+ t
2
2p
z,1
+ 2p
z,2
+ 2p
z,3
Alotropia siarki
Siarka
tworzy cząsteczki o pierścieniowym lub
łańcuchowym układzie atomów. Tworzy kilka odmian
alotropowych ...
Najczęściej siarka występuje w
cząsteczkach pierścieniowych o
wzorze S
8
W obu odmianach alotropowych siarki zarówno w siarce
rombowej, jak i siarce jednoskośnej występują cząsteczki
S
8
. Odmiany te różnią się od siebie ułożeniem cząsteczek,
co powoduje różnice symetrią sieci krystalicznej
Odmiany alotropowe siarki
Trwałość różnych odmian siarki zależy od temperatury i
ciśnienia ...
S
α
rombowa
S
β
jednoskośna
S
λ
ciekła
S
µ
polisiarka
370 K
↔
↔
↔
↔
392 K
↔
↔
↔
↔
450 K
↔
↔
↔
↔
718 K
↔
↔
↔
↔
S
2
pary siarki
Przemiany fazowe siarki są odwracalne, ale gwałtowne
ochłodzenie par siarki prowadzi do resublimacji i powstania
tzw. kwiatu siarki, żółtej stłej odmiany o dwuatomowych
cząsteczkach S
2
Gwałtowne ochłodzenie polisiarki w wodzie prowadzi do
otrzymania siarki plastycznej, zbudowanej z długich
łańcuchów
Diagram fazowy siarki
Diagram fazowy to wykres, który pokazuje obszary istnienia
różnych faz w funkcji temperatury i ciśnienia
Linie oddzielają od siebie obszary trwałości różnych faz
T
p
Siarka
rombowa
S
α
Siarka
jednoskośna
S
β
Siarka
ciekła
S
λ
Pary siarki
S
2
Odmiany alotropowe selenu. Inne tlenowce
Selen - podobnie jak S występuje w cząsteczkach Se
8
,
tworząc 3 odmiany alotropowe różniące się ułożeniem
cząsteczek (Se
α
, Se
β
, Se
γ
).
Oprócz tego występuje selen szary (metaliczny) - długie
łańcuchy (trochę podobne do polisiarki)
Tellur występuje w jednej odmianie alotropowej -
łańcuchowej.
Polon jest metaloidem – jako pierwiastek tworzy sieć
typu metalicznego o gęstym upakowaniu (symetria
regularna)
Tlenki
۞
Związki pierwiastków z tlenem, który jest
utleniaczem
(przyjmuje elektrony i ma ujemny
stopień utlenienia)
۞
Można podzielić tlenki ze względu na stopień
utlenienia atomu tlenu:
tlenki normalne – stopień utlenienia
–II
nadtlenki – stopień utlenienia
– I
ponadtlenki – stopień utlenienia
- ½
۞
Wszystkie pierwiastki (z wyjątkiem niektórych
helowców) tworzą tlenki normalne, niektóre tworzą po
kilka połączeń z tlenem
Tlenki normalne
Można je podzielić ze względu na rodzaj
występującego wiązania na:
– jonowe – w stukturze tlenku występują jony O
2-
– MgO, CaO, Na
2
O ...
– kowalencyjne - wiązania pomiędzy tlenem a
pierwiastkiem mają charakter wiązań atomowych
spolaryzowanych
– w tlenkach kowalencyjnych cząsteczkowych można
odróżnić pojedyncze cząsteczki,
– CO, CO
2
, NO, SO
3
, Cl
2
O
7
...
– w niektórych tlenkach występują oba rodzaje wiązań
(takie związki nazywamy anizodesmicznymi),
– Ag
2
O, PbO, SnO ...
Tlenki normalne – klasyfikacja
o
Można je podzielić ze względu na charakter
chemiczny, jaki przejawiają w reakcjach na:
– zasadowe
, w reakcji z wodą dają zasady (są
bezwodnikami zasad) - Na
2
O, BaO, CaO, ....
– kwasowe
, w reakcji z wodą dają kwasy (są
bezwodnikami kwasów) - CO
2
, Cl
2
O
7
, P
4
O
10
, .....
– amfoteryczne
, z kwasami reagują jak
zasady
, z
zasadami jak
kwasy
- Al
2
O
3
, ZnO, SnO, ...
– obojętne
, nie są bezwodnikami kwasów ani zasad, nie
są też amfoteryczne - CO, N
2
O ...
Tlenki normalne – klasyfikacja (c.d.)
Można je podzielić ze względu liczbę
pierwiastków połączonych z tlenem na:
– tlenki proste (binary oxides), połączenie jednego
pierwiastka z tlenem – MeO, X
n
O
m
...
– tlenki złożone (ternary oxides), połączenie więcej
niż jednego pierwiastka z tlenem (Uwaga! to nie są
sole kwasów tlenowych! mimo, że wzory są
podobne i potoczne nazwy też); najczęściej dotyczy to
tlenków metali:
– Perowskity
– ABO
3
– CaTiO
3
, SrTiO
3
, BaTiO
3
,
LaAlO
3
, LiNbO
3
- suma stopni utlenienia A i B
wynosi zawsze +6;
– Spinele
- Me
II
Me
2
III
O
4
– MgAl
2
O
4
, FeAl
2
O
4
,
ZnFe
2
O
4
, MnFe
2
O
4
, FeFe
2
O
4
= Fe
3
O
4
.
Otrzymywanie tlenków
Tlenki wielu pierwiastków, zwłaszcza metali, występują
w przyrodzie;
Tlenki można otrzymać na wiele sposobów:
poprzez spalanie:
na drodze reakcji wymiany:
na drodze reakcji rozkładu np. soli i wodorotlenków:
na drodze innych reakcji
10
4
2
4
2
O
P
5O
P
2MgO
O
2Mg
→
+
→
+
2Fe
O
Al
O
Fe
2Al
3H
O
Fe
O
3H
3Fe
3
2
3
2
2(g)
3
2
(p)
2
+
→
+
+
→
+
↑
+
→
↑
+
→
2
3
2
2
CO
CaO
CaCO
O
H
CuO
Cu(OH)
O
2H
O
V
2H
O
V
O
H
O
Ag
2OH
2Ag
2
3
2
2
5
2
2
2
+
→
+
+
↓
→
+
−
+
Charakter chemiczny tlenków
I
2
O
5
N
2
O
5
SO
3
CO
2
B
2
O
3
BeO
Ga
2
O
3
MgO
Na
2
O
Li
2
O
K
2
O
Rb
2
O
Cs
2
O
CaO
SrO
BaO
Al
2
O
3
Tl
2
O
In
2
O
3
SiO
2
GeO
2
SnO
PbO
P
4
O
10
As
2
O
5
Sb
2
O
3
Bi
2
O
3
PoO
2
Cl
2
O
7
Br
2
O
7
Pierwiastki
bloku s i p
ZrO
2
Y
2
O
3
Ln
2
O
3
Nb
2
O
5
TiO
2
HfO
2
TiO
2
Sc
2
O
3
CrO
3
Ta
2
O
5
V
2
O
5
MoO
3
WO
3
Tc
2
O
7
Mn
2
O
7
Re
2
O
7
CoO
Rh
2
O
3
Fe
2
O
3
IrO
2
PdO
CdO
PtO
NiO
ZnO
HgO
Ag
2
O
Cu
2
O
Au
2
O
Pierwiastki bloku d
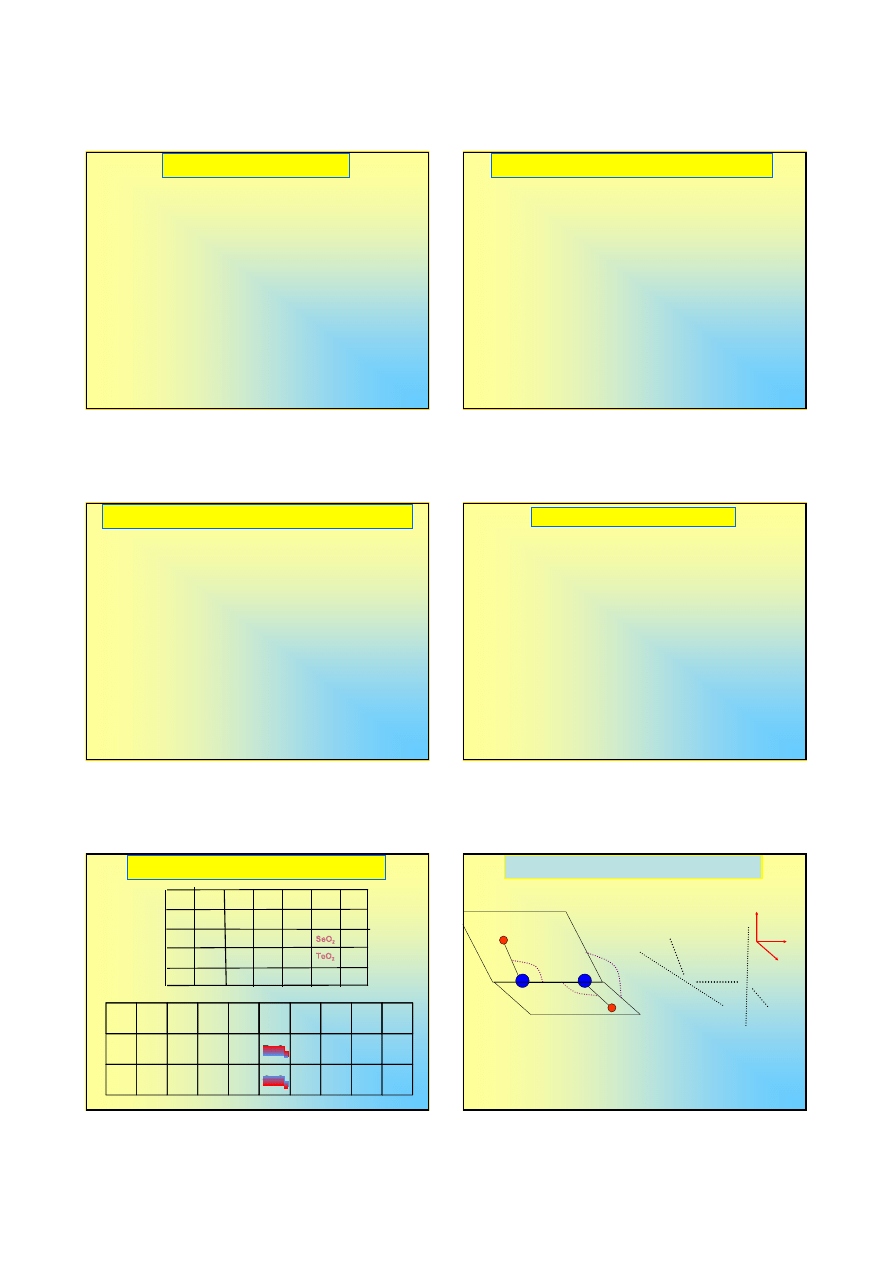
Nadtlenki – nadtlenek wodoru
94
°°°°
91
°°°°
91
°°°°
O
O
H
H
x
y
z
(2p
y
+ 1s
H
)
(2p
x
+ 2p
x
)
(2p
z
+ 1s
H
)
2p
z
wolna para
2p
y
wolna para
Aby wytłumaczyć kształt cząsteczki H
2
O
2
nie trzeba się
uciekać do hybrydyzacji.
Wiązania tlen-wodór mają charakter kowalencyjny
spolaryzowany.
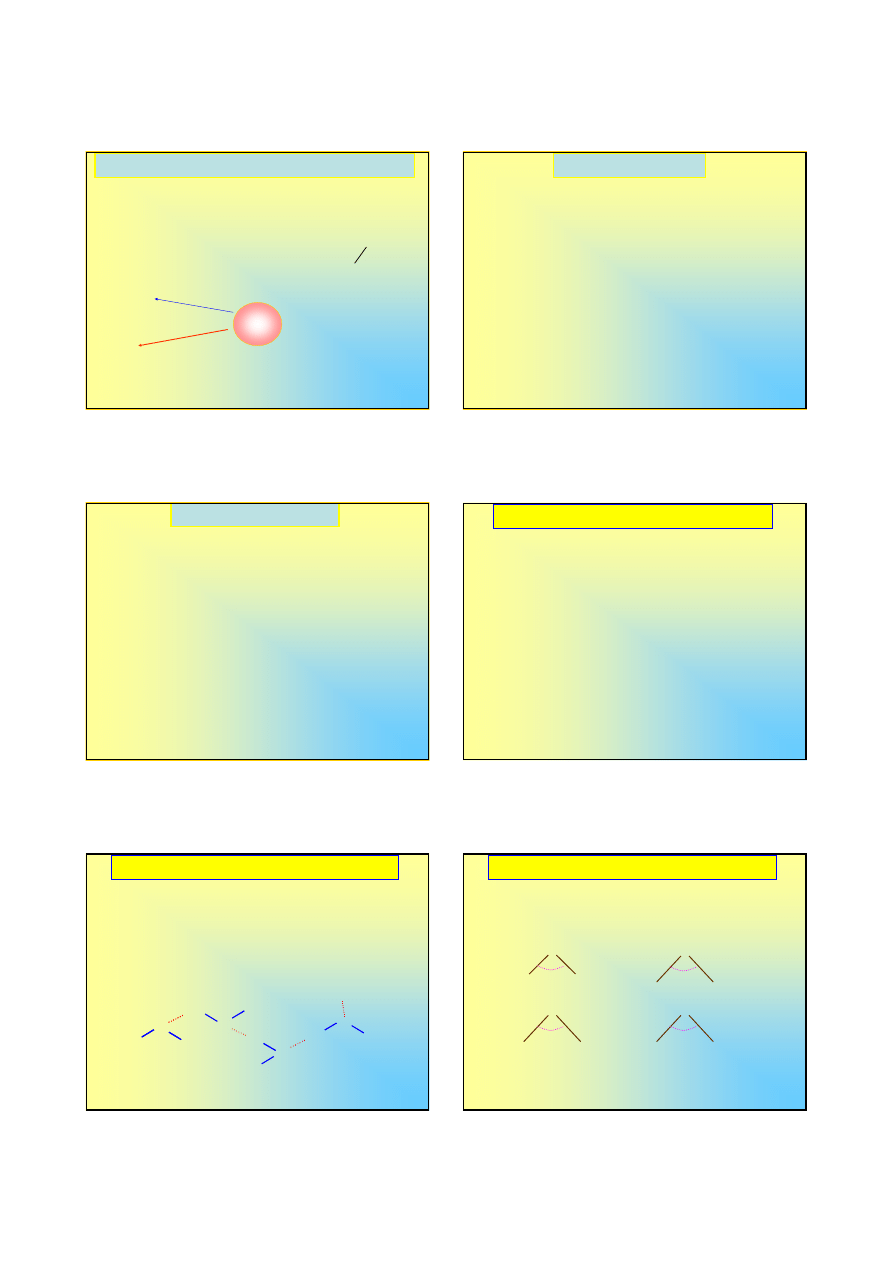
Charakter chemiczny nadtlenku wodoru
Reakcja rozkładu nadtlenku wodoru wiąże się z dyspropor-
cjonowaniem tlenu, z czego wynika, że może on mieć
charakter zarówno utleniający, jak i redukujący:
↑
+
→
2
2
1
2
jonowanie
dysproporc
2
2
O
O
H
O
H
-I
-II
0
H
2
O
2
jako utleniacz
O
H
]
2[Fe(CN)
O
H
]
2[Fe(CN)
2
3
6
2
2
4
6
+
→
+
−
−
+II
+III
-I
-II
jako re
duktor
O
8H
5O
2Mn
6H
O
H
2MnO
2
2
2
2
2
4
+
+
→
+
+
+
+
−
+VII
+2
-I
0
woda utleniona - roztwór 3%
perhydrol - roztwór 30 %
Nadtlenki jonowe
Utlenianie metali alkalicznych prowadzi do otrzymywania
nadtlenków jonowych o właściwościach
utleniających
:
Na
2
O
2
, K
2
O
2
, BaO
2
, CaO
2
, ...
Występuje w nich jon
O
2
2-
, (O─O)
2-
, długość wiązania
tlen-tlen wynosi 149 pm, rząd wiązania – 1. Konfiguracja
elektronowa jak w cząsteczce fluoru (F
2
) – jon i
cząsteczka są izoelektronowe:
O
2
2-
KKσ
2s
2
σ*
2s
2
σ
2px
2
π
2py
2
π
2pz
2
π*
2py
2
π*
2pz
2
Reakcje nadtlenków jonowych z kwasem siarkowym
pozwalaja na otrzymanie nadtlenku wodoru:
2
2
4
2
4
2
2
2
O
H
SO
Na
SO
H
O
Na
+
→
+
Ponadtlenki jonowe
Łagodne utlenianie nadtlenków prowadzi do ponadtlenków,
w których tlen występuje na stopniu utlenienia
-½
, np. KO
2
:
Występuje w nich jon
O
2
-
, (O─O)
-
, długość wiązania
tlen-tlen wynosi 126 pm, rząd wiązania – 1,5.
Konfiguracja elektronowa – pośrednia pomiędzy O
2
i F
2
:
O
2
-
KKσ
2s
2
σ*
2s
2
σ
2px
2
π
2py
2
π
2pz
2
π*
2py
2
π*
2pz
1
Jon O
2
jest dość silnym utleniaczem:
2
2
2
2
-
2
O
2OH
O
H
O
H
2
2O
+
+
→
+
−
Charakter chemiczny tlenowców
W stanie wolnym tlenowce mają charakter
utleniający
; potencjał redoksowy maleje ze
wzrostem masy molowej.
Najczęściej tworzą wiązania kowalencyjne
spolaryzowane – jonowość wiązań maleje ze
wzrostem masy molowej i dodatniego stopnia
utlenienia pierwiastka.
Występują w związkach na stopniach utlenienia od
–II do +VIII, ich charakter redoksowy zmienia się
również ze zmianą stopnia utlenienia
Połączenia tlenowców z wodorem
Wszystkie tlenowce tworzą z wodorem połączenia o
wzorze
H
2
X
– we wszystkich występuje wiązanie
atomowe spolaryzowane z malejącym udziałem
wiązania jonowego, a tlenowcowi przpisujemy
stopień utlenienia
–II
;
W wodzie (H
2
O) występują wiązania wodorowe i
asocjacja cząsteczek
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
Własności wodorków tlenowców
Aby opisać wiązania w wodzie, zakładamy hybrydyzację
sp
3
orbitali atomu tlenu, w pozostałych przypadkach
opisujemy wiązania bez uciekania sie do hybrydyzacji
O
H
H
96
p
m
104,5
°°°°
ciecz
S
H
H
13
5
pm
92
°°°°
gaz
ciecz
Se
H
H
14
6
pm
92
°°°°
ciecz
Te
H
H
16
9
pm
92
°°°°
H
2
O ma właściwości amfiprotyczne, pozostałe wodorki –
słabo kwasowe
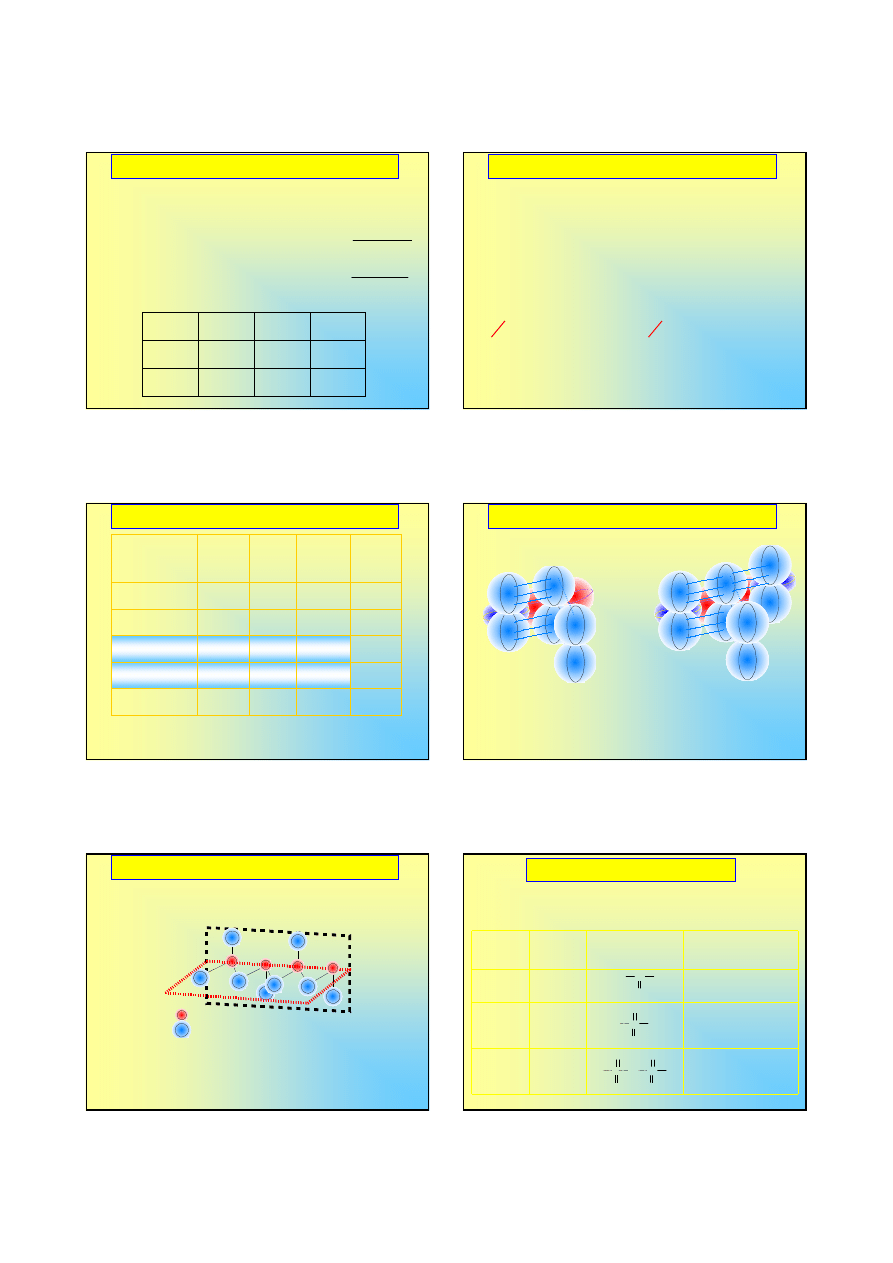
Roztwory wodorków tlenowców
W roztworach wodnych wodorki tlenowców dysocjują
z odszczepieniem protonu:
−
−
+
−
+
⋅
=
+
→
←
+
⋅
=
+
→
←
+
−
+
−
+
HX
X
O
H
X
H
HX
O
H
c
a
a
c
a
a
2
3
2
3
2
2
3
2
-
1
3
2
2
K
X
O
H
O
H
HX
K
HX
O
H
O
H
X
H
H
2
S
H
2
Se
H
2
Te
K
1
10
-7
2·10
-4
2,5·10
-3
K
2
~10
-14
~10
-11
~10
-11
Pochodne wodorków tlenowców
☼
Pochodne wodorków tlenowców mają charakter soli, w
których występuje jon X
2-
lub HX
-
(np.
siarczki
z
jonem
S
2-
lub
wodorosiarczki
z jonem
HS
-
☼
W roztworze nasyconym H
2
S (ok. 0,1 mol/l) na jeden
jon siarczkowy
S
2-
przypada 10
10
(!) jonów
HS
-
;
☼
Siarczki ulegają dwustopniowej lub jednostopniowej
(wodorosiarczki) hydrolizie:
−
+
−
+
+
+
↔
+
+
+
→
+
OH
S
H
Na
O
H
HS
Na
O
H
NaHS
S
H
NaOH
2
2
2
2
zasada I
kwas II
kwas I
zasada II
Połączenia S, Se, Te, Po z tlenem
Stopień
utlenienia
S
Se
Te
Po
+I
S
2
O
+II
SO
TeO
PoO
+IV
SO
2
SeO
2
TeO
2
PoO
2
+VI
SO
3
SeO
3
TeO
3
+VIII
SO
4
Tlenki siarki mają charakter
kwasowy
, tlenki selenu i telluru
również, choć mają także b.słabe własności
zasadowe
Struktura elektronowa SO
2
i SO
3
Tlenek siarki (IV) SO
2
, dwutlenek siarki ma strukturę
elektronową analogiczną do ozonu O
3
S
O
O
wolna
para
S
O
O
O
Orbital π jest trójcentrowy,
zdelokalizowany, rozciąga
się na całą cząsteczkę
Wolna para elektronowa
atomu siarki w cząsteczce SO
3
wiąże czwarty atom tlenu
Orbital π jest czterocentrowy,
zdelokalizowany, rozciąga
się na całą cząsteczkę
Czasteczki SO
2
i SO
3
są płaskie
Tlenki kowalencyjne, ale nie cząsteczkowe
Se
O
Łańcuchowa struktura SeO
2
Uwaga ! Nie ma cząsteczek SeO
2
, a wzór wynika ze
stosunku molowego obu pierwiastków w związku
Struktura tlenków selenu i telluru
Kwasy tlenowe siarki
duża liczba kwasów; stopnie utlenienia siarki
od
-II
do
+VI
, niektóre znane tylko z soli ...
Stopień
utlenienia
Wzór
sumaryczny
Wzór Lewisa
Nazwa
tradycyjna
+IV
H
2
SO
3
kwas siarkowy (IV),
kwas siarkawy
+VI
H
2
SO
4
kwas siarkowy (VI),
kwas siarkowy
+VI
H
2
S
2
O
7
kwas disiarkowy (VI)
kwas pirosiarkowy
S
O
O
O
H
H
S
O
O
O
H
H
O
S
O
O
O
H
H
O
S
O
O
H
O
S
O
O
O
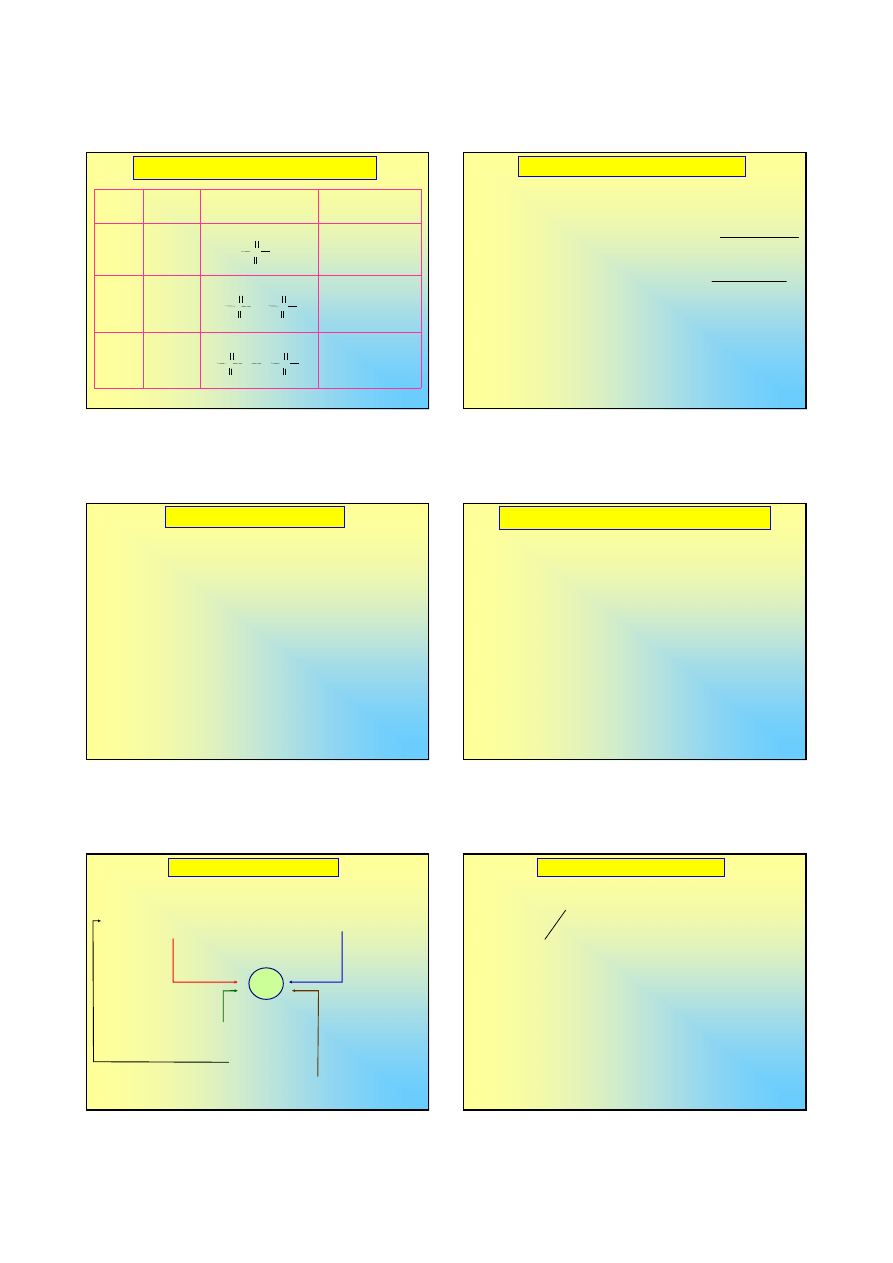
Kwasy tlenowe siarki (c.d.)
Stopień
utlenienia
Wzór
sumaryczny
Wzór Lewisa
Nazwa
+VI i -II H
2
S
2
O
3
kwas tiosiarkowy
+VI
H
2
S
n
O
6
n=2-6
kwasy politionowe
+VI
H
2
S
2
O
8
kwas
nadtlenodisiarkowy
S
O
O
H
H
O
S
S
O
O
O
H
H
O
(S)
n-2
O
O
H
O
S
O
O
S
S
O
O
O
H
H
O
S
O
O
H
O
S
O
O
O
O
O
Kwas siarkowy (IV)
3
2
2
2
SO
H
O
H
SO
↔
+
-
3
2
3
3
3
2
3
3
HSO
SO
O
H
2
2
3
3
2
3
SO
H
HSO
O
H
1
3
3
2
3
2
K
SO
O
H
O
H
HSO
K
HSO
O
H
O
H
SO
H
c
c
c
c
c
c
−
+
−
+
⋅
=
+
↔
+
⋅
=
+
↔
+
−
+
−
−
+
K
1
= 1,6·10
-2
K
2
~ 10
-7
Jest kwasem umiarkowanie słabym. Nie da się otrzymać w
stanie czystym, znane są tylko roztwory oraz sole: obojętne
(anion SO
3
2-
) oraz wodorosiarczany (IV) (anion HSO
3
-
)
Kwas siarkowy (VI)
−
+
−
−
+
+
↔
+
+
→
+
2
4
3
2
4
4
3
2
4
2
SO
O
H
O
H
HSO
HSO
O
H
O
H
SO
H
Kwas siarkowy (VI) jest mocny, ale dysocjacja jonu HSO
4
-
zachodzi tylko w niewielkim stopniu
Znane są dwa rodzaje soli: obojętne
(anion SO
4
2-
)
oraz
wodorosiarczany (VI)
(anion HSO
4
-
)
Sieci krystaliczne wielu siarczanów zawierają cząsteczki
wody wbudowane w ich strukturę w stosunku
stechiometrycznym. Sa to tzw. hydraty. Ich przykładem są
ałuny
O
24H
)
(SO
M
SO
M
2
3
4
III
2
4
I
2
⋅
⋅
M
I
= (Na, K, Rb, Cs, Tl, NH
4
)
+
M
III
= (Al, Cr, Fe, Co, Ga, In, Ti, V)
3+
Ałuny sa przykładem występowania izomorfizmu kryształów.
Przemysłowe wytwarzanie H
2
SO
4
♦
Znany jako „krew" przemysłu chemicznego,
wytwarzany jest od ponad 400 lat !!!
♦
Dawniej "olej witriolowy", "witriol", vitroleum,
otrzymywany przez destylację
FeSO
4
·xH
2
O
(zielony witriol)
♦
Obecnie otrzymywany na skalę przemysłową
metodą kontaktową, składającą się z trzech
etapów:
♠
otrzymywanie SO
2
♠
utlenianie SO
2
do SO
3
♠
reakcja SO
3
z wodą - otrzymywanie H
2
SO
4
Otrzymywanie SO
2
SO
2
a. spalanie siarki
2
2
SO
O
S
→
+
b. spalanie siarczków
2PbO
2SO
3O
2PbS
2
2
+
→
+
c. odsiarczanie
gazu ziemnego
O
2H
2SO
3O
S
2H
2
2
2
2
+
→
+
O
2H
3S
SO
S
2H
2
2
2
+
→
+
d. redukcja anhydrytu
2
2
4
CO
2CaO
2SO
C
2CaSO
+
+
→
+
Utlenianie SO
2
do SO
3
reakcja jest
egzotermiczna
, Q=198 kJ/mol czyli
∆H=-198 kJ/mol
zgodnie z regułą przekory wzrost ciśnienia i/lub
obniżenie temperatury zwiększa wydajność
reakcji ...
3
C
500
,400
O
V
2
2
SO
O
2
1
SO
5
2
→
←
+
−
o
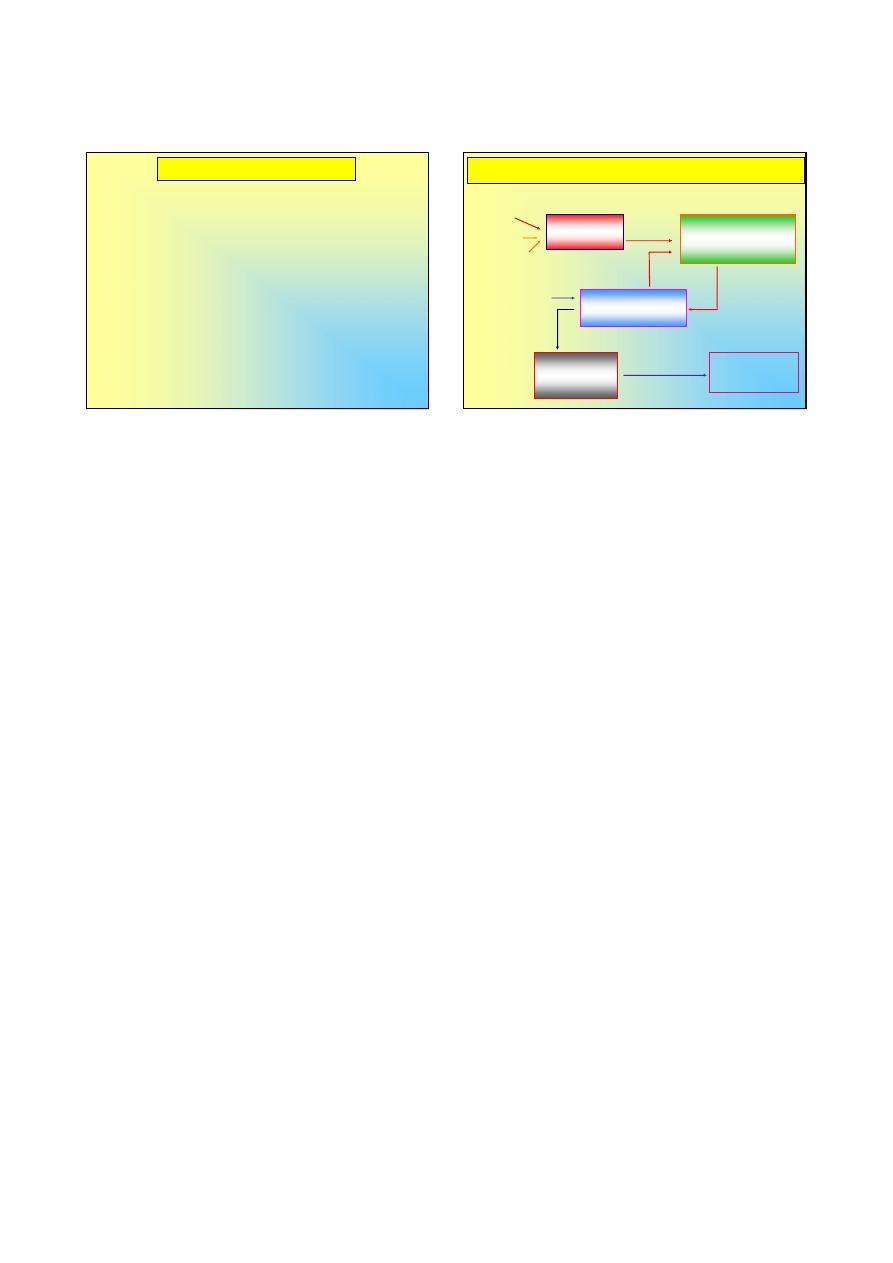
Otrzymywanie H
2
SO
4
Trójtlenek siarki SO
3
słabo rozpuszcza się w
wodzie,dlatego nasyca się nim roztwór H
2
SO
4,
który następnie się rozcieńcza:
)
(
4
2
)
(
2
)
(
7
2
2
)
(
7
2
2
)
(
4
2
)
(
3
SO
H
2
O
S
H
O
S
H
SO
H
SO
aq
c
aq
aq
aq
g
O
H
→
+
→
+
Schemat produkcji H
2
SO
4
metodą kontaktową
H
2
S
siarka
siarczki
spalanie
SO
2
wymiennik ciepła
zimne
powietrze
gorące
powietrze
gorący
SO
3
zimny
SO
3
wieża oleum
H
2
SO
4
+H
2
O
+ H
2
O
98 % H
2
SO
4
SO
2
+½O
2
→
→
→
→
SO
3
aparat kontaktowy
Wyszukiwarka
Podobne podstrony:
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 06 09 10
chemia lato 05 09 10
chemia lato 08 09 10
chemia lato 12 09 10
chemia lato 03 09 10
chemia lato 13 09 10
chemia lato 01 09 10
chemia lato 02 09 10
chemia lato 07 07 08 id 112423 Nieznany
Podstawy finansow i bankowosci - wyklad 07 [09.10.2001], Finanse i bankowość, finanse cd student
chemia lato 07 07 08
chemia lato 10 07 08
chemia lato 09 07 08 id 112430 Nieznany
chemia lato 10 07 08
chemia lato 09 07 08
więcej podobnych podstron