2010-03-18
1
Podstawy analizy chemicznej
Analiza jakościowa
Analiza ilościowa
Dodatkowe podręczniki
•
J.Minczewski, Z.Marczenko – Chemia
analityczna, PWN Warszawa, wydania od 1965
do chwili obecnej,
•
Skrypt „Wybrane zagadnienia z chemii
analitycznej”
•
Podręczniki chemii fizycznej (do wybranych
zagadnień)
Podstawy analizy jakościowej
Co jest w mojej probówce ??!!
♦
Charakterystyczne zabarwienie związków stałych
lub ich roztworów wodnych;
♦
Tworzenie nierozpuszczalnych w wodzie osadów z
odpowiednimi odczynnikami;
♦
Tworzenie związków kompleksowych o
charakterystycznym zabarwieniu;
♦
Barwienie płomienia na charakterystyczny kolor.
Charakterystyczne zabarwienie
♠
Wiele związków chemicznych absorbuje
promieniowanie światła widzialnego w
charakterystyczny sposób, co jest przyczyną ich
zabarwienia;
♠
Związki o barwie białej nie absorbują wcale
promieniowania widzialnego, czarne – absorbują
całe widmo promieniowania;
♠
Zabarwienie może pochodzić od anionu lub
kationu;
♠
Zabarwienie w roztworze wodnym pochodzi
zwykle od barwy odpowiedniego akwakompleksu
lub kompleksu z anionami w przypadku kationów,
lub od zabarwienia anionu.
Charakterystyczne zabarwienie
niektóre przykłady
Kation
Zabarwienie
Anion
Zabarwienie
Cu
2+
niebieskie
CrO
4
2-
żółte
Co
2+
bezw.
niebieskie
Cr
2
O
7
2-
pomarań-
czowe
Co
2+
roztwór
różowe
MnO
4
-
fioletowe
Ni
2+
zielone
[Fe(CN)
6
]
3-
zielonkawe
Cr
3+
szaro-
niebieskie
[Fe(CN)
6
]
4-
żółtawe
Osady nierozpuszczalne w wodzie
Wodorotlenki
Dobrze rozpuszczalne w wodzie
wi
ę
kszo
ść
wodorotlenków 1 i 2 gr.
układu okresowego oraz NH
4
+
Kwasy
Wi
ę
kszo
ść
dobrze rozpuszczalna, z
wyj
ą
tkiem kwasów krzemu i
niektórych kwasów organicznych
Sole dobrze
Wi
ę
kszo
ść
soli Na
+
, K
+
, NH
4
+
,
rozpuszczalne
wszystkie azotany (V), chlorki z
wyj
ą
tkiem AgCl, PbCl
2
, Hg
2
Cl
2
siarczany (VI) z wyj
ą
tkiem BaSO
4
,
SrSO
4
, CaSO
4
,
Sole trudno
Siarczki, w
ę
glany, fosforany (V) –
rozpuszczalne
rozpuszczalne tylko sole Na
+
, K
+
,
NH
4
+
; wodorosole rozpuszczaj
ą
si
ę
w wodzie
2010-03-18
2
Rozpuszczalność
Roztwór nasycony – osiągający najwyższe
mozliwe stężenie (w danej temperaturze);
Rozpuszczalnością związku nazywamy stężenie
roztworu nasyconego;
Roztwór nasycony pozostaje zazwyczaj w stanie
równowagi ze swoim osadem (dotyczy
związków trudno rozpuszczalnych w wodzie) -
nie ma właściwie związków całkowicie
nierozpuszczalnych;
Reakcja charakterystyczna (jakościowa) na
obecność danego jonu w roztworze polega na
dodaniu odczynnika zawierającego jon, tworzący
z nim związek trudno rozpuszczalny w wodzie;
Jeżeli iloczyn rozpuszczalności jest bardzo niski,
reakcję można stosować do ilościowego
określenia zawartości danego jonu w roztworze.
Iloczyn rozpuszczalności
Iloczyn rozpuszczalności obejmuje aktywności
podniesione do odpowiednich wykładników
(współczynników stechiometrycznych)
AB
A
B
s
( )
← →
+
+
−
L
A
B
=
⋅
+
−
[
] [
]
A B
A
B
s
2
2
2
( )
← →
+
+
−
L
A
B
=
⋅
+
−
[
] [
]
2
2
A B
A
B
s
2
3
3
2
2
3
( )
← →
+
+
−
L
A
B
=
⋅
+
−
[
] [
]
3
2
2
3
AB
A
B
s
3
3
3
( )
← →
+
+
−
L
A
B
=
⋅
+
−
[
] [
]
3
3
Wspólny jon a rozpuszczalność
AgCl
Ag
Cl
← →
+
+
−
L
x
Ag
Cl
=
=
⋅
= ⋅
+
−
−
2
10
1 10
[
] [
]
x
Ag
Cl
L
=
=
=
=
+
−
−
[
] [
]
10
5
Jeśli po ustaleniu się równowagi do roztworu nasyconego soli trudno
rozpuszczalnej dodamy elektrolitu dobrze rozpuszczalnego
o jonie
wspólnym
, to nastąpi zmniejszenie rozpuszczalności:
Po dodaniu 0,01 mola NaCl:
L
Ag
Cl
=
⋅
= ⋅
+
−
−
[
] [
]
1 10
10
x
Ag
L
Cl
=
=
=
=
+
−
−
−
−
[
]
[
]
10
10
10
10
2
8
Obecność wspólnego jonu znacząco obniża rozpuszczalność związków
trudno rozpuszczalnych
Wspólny jon a rozpuszczalność (2)
Fe OH
Fe
OH
(
)
3
3
3
← →
+
+
−
L
x
Fe
OH
=
=
⋅
= ⋅
+
−
−
27
1 10
4
3
3
37
[
] [
]
x
Fe
OH
L
=
=
=
=
⋅
+
−
−
[
]
[
]
,
3
4
10
3
27
2 47 10
Efekt wspólnego jonu zależy od równania dysocjacji
(rozpuszczania) związku trudno rozpuszczalnego:
Po dodaniu 0,01 mola NaOH:
L
Fe
OH
=
⋅
= ⋅
+
−
−
[
] [
]
3
3
37
1 10
x
Fe
L
OH
=
=
=
=
+
−
−
−
−
[
]
[
]
3
3
37
6
31
10
10
10
Obecność wspólnego jonu obniża w tym przypadku
rozpuszczalność wodorotlenku żelaza (III) o 21 rzędów !
Wspólny jon a rozpuszczalność (3)
Dwie sole trudno rozpuszczalne:
W roztworze znajduje się 0,001 mola chlorku potasu oraz 0,001 mola
chromianu (VI) potasu. Do roztworu dodawano kroplami 0,01 M
roztwór azotanu srebra. Jaki osad wytrąci się z tego roztworu ?
12
4
2
-
2
4
-10
-
10
1
L
CrO
Ag
CrO
2Ag
10
1
L
AgCl
Cl
Ag
−
+
+
⋅
=
↓
→
←
+
⋅
=
↓
→
←
+
Obliczamy przy jakim stężeniu jonów srebrowych będą się wytrącać
poszczególne osady:
5
3
12
2
4
CrO
Ag
4
2
7
3
10
10
2
,
3
10
10
]
[
]
[Ag
CrO
Ag
10
10
10
]
[
]
[Ag
AgCl
4
2
−
−
−
−
+
−
−
−
−
+
⋅
=
=
=
=
=
=
CrO
L
Cl
L
AgCl
Wspólny jon a rozpuszczalność (4)
Jak widać z obliczeń, wytrącanie chlorku srebra będzie odbywało
się najpierw, gdyż do jego wytrącenia tego osadu potrzebne jest
prawie sto razy mniejsze stężenie jonów srebrowych.
Wynika to z faktu, że rozpuszczalność chromianu (VI) srebra jest
wyższa (mimo, że iloczyn rozpuszczalności jest niższy).

2010-03-18
3
„Obcy” jon a rozpuszczalność
Czy dodatek soli, która
nie ma wspólnego jonu
z osadem zmienia rozpuszczalność soli ?
Tak, gdyż zmianie ulega siła jonowa roztworu –
zmienia się zatem (zgodnie z prawem Debeye’a
– Hückla) średni współczynnik aktywności
Skoro ulega zmianie aktywność (rośnie, gdyż
rośnie siła jonowa), to przy jej wzroście maleje
rozpuszczalność soli
„Obcy” jon a rozpuszczalność (2)
AgCl
Ag
Cl
← →
+
+
−
L
x
Ag
Cl
=
=
⋅
= ⋅
+
−
−
2
10
1 10
[
] [
]
x
Ag
Cl
L
=
=
=
=
+
−
−
[
]
[
]
10
5
Jeśli po ustaleniu się równowagi do roztworu nasyconego soli
trudno rozpuszczalnej dodamy elektrolitu dobrze
rozpuszczalnego
nie posiadającego jonu wspólnego
, to nastąpi
zmniejszenie rozpuszczalności, gdyż zmieni się siła jonowa
roztworu i współczynnik aktywności:
Po dodaniu 0,01 mola NaNO
3
:
L
Ag
Cl
f
=
⋅
⋅
= ⋅
+
−
−
[
] [
]
2
10
1 10
x
Ag
Cl
L
=
=
=
=
⋅
+
−
−
[
]
[
]
,
,
1124
8 9 10
6
Obecność soli bez wspólnego jonu również obniża rozpuszczalność
związków trudno rozpuszczalnych, gdyż zmienia się współczynnik
aktywności
(
)
1
004
,
1
;
10
2
,
3
;
10
1
1
5
5
2
2
2
1
≈
=
⋅
=
=
⋅
+
⋅
=
−
−
−
+
f
I
c
c
I
Cl
Ag
(
)
124
,
1
;
1
,
0
;
01
,
0
1
1
10
2
2
2
1
5
3
=
=
=
⋅
+
⋅
+
=
−
+
−
f
I
c
c
I
NO
Na
Iloczyn rozpuszczalności - przykłady
Substancje słabo rozpuszczalne:
związek
iloczyn
rozp.
pK
L
związek
iloczyn
rozp.
pK
L
MgCO
3
1·10
-5
5,0
Mg(OH)
2
1,99·10
-11
10,7
CaCO
3
3,91·10
-9
8,4
Ca(OH)
2
5,01·10
-6
5,3
SrCO
3
1·10
-9
9,0
PbCl
2
1,59·10
-5
4,8
BaCO
3
5,91·10
-9
8,3
PbBr
2
3,81·10
-5
4,4
Ca SO
4
2,51·10
-5
4,6
PbI
2
6,31·10
-9
8,2
Sr SO
4
2,51·10
-7
6,6
CuCO
3
2,51·10
-10
9,6
Ba SO
4
1·10
-10
10,0
CuC
2
O
4
3,16·10
-8
7,5
Iloczyn rozpuszczalności - przykłady
Substancje bardzo słabo rozpuszczalne:
związek
iloczyn
rozp.
pK
L
związek
iloczyn
rozp.
pK
L
AgCl
1·10
-10
9,8
Fe(OH)
3
1·10
-37
37,0
AgBr
5,01·10
-13
12,3
Al(OH)
3
5,01·10
-33
32,3
AgI
7,94·10
-16
16,1
SnOH)
4
1·10
-56
56,0
Ag
2
S
6,31·10
-50
49,2
PbS
2,51·10
-27
26,6
HgI
2
3,98·10
-29
28,4
CuS
6,31·10
-36
35,2
HgS
1,58·10
-52
51,8
CdS
7,94·10
-27
26,1
Bi(OH)
3
3,98·10
-31
30,4
Ca
3
(PO
4
)
2
1·10
-26
26,0
Rozdzielanie mieszanin (1)
Roztwór
i
osad(y)
stanowią dwie (lub więcej) różne
części składowe dwufazowej mieszaniny
Analiza jakościowa
– wytrącenie się osadu stanowi
reakcję charakterystyczną kationu lub anionu i pozwala
na stwierdzenie, co zawiera badana substancja. Zwykle
trzeba przeprowadzić więcej niż jedną reakcję
charakterystyczną;
Analiza ilościowa
– znając skład jakościowy badanej
substancji wytrącamy osad o znanym składzie. Jeżeli
iloczyn rozpuszczalności osadu jest niski (substancje
bardzo słabo rozpuszczalne), uważamy, że osad wytrąca
się całkowicie, co pozwala na określenie dokładnej ilości
badanej substancji w roztworze
Rozdzielanie mieszanin (2)
*
Mieszaniny
da się rozdzielić przy pomocy procesów
fizycznych, związków chemicznych nie da się w ten
sposób rozdzielić na pierwiastki
*
Rozdzielanie mieszanin odbywa się z wykorzystaniem
różnic we właściwościach fizycznych poszczególnych ich
składników. Celem rozdzielania może być również
oczyszczanie substancji.
–
składniki różnią się stanem skupienia:
•
oddzielenie ciała stałego od cieczy - sączenie, dekantacja,
sedymentacja, (odwirowanie)
–
składniki różnią się rozpuszczalnością w roztworze:
•
krystalizacja
•
ekstrakcja
–
składniki różnią się temperaturą wrzenia:
•
destylacja
•
sublimacja
2010-03-18
4
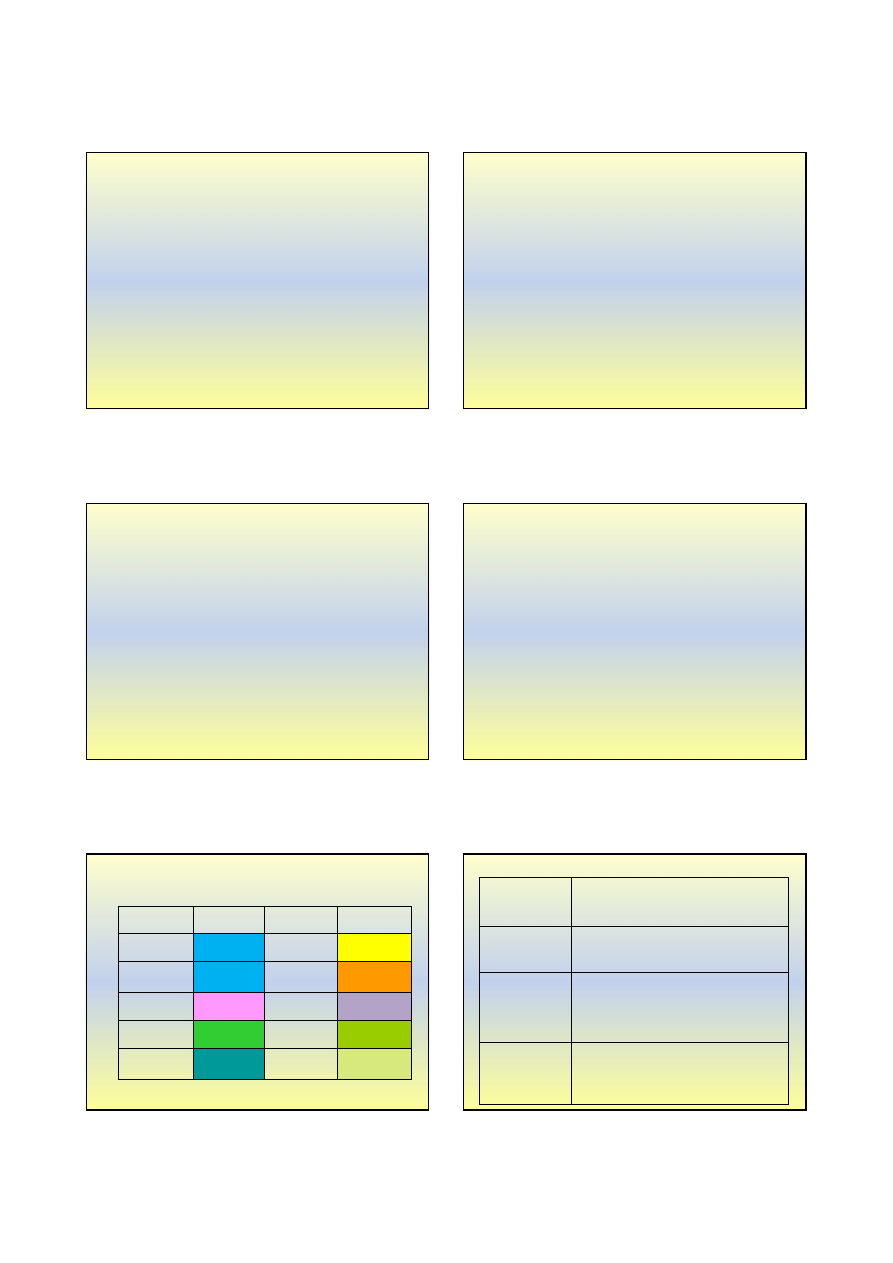
Sedymentacja, dekantacja i sączenie
♦
sedymentacja
- zawieszone w cieczy cząstki opadają pod
wpływem grawitacji na dno naczynia;
♦
dekantacja
- po przeprowadzeniu sedymentacji oddziela się
ciecz od osadu i powtórnie przemywa w celu usunięcia
zanieczyszczeń;
♦
sączenie
- oddzielanie osadu od cieczy przy pomocy filtra
nieprzepuszczalnego dla osadu
dekantacja
sedymentacja
sączek
osad
lejek
sączenie
Krystalizacja
•
Krystalizacja
opiera się na różnicy rozpuszczalności lub
różnicy temperatur krzepnięcia (topnienia)
krystalizacja z roztworu
nasycony roztwór CuSO
4
kryształy CuSO
4
@5H
2
O
Ekstrakcja
•
Ekstrakcja
opiera się na różnicy rozpuszczalności tego
samego związku w dwóch cieczach lub różnicy
rozpuszczalności dwóch związków w stanie stałym w tej
samej cieczy
roztwór jodu
w chloroformie
roztwór jodu
w wodzie
I
2
ekstrakcja przy pomocy
rozpuszczalnika
woda i CHCl
3
nie mieszają się
ze sobą
herbata
proces parzenia herbaty to
też ekstrakcja, choć służy do
tworzenia mieszaniny, a nie
jej rozdziału ...
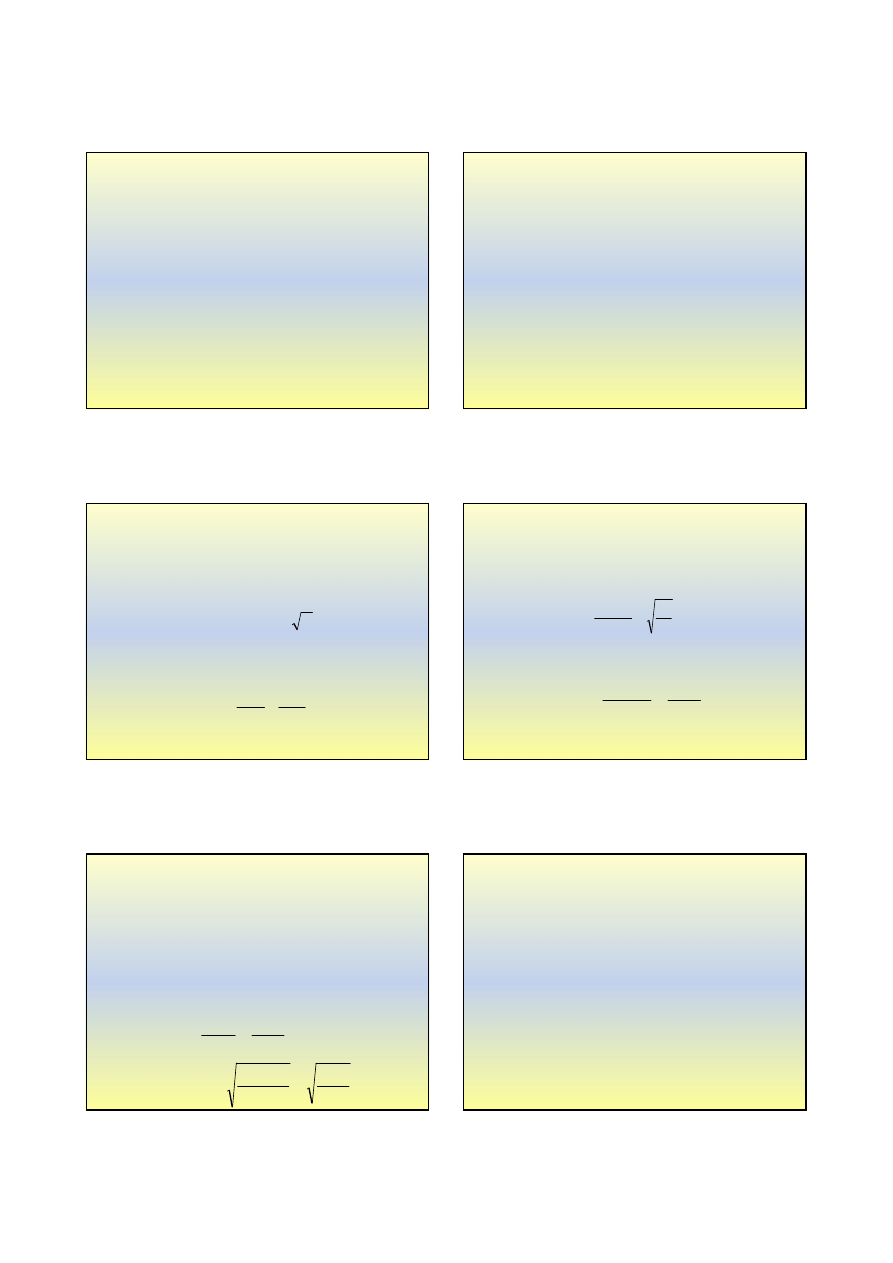
Destylacja
•
Destylacja
opiera się na różnicy temperatur wrzenia
dwóch cieczy
wrząca mieszanina
dwóch cieczy
termometr
chłodnica
w odbieralniku zbiera
się ciecz bardziej lotna
w kolbie pozostaje ciecz
mniej lotna
skraplanie pary
pary bardziej lotnego
składnika
Sublimacja
* Sublimacja
to zjawisko bezpośredniej przemiany
ciała stałego w parę, a
resublimacja
to przemiana
pary w ciało stałe
ogrzewanie
kryształy jodu, które
ulegają sublimacji
pary jodu (I
2
)
kryształy jodu, powstałe
na skutek resublimacji
naczynie chłodzone,
np. wodą
OCZYSZCZANIE
JODU
PRZEZ
SUBLIMACJĘ
Podział osadów
•
Osady dzielimy na:
–
krystaliczne
, które składają się z ziaren
(polikryształów) o uporządkowanej budowie (np.
BaSO
4
lub MgNH
4
PO
4
). Wytrącają się, gdy pod
wpływem czynnika strącającego zostanie
przekroczony iloczyn rozpuszczalności;
–
koloidalne
, w których cząstki substancji trudno
rozpuszczalnej łączą się w konglomeraty,
obdarzone jednakowymi ładunkami elektrycznymi.
Odpychając się tworząc zol, czyli pseudoroztwór
koloidalny, pod wpływem temperatury lub
odpowiedniego elektrolitu następuje ich
koagulacja i powstaje żel, czyli osad koloidalny.
2010-03-18
5
Osady krystaliczne
♦
Wytrącanie kryształów, czyli krystalizacja odbywa się z
udziałem zarodków. Im mniejsza jest ich liczba, tym
większe są kryształy;
♦
Starzenie się osadu polega na jego rekrystalizacji, czyli
rozpuszczaniu się mniejszych kryształów, których
kosztem rosną większe;
♦
Zbyt szybkie wytrącanie osadu krystalicznego może
ponadto prowadzić do otrzymania osadu
zanieczyszczonego przez adsorpcję i okluzję ;
♦
Jeżeli warunki strącania dwóch osadów są podobne,
może dojść do współstrącania, czyli równoczesnego
wytrącania się dwóch trudno rozpuszczalnych soli
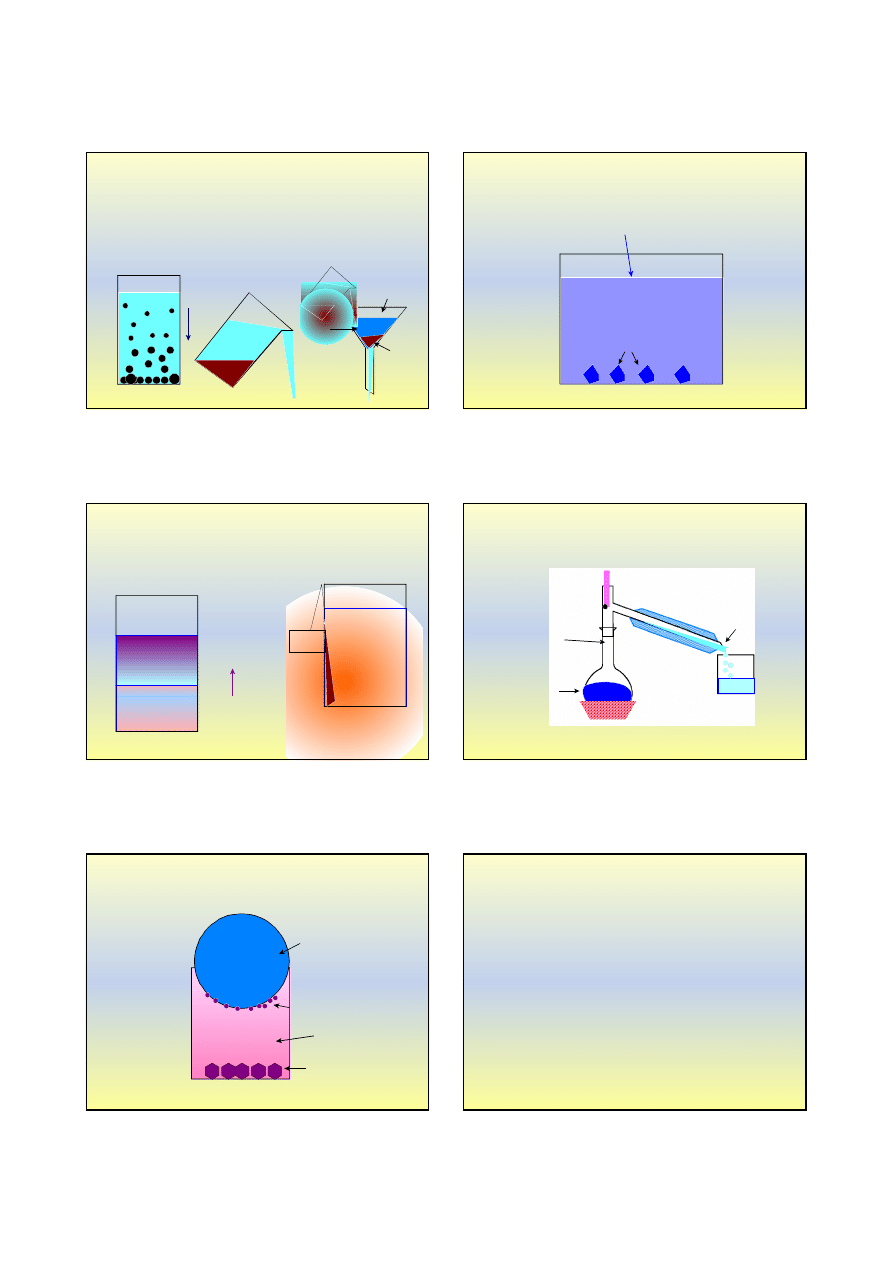
Osady koloidalne
♦
Dzielimy je na hydrofobowe (koagulacja odbywa się
nawet pod wpływem wody) oraz hydrofilowe
(koagulacja prowadzi do tworzenia galaretowatych
osadów z dużą zawartością wody);
♦
Okluzja i adsorpcja (osady koloidalne mają dużą
pwierzchnię) prowadzą do znacznych zanieczyszczeń –
konieczne jest przemywanie osadu roztworem
elektrolitu, aby zapobiec peptyzacji. Można go również
rozpuścić i wytrącić powtórnie.
ż
el
zol
peptyzacja
koagulacja
←
→
Wpływ pH na reakcje strącania
►
Wytrącony osad substancji amfoterycznej (amfolitu)
może ulec rozpuszczeniu w nadmiarze odczynnika
strącającego [jeśli są nim np. jony OH
-
] :
−
+
+
−
+
+
→
←
→
←
+
+
3OH
Al
Al(OH)
AlO
O
H
3
O
H
3(s)
OH
2
3
3
-
13
2
3
HAlO
25
3
Al(OH)
10
4
]
[AlO
]
O
[H
K
10
8
]
[OH
]
[Al
K
2
3
−
−
+
−
−
+
⋅
=
⋅
=
⋅
=
⋅
=
Jak widać z powyższego, istnieje pewien zakres pH (inny
dla każdej substancji amfoterycznej), w którym osad jest
nierozpuszczalny w wodzie
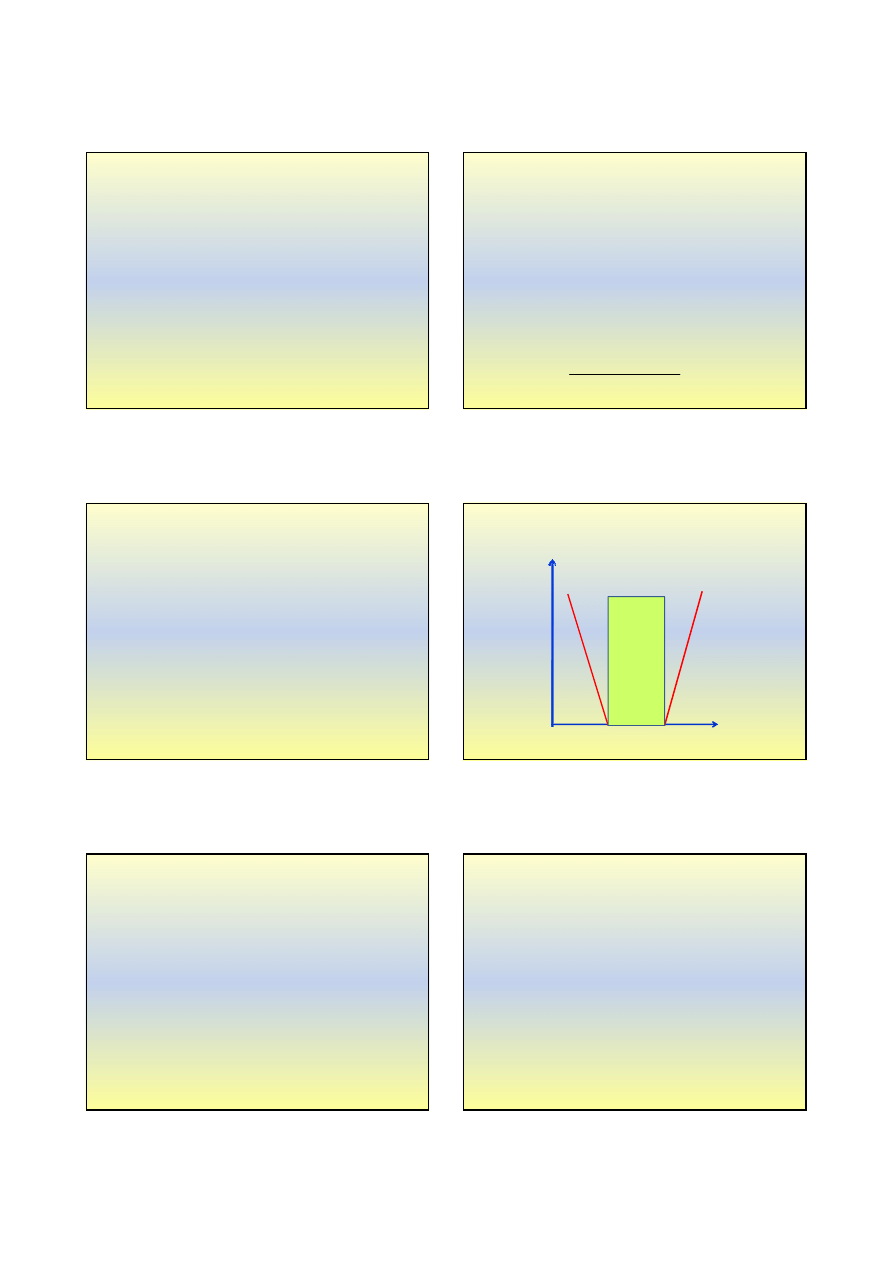
Wpływ pH na reakcje strącania (2) –
rozpuszczalność osadu w funkcji pH
pH
log R
Al
3+
AlO
-
2
O
p
ty
m
a
ln
y
z
a
k
re
s
p
H
Inne czynniki wpływające na wytrącanie
osadów
♦
Tworzenie się jonów kompleksowych (zależy od stałej
trwałości kompleksu);
♦
Hydroliza soli trudno rozpuszczalnej
♦
Utlenianie lub redukcja substancji wytrącanej w postaci
osadu (lub obecnej w roztworze)
Analiza ilościowa – wagowa (1)
♦
Analiza wagowa opiera się na wytrącaniu związków trudno
rozpuszczalnych z roztworów badanych soli – ich
rozpuszczalność nie powinna przekraczać 10
-4
mol·dm
-3
–
wówczas w roztworze pozostaje najwyżej 0,1-0,2 mg
oznaczanego składnika;
♦
Osad musi mieć ściśle określony skład chemiczny o stałej
zawartości oznaczanego składnika – zmiany zachodzące w
czasie suszenia czy prażenia muszą przebiegać ilościowo;
♦
Pożądana jest znaczna masa molowa osadu, w którym
masa oznaczanego składnika stanowi niewielki procent
(zmniejsza się w ten sposób błąd oznaczenia)
2010-03-18
6
Analiza wagowa (2)
♦
Osady te oddziela się od roztworu – który nie powinien już
zawierać substancji oznaczanej – i przeprowadza w
wysokiej (lub podwyższonej) temperaturze w związki o
ściśle określonym składzie;
♦
Przy pomocy wagi analitycznej ustala się masę
otrzymanego po wyprażeniu (suszeniu) związku;
♦
Znając skład końcowego związku i jego masę można
obliczyć zawartość szukanego pierwiastka (związku, jonu)
w badanej mieszaninie
Optymalne warunki strącania osadu
1.
Strącanie z roztworu rozcieńczonego;
2.
Powolne dodawanie odczynnika strącającego;
3.
Mieszanie w czasie strącania;
4.
Wytrącanie z gorącego roztworu gorącym odczynnikiem
strącającym;
5.
Odpowiedni nadmiar odczynnika strącającego;
6.
Sączenie w warunkach odpowiednich (świeży osad dla
osadów koloidalnych, osad „po starzeniu” dla osadów
krystalicznych).
Przykłady oznaczeń wagowych
Oznaczana
substancja
Wytrącany osad/
odczynnik strącający
Skład osadu po
prażeniu lub suszeniu
jony Ba
2+
BaSO
4
jonami SO
4
2-
BaSO
4
jony SO
4
2-
BaSO
4
jonami Ba
2+
BaSO
4
jony Al
3+
Al(OH)
3
za pomocą NH
3
aq
Al
2
O
3
jony Fe
3+
Fe(OH)
3
za pomocą NH
3
aq
Fe
2
O
3
jony Ag
+
AgCl za pomocą HCl
AgCl
jony PO
4
3-
MgNH
4
PO
4
·6H
2
O
Mg
2
P
2
O
7
jony Zn
2+
ZnS za pomocą H
2
S [(NH
4
)
2
S] ZnO
jony Hg
2+
HgS za pomocą H
2
S [(NH
4
)
2
S] HgS
Wyszukiwarka
Podobne podstrony:
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 04 09 10
chemia lato 06 09 10
chemia lato 05 09 10
chemia lato 07 09 10
chemia lato 08 09 10
chemia lato 12 09 10
chemia lato 03 09 10
chemia lato 13 09 10
chemia lato 01 09 10
IS wyklad 02 09 10 08 MDW
fiszki 02 09 i 10
chemia lato 09 09 10
10 02 09
chemia, 02 09
więcej podobnych podstron