
CZĘŚĆ
6
O
nk
ologia i hema
tologia
738
104
Ostra i przewlekła białaczka
szpikowa
Meir Wetzler, John C. Byrd, Clara D. Bloomfi eld
Białaczki szpikowe stanowią heterogenną grupę chorób charakte-
ryzujących się zajęciem krwi, szpiku i innych tkanek przez nowo-
tworowe komórki wywodzące się z układu krwiotwórczego. W roku
2006 liczba nowych przypadków białaczek szpikowych w Stanach
Zjednoczonych wyniosła 16 430. Białaczki szpikowe obejmują sze-
rokie spektrum nowotworów, od tych, które nieleczone postępują
wolno, do tych o przebiegu szybkim i prowadzących do śmierci.
W oparciu o przebieg kliniczny przypadków nieleczonych opraco-
wano tradycyjny podział na białaczki ostre i przewlekłe.
OSTRA BIAŁACZKA SZPIKOWA
WYSTĘPOWANIE
Częstość występowania ostrej białaczki szpikowej (acute myeloid
leukemia – AML) wynosi około 3,7 na 100 000 osób w ciągu roku
i jest większa u mężczyzn niż u kobiet (4,6 versus 3,0). Zwiększa się
ona z wiekiem; przed 65. rokiem życia wynosi 1,9, a po ukończeniu
65 lat rośnie do 18,6. W ciągu ostatnich 10 lat odnotowano znaczący
wzrost zachorowalności na AML.
ETIOLOGIA
W rozwoju AML dużą rolę odgrywają czynniki dziedziczne, pro-
mieniowanie jonizujące, narażenie zawodowe, głównie na środki
chemiczne, oraz leki. Nie ma bezpośrednich dowodów na etiologię
wirusową.
Czynniki dziedziczne. Częstsze występowanie AML wykazano w pew-
nych zespołach chorobowych z aneuploidią chromosomów soma-
tycznych, np. w zespole Downa (trisomia 21). Dziedziczne choroby,
związane z defektem naprawy DNA, takie jak niedokrwistość Fan-
coniego, zespół Blooma, zespół ataksja-teleangiektazja, także wiążą
się z częstym rozwojem AML. W ostrą białaczkę szpikową może
ewoluować zespół Kostmanna, u podłoża którego występuje muta-
cja genu receptora dla granulocytarnego czynnika wzrostu (G-CSF)
oraz elastazy neutrofi lowej. Zespoły mieloproliferacyjne mogą tak-
że transformować w AML (rozdz. 103). Zwiększoną predyspozycją
do rozwoju AML skutkują także mutacje genów C/EBP
α (CCAAT/
enhancer-binding protein
α), RUNX1 (runt-related transcription fac-
tor 1) i TP53 (tumor protein p53) w obrębie niektórych linii zarod-
kowych.
Promieniowanie jonizujące. Zwiększone występowanie białaczek szpi-
kowych stwierdzono w grupie osób, które przeżyły wybuch bomby
atomowej w Japonii podczas II wojny światowej, ze szczytem w okre-
sie 5-7 lat po ekspozycji. Wydaje się, że sama radioterapia związana
jest z niewielkim ryzykiem rozwoju AML, ale w połączeniu z przyj-
mowaniem leków alkilujących znacznie to ryzyko zwiększa.
Ekspozycja na środki chemiczne i inne. Ryzyko zachorowania na AML
zwiększa ekspozycja na benzen, używany jako rozpuszczalnik w za-
kładach chemicznych, wytwarzających materiały plastikowe, gumo-
we oraz leki. Częstsze występowanie AML stwierdzono także u pa-
laczy oraz ludzi narażonych na kontakt z produktami przemiany
ropy naft owej, farbami, płynami balsamującymi, tlenkiem etylenu,
herbicydami i pestycydami.
Leki. Główną przyczyną rozwoju związanej z leczeniem AML jest
przyjmowanie leków przeciwnowotworowych. Białaczka zależna od
leków alkilujących występuje w okresie 4-6 lat od ekspozycji i cha-
rakteryzuje się aberracjami chromosomu 5 i 7. Białaczki będące
następstwem przyjmowania inhibitorów topoizomerazy II rozwijają
się w okresie 1-3 lat po leczeniu i cechują się aberracjami 11q23.
Opisano także uszkodzenie szpiku z następowym rozwojem AML
po chloramfenikolu, fenylbutazonie i (rzadziej) po chlorochinie
oraz metoksypsoralenie.
KLASYFIKACJA
Klasyfi kacja WHO (World Health Organization) (tab. 104-1) wy-
odrębnia różne pod względem biologicznym jednostki w oparciu
o cechy kliniczne, morfologiczne, immunofenotypowe, a także
obecność nieprawidłowości cytogenetycznych i molekularnych.
W przeciwieństwie do poprzednio stosowanej klasyfi kacji FAB
(French-American-British), podział WHO w ograniczonym stopniu
opiera się na wynikach badań cytochemicznych. Ponieważ w naj-
nowszej literaturze, a także w aktualnie prowadzonych badaniach
klinicznych używa się klasyfi kacji FAB, została ona również przy-
toczona w tabeli 104-1. Główną różnicą pomiędzy podziałami FAB
i WHO jest graniczna wartość blastów odróżniająca AML i zespoły
mielodysplastyczne (MDS); jest to 20% w klasyfi kacji WHO i 30%
w klasyfi kacji FAB. AML, rozpoznana zgodnie z kryteriami WHO
i z odsetkiem blastów 20-30%, może pozytywnie zareagować na le-
czenie zalecane głównie dla MDS (decytabina lub 5-azacytydyna)
i w przeszłości zaakceptowane przez FDA (Food and Drug Admini-
stration) w oparciu o badania posługujące się klasyfi kacją FAB.
Szczególnie istotne jest to, że po raz pierwszy w klasyfi kacji WHO
uwzględniono nieprawidłowości genetyczne oraz cechy morfolo-
giczne w celu wyodrębnienia różnych podtypów AML.
Immunofenotyp a klasyfi kacja WHO. Immunofenotyp komórek ludz-
kich białaczek szpikowych może być zbadany techniką cytometrii
przepływowej, z użyciem przeciwciał monoklonalnych skierowa-
nych przeciwko antygenom powierzchniowym. Wyniki badań są
użyteczne w odróżnieniu AML od ostrej białaczki limfoblastycznej
(acute lymphoblastic leukemia – ALL) i identyfi kacji niektórych ty-
pów AML. Na przykład AML minimalnie zróżnicowana (komórki
z cechami niedojrzałości i niespecyfi cznymi liniowo wynikami reak-
cji cytochemicznych) jest rozpoznawana dzięki wykryciu w cytome-
trze przepływowym ekspresji antygenów mieloidalnych CD13 lub
CD33. Podobnie ostrą białaczkę megakarioblastyczną często można
rozpoznać tylko dzięki ekspresji antygenu specyfi cznego dla linii
megakariocytowej CD41 i/lub CD61. Mimo że cytometria prze-
pływowa jest użyteczna i szeroko stosowana oraz że w niektórych
przypadkach ma kluczowe znaczenie dla rozpoznania AML, ma ona
jedynie dodatkową wartość w ustaleniu różnych podtypów AML
według klasyfi kacji WHO.
Cechy kliniczne w odniesieniu do klasyfi kacji WHO. Klasyfi kacja WHO
uwzględnia cechy kliniczne w wyodrębnianiu szczególnych typów
AML. Na przykład identyfi kuje AML zależną od terapii jako odręb-
ną jednostkę i wyróżnia w jej obrębie specyfi czne typy w oparciu
o rodzaj uprzednio zastosowanej chemioterapii. Wyróżnia także
AML z wieloliniową dysplazją, biorąc pod uwagę wcześniejsze wy-
stępowanie bądź nie zespołu mielodysplastycznego. Uwzględnione
w klasyfi kacji WHO cechy kliniczne mają istotne znaczenie dla
ustalenia rokowania w specyfi cznych typach AML.
Zmiany genetyczne w odniesieniu do klasyfi kacji WHO. Klasyfi kacja WHO
jest pierwszym podziałem AML uwzględniającym zmiany genetycz-
ne, zarówno chromosomowe, jak i molekularne. W ten sposób AML
jest pierwszą jednostką sklasyfi kowaną w oparciu o obecność bądź
nie powtarzających się nieprawidłowości genetycznych. Na przykład
typ M3 AML według FAB jest teraz określany jako ostra białaczka
promielocytowa (acute promyelocytic leukemia – APL) w oparciu
o obecność albo cytogenetycznej rearanżacji t(15;17)(q22;q12),
albo produktu translokacji PML/RAR
α. W ten sposób klasyfi ka-
cja WHO odróżnia APL od innych typów AML jako pierwszy etap
działań diagnostycznych i daje istotną informację lekarzowi o moż-
liwości adekwatnego leczenia.
ANALIZA CHROMOSOMOWA. Analiza chromosomowa komórek białaczko-
wych dostarcza najważniejszych prognostycznych informacji u cho-
rych na AML. Dwa typy cytogenetycznych nieprawidłowości są jed-
noznacznie związane ze specyfi cznymi cechami morfologicznymi:
t(15;17)(q22;q12) z APL a inv(16)(p13q22) z AML z nieprawidłową
eozynofi lią w szpiku. Wiele innych zmian chromosomowych wiąże
się z określoną grupą cech morfologiczno-immunofenotypowych,
np. białaczka z t(8;21)(q22;q22) charakteryzuje się występowaniem
pałek Auera, ekspresją CD19 i licznymi prawidłowymi eozynofi lami,
natomiast białaczka z t(9;11)(p22;q23) oraz z innymi nieprawidło-
wościami 11q23 wiąże się z morfologią monocytoidalną. Różne typy
powtarzających się nieprawidłowości chromosomowych kojarzą się
też ze specyfi cznymi cechami klinicznymi. Z młodym wiekiem wiąże
się często t(8;21) i t(15;17), natomiast ze starszym wiekiem del(5q)

ROZDZIAŁ
1
04
Ostr
a i pr
zewlekła białaczka szpik
ow
a
739
i del(7q). Mięsak szpikowy (patrz poniżej) związany jest z t(8;21),
natomiast zespół rozsianego wewnątrznaczyniowego wykrzepiania
(disseminated intravascular coagulation – DIC) z t(15;17).
Klasyfi kacja molekularna. Badanie molekularne komórek białaczko-
wych z powtarzającymi się nieprawidłowościami cytogenetycz-
nymi pozwala na wykrycie zmian w ekspresji genów, które mogą
uczestniczyć w leukemogenezie. Informacje te również znalazły
miejsce w klasyfi kacji WHO. Na przykład t(15;17) koduje chime-
ryczne białko białaczki promielocytowej (Pml)/receptora α kwasu
retynoinowego (Rar
α), które jest produkowane w wyniku fuzji genu
dla receptora dla kwasu retynoinowego
α (RARα) znajdującego się
na chromosomie 17 i genu białaczki promielocytowej (PML) na
choromosomie 15. Gen RAR
α koduje receptor dla hormonu ją-
drowego należącego do rodziny czynników transkrypcyjnych. Po
związaniu kwasu retynoinowego, RAR
α pobudza ekspresję wielu
genów. Translokacja 15;17 zestawia geny PML i RAR
α w konfi gura-
cji „głowa do ogona”, która podlega transkrypcyjnej kontroli PML.
Trzy różne punkty złamań w genie PML dają w efekcie różne białka
fuzyjne. Białko Pml-Rar
α hamuje transkrypcję i blokuje różnico-
wanie komórkowe. Farmakologiczne dawki liganda Rar
α, kwasu
all-trans-retynoinowego (tretynoiny) przełamują blok i pobudzają
różnicowanie (patrz poniżej). Podobne przykłady dotyczą wielu in-
nych zbalansowanych translokacji i inwersji, w tym t(8;21), t(9;11),
t(6;9) i inv(16).
Aberracje molekularne dostarczają również użytecznych in-
formacji dla ustalenia ryzyka nawrotu u chorych bez zmian chro-
mosomowych. Częściowa duplikacja tandemowa (partial tandem
duplication – PTD) genu MLL wykrywana jest u 5-10% chorych
z prawidłowym kariotypem i związana jest z krótszym okresem re-
misji. Kinaza tyrozynowa 3 FMS-like (Flt3) jest kinazą tyrozynową
receptora ważnego dla rozwoju linii mieloidalnej i limfoidalnej. Ak-
tywne mutacje genu FLT3 występujące u około 30% dorosłych cho-
rych na AML to wewnątrztandemowe duplikacje (internal tandem
duplications – ITD) w domenie okołobłonowej lub mutacje w pętli
aktywującej kinazy. Zdarza się to znacznie częściej u chorych z pra-
widłowym kariotypem. Ciągła aktywacja Flt3 i kaskady docelowych
kinaz, włączając w to transduktora sygnałów, aktywatora białka
transkrypcyjnego 5, kinazę białkową aktywowaną przez Ras/mito-
gen i Akt/3 kinazę fosfatydyloinozytolową prowadzi do zwiększenia
siły sygnałów antyapoptycznych i nasilenia proliferacji mieloidal-
nych komórek progenitorowych. Obecność FLT3 ITD u chorych
z prawidłowym kariotypem związana jest z krótszym czasem remisji
i krótszym przeżyciem. Inne molekularne czynniki prognostyczne
u chorych na AML z prawidłowym kariotypem to mutacje genu dla
nukleofozminy (NPM1) i C/EBP
α, które związane są z dobrą wrażli-
wością na leczenie. W przeciwieństwie do tego, hiperekspresja genu
BAALC (brain and acute leukemia cytoplasmic) kojarzy się ze złym
przebiegiem. Profi l ekspresji genów pomagający w ustaleniu roko-
wania u chorych z prawidłowym kariotypem podlega obecnie wielu
badaniom klinicznym.
OBRAZ KLINICZNY
Objawy. Chorzy na AML najczęściej zgłaszają niespecyfi czne obja-
wy, które pojawiają się stopniowo lub nagle, i są konsekwencją nie-
dokrwistości, podwyższonej leukocytozy, leukopenii lub dysfunkcji
leukocytów oraz małopłytkowości. U prawie połowy pacjentów ob-
jawy chorobowe występują na mniej niż 3 miesiące przed rozpozna-
niem białaczki.
Połowa chorych jako pierwszy objaw zgłasza zmęczenie, ale więk-
szość narzeka na zmęczenie lub osłabienie w momencie ustalania
rozpoznania. Częste są brak apetytu i ubytek wagi. Gorączka towa-
rzysząca infekcji lub bez niej jest wstępnym objawem u około 10%
chorych. Podobnie cechy nieprawidłowej hemostazy (krwawienie,
łatwe siniaczenie) notowane są wstępnie w 5% wszystkich przypad-
ków. Czasami stwierdza się ból kości, limfadenopatię, niespecyfi cz-
ny kaszel, ból głowy i nadmierne pocenie się.
Rzadko pacjenci zgłaszają objawy związane z obecnością nacie-
ków, zlokalizowanych w tkankach miękkich, gruczołach sutkowych,
macicy, jajnikach, oponach czaszki lub kręgosłupa, przewodzie po-
karmowym, płucach, śródpiersiu, gruczole krokowym, kościach
lub innych narządach. Zmiany naciekowe mogą mieć postać guza
złożonego z komórek białaczkowych i nazywanego mięsakiem gra-
nulocytowym (granulocytic sarcoma) lub zieleniakiem (chloroma).
Typowa AML może pojawić się u tych pacjentów równocześnie,
później lub w ogóle nie wystąpić. Ten rzadki obraz kliniczny jest
częstszy u chorych z translokacją t(8;21).
Badanie przedmiotowe. Gorączka, splenomegalia, hepatomegalia, lim-
fadenopatia, tkliwość uciskowa w okolicy mostka oraz cechy infekcji
i tendencja do krwawień są często obecne w momencie ustalania
diagnozy. Znaczne krwawienie z przewodu pokarmowego, krwo-
tok wewnątrz płuc ny lub wewnątrzczaszkowy najczęściej występu-
ją w APL. Krwawienie związane z koagulopatią może mieć także
miejsce w ostrej białaczce monocytowej oraz w innych morfologicz-
nych typach ze skrajnymi wartościami leukocytozy lub małopłyt-
kowością. Wylewy krwotoczne do siatkówki wykrywane są u 15%
chorych. Nacieki z komórek białaczkowych w dziąsłach, skórze,
tkankach miękkich albo oponach są charakterystyczne dla podty-
pów monocytoidalnych oraz tych, w których występują nieprawi-
dłowości 11q23.
Badanie hematologiczne. Niedokrwistość zazwyczaj występuje w mo-
mencie rozpoznania i może być znacznie wyrażona. Jej nasilenie
może różnić się znacznie, niezależnie od innych hematologicznych
objawów, splenomegalii i czasu trwania choroby. Niedokrwistość
jest zwykle normochromiczna i normocytowa. Rezultatem osła-
bionej erytropoezy jest często spadek liczby retykulocytów, czasu
przeżycia erytrocytów, wskutek przyspieszenia ich rozpadu. Czynne
krwawienie również przyczynia się do rozwoju niedokrwistości.
Średnia leukocytoza wynosi około 15 000/
μl. 25-40% chorych
ma leukocytozę mniejszą niż 5000/
μl i 20% większą niż 100 000/μl.
U mniej niż 5% chorych nie wykrywa się komórek białaczkowych
we krwi. Morfologia komórek białaczkowych jest inna w różnych
podtypach. W AML cytoplazma zawiera często pierwotne (niespe-
cyfi czne) ziarnistości, jądro ma delikatną, rozproszoną chromatynę
z jednym lub większą liczbą jąderek, co jest charakterystyczne dla
TABELA 104-1
Klasyfi kacje ostrych białaczek szpikowych
Klasyfi kacja WHO (World Health Organization)a
I. Ostre białaczki szpikowe z powtarzającymi się zmianami genetycznymi
Ostra białaczka szpikowa z t(8;21)(q22;q22);RUNX1/RUNX1T1b
Ostra białaczka szpikowa z nieprawidłową eozynofi lią w szpiku
[inv(16)(p13;q22) lub t(16;16)(p13;q22);(CBFB/MYH11)]b
Ostra białaczka promielocytowa [t(15;17)(q22;q21)(PML/RARA) i wa-
rianty]b
Ostra białaczka szpikowa z nieprawidłowościami 11q23 (MLL)
II. Ostre białaczki szpikowe z wieloliniową dysplazją
Ostra białaczka szpikowa z poprzedzającym zespołem mielodyspla-
stycznym lub mielodysplastyczno-mieloproliferacyjnym
Ostra białaczka szpikowa bez poprzedzającego zespołu mielodyspla-
stycznego
III. Ostre białaczki szpikowe i zespoły mielodysplastyczne spowodowane
uprzednim leczeniem
Ostra białaczka szpikowa po leczeniu związkami alkilującymi
Ostra białaczka szpikowa po leczeniu inhibitorami topoizomerazy II
Inne typy
IV. Ostre białaczki szpikowe, gdzie indziej niesklasyfi kowane
Ostra białaczka szpikowa minimalnie zróżnicowana
Ostra białaczka szpikowa bez dojrzewania
Ostra białaczka szpikowa z dojrzewaniem
Ostra białaczka szpikowa mielomonocytowa
Ostra białaczka monoblastyczna i monocytowa
Ostra białaczka erytroblastyczna
Ostra białaczka megakarioblastyczna
Ostra białaczka bazofi lowa
Ostra panmieloza ze zwłóknieniem
Mięsak szpikowy
Klasyfi kacja francusko-amerykańsko-brytyjska (FAB)c
Występowanie
M0: Ostra białaczka szpikowa minimalnie zróżnicowana
5%
M1: Ostra białaczka szpikowa bez dojrzewania
20%
M2: Ostra białaczka szpikowa z dojrzewaniem
30%
M3: Hipergranularna ostra białaczka promielocytowa
10%
M4: Ostra białaczka szpikowa mielomonocytowa
20%
M4Eo Wariant: Ze zwiększonym odsetkiem nieprawidłowych
eozynofi li w szpiku
M5: Ostra białaczka monocytowa
10%
M6: Erytroleukemia (choroba DiGuglielmo)
4%
M7: Ostra białaczka megakarioblastyczna
1%
a Jaff e E.S. i wsp.: World Health Organization Classifi cation of Tumours, Lyon, IARC
Press, 2001.
b Rozpoznanie AML uzależnione od liczby blastów.
c Bennett J.M. i wsp. Ann Intern Med 103: 620, 1985.
CZĘŚĆ
6
O
nk
ologia i hema
tologia
740
niedojrzałych komórek. Nieprawidłowe ziarnistości, ukształtowane
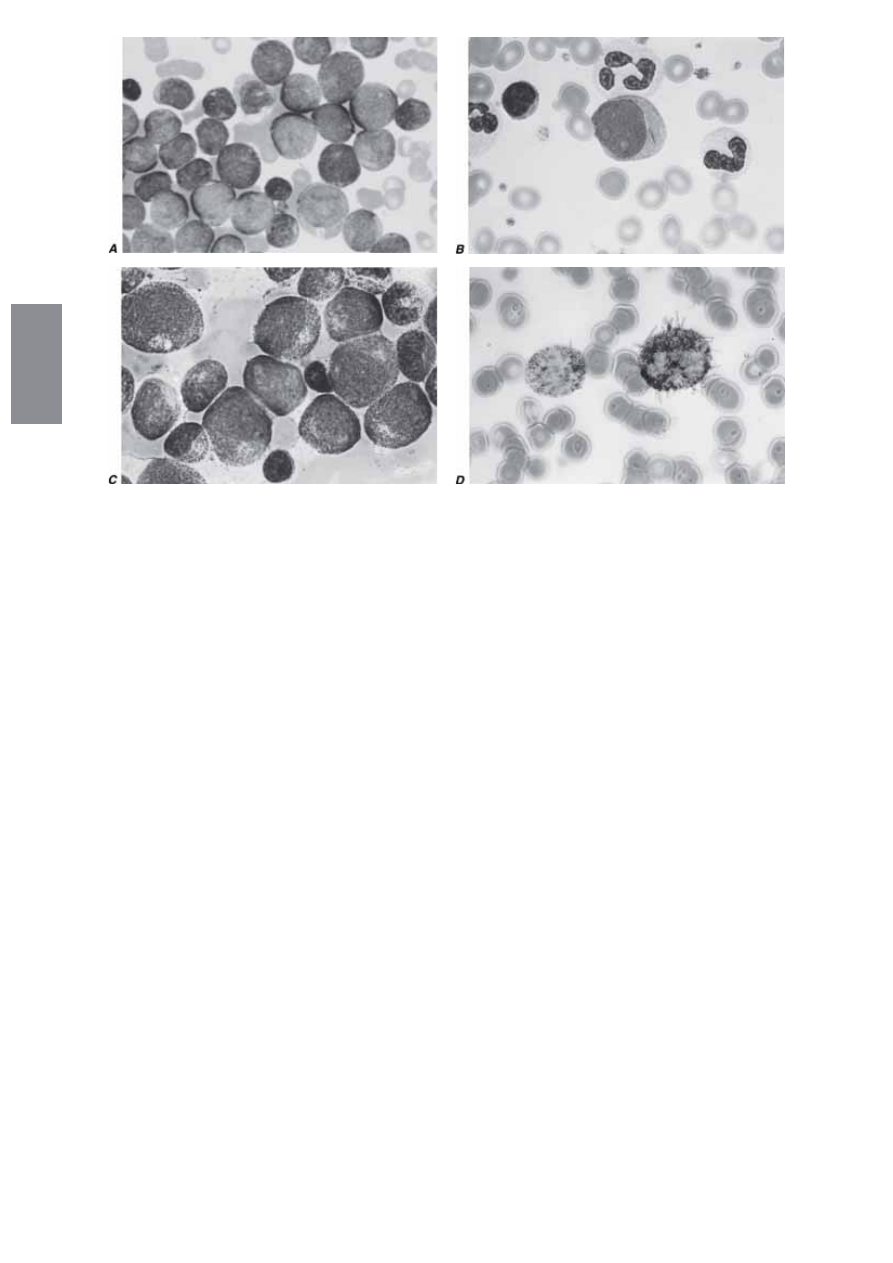
w postaci pałek, zwanych pałkami Auera, nie zawsze są wykrywane,
ale ich obecność jednoznacznie wskazuje na linię mieloidalną (ryc.
104-1). Można także stwierdzić nieprawidłową funkcję neutrofi li,
manifestującą się osłabieniem fagocytozy i migracji oraz zmiany ich
morfologii w postaci zaburzenia lobulacji i zmniejszenia granulacji.
Liczba płytek w momencie rozpoznania wynosi poniżej 100 000/
μl
u około 75% chorych i mniej niż 25 000/
μl u około 25% pacjentów.
Obserwuje się zarówno nieprawidłowości dotyczące morfologii, jak
i funkcji płytek. Najczęściej są to duże rozmiary i dziwaczne kształty
płytek z nieprawidłową granulacją oraz zaburzeniem zdolności do
agregacji i adhezji.
Ocena kliniczna chorych przed leczeniem. W momencie podejrzenia AML
powinna nastąpić szybka ocena kliniczna, a następnie wdrożenie
odpowiedniego leczenia (tab. 104-2). Poza określeniem podtypu
białaczki konieczne jest przeprowadzenie wstępnych badań w celu
ustalenia funkcjonalnej integralności głównych układów: serco-
wo-naczyniowego, oddechowego, wątroby i nerek. Czynniki, które
mają znaczenie prognostyczne, albo przez wpływ na uzyskanie cał-
kowitej remisji (CR), albo dla przewidywania czasu jej trwania, po-
winny być także określone przed rozpoczęciem leczenia. Wskazane
byłoby uzyskanie od chorych komórek białaczkowych i zamrożenie
ich w celu zbadania w przyszłości, kiedy będą dostępne nowe testy
diagnostyczne i możliwości terapeutyczne. Wszyscy pacjenci po-
winni być zbadani pod kątem jawnej lub ukrytej infekcji.
Większość chorych ma w momencie rozpoznania niedokrwistość
i małopłytkowość. Natychmiast po uzyskaniu wstępnych wyników
badań powinna mieć miejsce, jeśli jest to konieczne, substytucja od-
powiednich komponentów krwi. Ponieważ jakościowa dysfunkcja
płytek lub obecność infekcji mogą zwiększyć prawdopodobieństwo
krwawienia, istnieje uzasadnienie dla jak najszybszego przetoczenia
masy płytkowej, nawet jeśli liczba płytek jest umiarkowanie obni-
żona.
Około 50% pacjentów w momencie rozpoznania wykazuje ła-
godne lub umiarkowane podwyższenie poziomu kwasu moczowe-
go. Jedynie 10% chorych ma znaczący wzrost stężenia i poważna
komplikacja w postaci wytrącania kwasu moczowego w nerkach
i nefropatii nie jest częsta. Rozpoczęcie leczenia może nasilać hiper-
urikemię, dlatego pacjenci powinni jak najszybciej być nawadniani
i rozpoczynać przyjmowanie allopurynolu. W leczeniu nefropatii
związanej z nadmiarem kwasu moczowego może być użyteczna ras-
burykaza (rekombinowana oksydaza moczowa), która jedną dawką
normalizuje poziom kwasu moczowego w surowicy krwi w ciągu
kilku godzin. Ponadto duże stężenie lizozymu, markera różnicowa-
nia monocytoidalnego, może być przyczyną dysfunkcji kanalików
nerkowych, co nasila inne problemy nerkowe, które zwykle pojawia-
ją się we wstępnej fazie leczenia.
CZYNNIKI PROGNOSTYCZNE
Wiele czynników wpływa na prawdopodobieństwo uzyskania CR
oraz czas jej trwania, jak również wyleczalność z AML. W celu roz-
poznania CR konieczne jest zbadanie zarówno krwi, jak i szpiku.
Liczba neutrofi li we krwi powinna wynosić co najmniej 1000/
μl,
a liczba płytek co najmniej 100 000/μl. Stężenie hemoglobiny nie
jest brane pod uwagę przy ustalaniu CR. Krążące komórki blastycz-
ne nie powinny być wykrywane. Dopuszcza się obecność pojedyn-
czych blastów we krwi podczas regeneracji szpiku, nie powinny one
się pojawiać w dalszych badaniach. Komórkowość szpiku powinna
wynosić ponad 20% i charakteryzować się trójliniowym dojrzewa-
niem. Szpik powinien zawierać mniej niż 5% blastów, nie powin-
ny być wykrywane pałki Auera. Nie stwierdza się oznak białaczki
pozaszpikowej. Do oceny choroby resztkowej u pacjentów z CR
znalazły ostatnio zastosowanie: reakcja łańcuchowej polimerazy
z odwrotną transkryptazą (reverse transcriptase polymerase chain
reaction – RT-PCR), która wykrywa zmiany molekularne, oraz fl u-
orescencyjna hybrydyzacja in situ (fl uorescence in situ hybridization
– FISH) w wersji metafazalnej lub interfazalnej, dzięki której można
wykryć aberracje chromosomowe. Tego typu ocena choroby reszt-
kowej może stać się wiarygodną podstawą różnicowania między
pacjentami z CR, którzy wymagają bądź też nie dodatkowej i/lub
alternatywnej terapii.
Wiek w momencie rozpoznania należy do najważniejszych czyn-
ników prognostycznych. Zaawansowany wiek związany jest z gorszą
prognozą, głównie ze względu na wpływ na przeżycie przez chorych
terapii indukcyjnej. Wiek może także wpływać na wynik leczenia
z tego powodu, że AML u ludzi starszych charakteryzuje się od-
mienną biologią. Komórki białaczkowe u ludzi starszych częściej
wykazują ekspresję CD34 i zależnej od MDR1 (multidrug resistan-
ce 1) pompy powodującej wypływ cytostatyków oraz oporność na
leki pochodzenia naturalnego, takie jak antracykliny (patrz poni-
żej). Z każdą kolejną dekadą życia wzrasta odsetek chorych wykazu-
RYCINA 104-1.* Morfologia komórek ostrej białaczki szpikowej. A. Jednorodna populacja prymitywnych mieloblastów z niedojrzałą chromatyną, ją-
derkami w niektórych komórkach i pierwotnymi ziarnistościami w cytoplazmie. B. Mieloblast białaczkowy zawierający pałkę Auera. C. Komórki białaczki
promielocytowej z wyraźnymi pierwotnymi ziarnistościami cytoplazmatycznymi. D. Barwienie na peroksydazę wykazuje ciemnoniebieski kolor charak-
terystyczny dla peroksydazy w ziarnistościach w AML.
ROZDZIAŁ
1
04
Ostr
a i pr
zewlekła białaczka szpik
ow
a
741
jących oporność na leczenie. Przewlekłe i współistniejące choroby
osłabiają tolerancję intensywnego leczenia cytostatycznego; ostre
problemy medyczne w momencie rozpoznania negatywnie wpły-
wają na prawdopodobieństwo przeżycia. Stan ogólny niezależnie od
wieku także wpływa na zdolność przeżycia terapii indukcyjnej i na
efekt leczenia.
Zaburzenia chromosomowe w momencie rozpoznania są następ-
nym ważnym, niezależnym czynnikiem prognostycznym. Pacjen-
ci z t(15;17) mają bardzo dobrą prognozę (około 85% wyleczeń),
z t(8;21) i inv(16) – dobrą (około 50% wyleczeń), natomiast u cho-
rych z prawidłowym kariotypem odnotowuje się umiarkowanie ko-
rzystny przebieg (około 40% wyleczeń). Pacjenci ze złożonymi zmia-
nami w kariotypie, t(6;9), inv(3) oraz zmianami dotyczącymi chro-
mosomu 7 mają bardzo złe rokowanie. Determinuje to znaczenie
cytogenetycznych i molekularnych badań komórek białaczkowych
w momencie rozpoznania oraz wartość zabezpieczenia próbek szpi-
ku w celu ich późniejszego ewentualnego zbadania.
Zbyt długi symptomatyczny okres z cytopenią poprzedzający
właściwą diagnozę lub choroba hematologiczna w wywiadzie rów-
nież istotnie wpływają na mniejszą szansę na CR i dłuższe przeży-
cie. Szansa na uzyskanie CR jest mniejsza u tych pacjentów, którzy
mieli niedokrwistość, leukopenię i/lub małopłytkowość przez okres
dłuższy niż 3 miesiące przed rozpoznaniem, w porównaniu z tymi,
u których nie odnotowano podobnych zaburzeń. Odpowiedź na
chemioterapię wydaje się systematycznie zmniejszać, kiedy czas
trwania poprzedzających białaczkę zaburzeń hematologicznych
wydłuża się. Ponadto wtórna AML, rozwijająca się w następstwie
leczenia cytostatykami z powodu innych chorób nowotworowych,
zwiększa istotnie problemy terapeutyczne.
Duża liczba krwinek białych jest niezależnym czynnikiem pro-
gnostycznym dla uzyskania remisji. Wśród chorych z hiperleuko-
cytozą (> 100 000/
μl) wczesne krwawienie do ośrodkowego układu
nerwowego oraz leukostaza płucna przyczyniają się do niekorzyst-
nego przebiegu.
Poza czynnikami prognostycznymi określanymi przed leczeniem,
takimi jak wiek, zmiany cytogenetyczne oraz liczba krwinek bia-
łych, także wiele innych czynników koreluje z rokowaniem w AML,
a wśród nich przede wszystkim osiągnięcie CR. Pacjenci, u których
uzyskuje się CR w następstwie jednego tylko cyklu indukcyjnego,
mają dłuższą CR niż ci, którzy wymagają do tego kilku kuracji.
LECZENIE OSTREJ BIAŁACZKI SZPIKOWEJ
Leczenie nowo zdiagnozowanych chorych na AML jest zwykle podzie-
lone na 2 fazy: indukcję i podtrzymywanie remisji (ryc. 104-2). Wstępnym
celem terapii jest szybka indukcja CR. Jak tylko osiągnie się CR, należy w celu
utrwalenia efektu leczniczego i przedłużenia przeżycia wdrożyć następne
strategie terapeutyczne. Rodzaj kuracji indukującej remisję i następnie tera-
pia poremisyjna w dużym stopniu zależne są od wieku chorego. Intensyfi -
kacja leczenia opartego o tradycyjne leki cytostatyczne, takie jak cytarabi-
na i antracykliny, wydaje się pozytywnie wpływać na wyleczalność z AML
u chorych < 60. roku życia. U starszych pacjentów korzyść z intensyfi kacji
leczenia cytostatycznego nie jest jednoznaczna; potrzebne są nowe formy
terapii.
CHEMIOTERAPIA INDUKCYJNA.
Najpowszechniej stosowany
schemat indukcyjny (dla pacjentów z wszystkimi typami FAB, z wyjątkiem
APL) składa się z cytarabiny i antracykliny. Cytarabina jest antymetabolitem
specyfi cznie działającym na komórkę w fazie S cyklu mitotycznego, który
po fosforylacji przechodzi w aktywną postać trójfosforanu i zaburza syn-
tezę DNA. Antracykliny uszkadzają nici DNA. Uważa się, że najważniejszym
sposobem ich działania jest interakcja z topoizomerazą II, prowadząca do
rozerwania DNA. Cytarabina jest zwykle stosowana w ciągłej infuzji dożyl-
nej przez 7 dni. Leczenie antracyklinami polega zazwyczaj na stosowaniu
daunorubicyny dożylnie w dniach 1., 2. i 3. (schemat: 7 + 3). Terapia idarubi-
cyną przez 3 dni, łącznie z cytarabiną, podawaną w 7-dniowej ciągłej infuzji,
jest co najmniej tak samo efektywna, a może być nawet lepsza niż leczenie
daunorubicyną u młodszych chorych. Dołączenie do schematu etopozydu
może wydłużyć czas trwania CR.
Po zakończeniu chemioterapii indukcyjnej przeprowadza się badanie
szpiku w celu ustalenia, czy komórki białaczkowe zostały wyeliminowane.
Jeśli blasty stanowią ≥ 5%, przy komórkowości ≥ 20%, zwykle powtarza się
schemat z cytarabiną i antracykliną w dawkach jak w kuracji indukcyjnej, ale
odpowiednio przez 5 i 2 dni. Nasza rekomendacja w takiej sytuacji to jednak
zmiana kuracji. Chorzy, u których po 2 kursach indukcyjnych nie uda się uzy-
skać CR, powinni być natychmiast kierowani do alogenicznej transplantacji
komórek macierzystych (stem cell transplant – SCT), jeśli jest odpowiedni
dawca. Taka opcja dotyczy tylko chorych w wieku poniżej 70 lat z wydolny-
mi organami wewnętrznymi.
Przy zastosowaniu schematu 7 + 3 z cytarabiną i daunorubicyną, opisa-
nego powyżej, całkowitą remisję uzyskuje 65-75% dorosłych z AML de novo
poniżej 60. roku życia Dwie trzecie chorych uzyskuje CR po jednym cyklu
chemioterapii, natomiast jedna trzecia wymaga dwóch kursów. U około
50% chorych przyczyną braku CR jest pierwotna oporność na chemiote-
rapię, natomiast u pozostałych 50% pacjentów dochodzi do ciężkich po-
wikłań, związanych z aplazją szpiku i utrudnioną odnową prawidłowych
komórek macierzystych. Większa śmiertelność oraz oporność po leczeniu
indukcyjnym obserwowane są u chorych starszych oraz u tych, u których
wystąpienie AML jest następstwem MDS, zespołu mieloproliferacyjnego
lub chemioterapii z powodu innej choroby nowotworowej.
Schematy bazujące na dużych dawkach cytarabiny pozwalają na uzy-
skiwanie dużego odsetka CR już po jednym cyklu terapii. Przy podawaniu
dużych dawek więcej cytarabiny może wejść do wnętrza komórek, wy-
sycić inaktywujące ją enzymy i zwiększyć wewnątrzkomórkowy poziom
1-
β-D-trójfosforanu arabinofuranylcytozyny, aktywnego metabolitu wbu-
TABELA 104-2
Wstępna diagnostyka i działania medyczne u dorosłych
chorych na ostrą białaczkę szpikową
Wywiad
Narastające uczucie zmęczenia i zmniejszona tolerancja wysiłku
Wydłużone krwawienie lub krwawienie z nietypowych miejsc (DIC, ma-
łopłytkowość)
Gorączka lub nawracające infekcje (granulocytopenia)
Ból głowy, zaburzenia widzenia, nieogniskowe zmiany neurologiczne
(białaczka OUN lub krwawienie)
Brak apetytu (splenomegalia)
AML w wywiadzie rodzinnym (zespoły: Fanconiego, Blooma, Kostman-
na, ataksja-teleangiektazja)
Choroba nowotworowa w wywiadzie (ekspozycja na leki alkilujące, pro-
mieniowanie jonizujące, inhibitory topoizomerazy II)
Narażenie zawodowe (promieniowanie jonizujące, benzen, produkty
ropy naftowej, farby, nikotyna, pestycydy)
Badanie przedmiotowe
Stan ogólny (czynnik prognostyczny)
Wybroczyny i sączenie krwi z cewników naczyniowych (DIC, prawdopo-
dobieństwo ostrej białaczki promielocytowej)
Gorączka i tachykardia (cechy infekcji)
Obrzęk brodawki, nacieki siatkówki, uszkodzenie nerwów czaszkowych
(białaczka OUN)
Słabe uzębienie, ropnie okołozębowe
Przerost dziąseł (nacieki białaczkowe, najczęściej w białaczce monocy-
towej)
Nacieki skórne lub guzki (nacieki białaczkowe, najczęściej w białaczce
monocytowej)
Limfadenopatia, splenomegalia, hepatomegalia
Ból pleców, osłabienie kończyn dolnych [mięsak granulocytowy kręgo-
słupa, najbardziej prawdopodobna t(8;21)]
Badania laboratoryjne i radiologiczne
Morfologia krwi z rozmazem ręcznym
Badania chemiczne krwi (elektrolity, kreatynina, BUN, wapń, fosfor, kwas
moczowy, enzymy wątrobowe, bilirubina, LDH, amylaza, lipaza)
Badanie układu krzepnięcia (czas protrombinowy, czas częściowej trom-
boplastyny, fi brynogen, D-dimery)
Badania serologiczne wirusologiczne (CMV, HSV-1, varicella zoster)
Antygeny krwinek czerwonych
Antygeny HLA chorego, rodzeństwa i rodziców dla wytypowania dawcy
do ewentualnego alogenicznego SCT
Biopsja szpiku i badanie aspiratu (morfologia, cytogenetyka, cystometria
przepływowa, badania molekularne)
Zamrożenie komórek białaczkowych
Elektrokardiogram
Zdjęcie klatki piersiowej przednio-tylne i boczne
Ocena umiejscowienia cewnika w żyle centralnej
Działania medyczne w szczególnych przypadkach
Uporządkowanie uzębienia (u chorych ze zmianami uzębienia)
Punkcja lędźwiowa (u osób z objawami zajęcia OUN)
MRI kręgosłupa (u pacjentów z bólem pleców, osłabieniem kończyn
dolnych, parastezjami)
Pomoc socjalna i psychologiczna
Poradnictwo dla wszystkich chorych
Poinformowanie pacjenta o chorobie, możliwości wsparcia fi nansowe-
go, skontaktowanie z grupami wsparcia
Objaśnienia: BUN (blood urea nitrogen) – azot mocznikowy we krwi; CMV – cyto-
megalowirus; DIC (disseminated intravascular coagulation) – rozsiane wykrzepianie
wewnątrznaczyniowe; HLA (human leukocyte antigen) – antygeny ludzkich leukocy-
tów, antygeny zgodności tkankowej; ; HSV – wirus herpes simplex; LDH – dehydro-
genaza kwasu mlekowego; MRI – rezonans magnetyczny; OUN – ośrodkowy układ
nerwowy; SCT (stem cell transplantation) – transplantacja komórek macierzystych.

CZĘŚĆ
6
O
nk
ologia i hema
tologia
742
dowywanego do DNA. Dlatego właśnie duże dawki cytarabiny mogą
zwiększyć hamowanie syntezy DNA i tym samym przełamać oporność na
jej standardowe dawki. W dwóch randomizowanych badaniach wykazano,
że duże dawki cytarabiny w połączeniu z antracykliną dawały podobny od-
setek remisji do osiąganego przy zastosowaniu standardowego schematu
7 + 3. Jednak czas trwania CR był dłuższy przy podawaniu dużych dawek
cytarabiny w porównaniu z dawkami standardowymi.
Toksyczne objawy hematologiczne w następstwie kuracji bazujących na
dużych dawkach cytarabiny są zwykle bardziej nasilone niż przy zastosowa-
niu schematu 7 + 3. Toksyczność związana z podawaniem dużych dawek
cytarabiny manifestuje się mielosupresją, uszkodzeniem płuc i istotnym,
czasem nieodwracalnym uszkodzeniem móżdżku. Wszyscy chorzy le-
czeni dużymi dawkami cytarabiny powinni być monitorowani pod kątem
toksyczności móżdżkowej. W związku z tym należy przeprowadzać pełne
badanie funkcji móżdżku przed każdą kolejną dawką i dalsze stosowanie du-
żych dawek cytarabiny powinno być natychmiast przerwane przy jakichkol-
wiek objawach toksycznego uszkodzenia móżdżku. Tego typu toksyczność
znacznie częściej ma miejsce u chorych z niewydolnością nerek i w wieku
powyżej 60 lat. W związku z tym stosowanie dużych dawek cytarabiny jest
ograniczone u ludzi starszych.
LECZENIE WSPOMAGAJĄCE.
Środki zastosowane w leczeniu wspo-
magającym chorych na AML, wykazujących przez wiele tygodni granulocy-
topenię i małopłytkowość, są decydujące dla powodzenia terapii. Chorzy na
ostrą białaczkę powinni być leczeni w specjalistycznych ośrodkach hemato-
logicznych, mających doświadczenie w leczeniu wspomagającym.
Do klinicznych programów badawczych dotyczących AML dołączono
rekombinowane hematopoetyczne czynniki wzrostu. W założeniach tych
programów jest badanie wpływu na ograniczenie infekcji po chemioterapii.
Zarówno G-CSF, jak i czynnik stymulujący kolonie granulocytowo-makrofa-
gowe (granulocyte-macrophage colony-stimulating factor – GM-CSF) skracają
średni czas odnowy liczby neutrofi li średnio o 5-7 dni. To przyspieszenie od-
nowy neutrofi li nie ma jednak znaczącego wpływu na ograniczenie rozwo-
ju infekcji i skrócenie czasu hospitalizacji. W większości randomizowanych
badań z użyciem zarówno G-CSF, jak i GM-CSF nie wykazano ich znaczenia
dla zwiększenia częstości CR, przeżycia wolnego od choroby i całkowitego
przeżycia. Mimo że receptory dla G-CSF i GM-CSF są obecne na blastach
AML, czynniki wzrostu nie mają wpływu na skuteczność terapii. Zastoso-
wanie czynników wzrostu w leczeniu wspomagającym jest kontrowersyjne.
Poleca się ich wykorzystanie u pacjentów starszych, leczonych skompli-
kowanymi schematami, otrzymujących intensywne leczenie poremisyjne,
u których wystąpiły poważne infekcje, oraz uczestniczących w badaniach
klinicznych.
Wieloprzewodowe cewniki prawoprzedsionkowe należy zakładać na-
tychmiast po uzyskaniu stabilnego stanu u pacjentów ze świeżo rozpozna-
ną AML. Powinny być one instalowane dla wygodnego podawania drogą
dożylną leków, stosowania transfuzji, jak również pobierania próbek krwi do
badań. Przy zwiększonym ryzyku rozwoju infekcji należy rozważyć zastoso-
wanie cewników impregnowanych antybiotykami.
Odpowiednia i szybka transfuzja preparatów krwiopochodnych ma de-
cydujące znaczenie w leczeniu chorych na AML. Transfuzje płytek trzeba
stosować tak często, aby utrzymać ich liczbę we krwi powyżej 10 000-20
000/
μl. Uważa się, że liczba płytek powinna być utrzymana na wyższym
poziomie u chorych gorączkujących i podczas epizodów aktywnego
krwawienia lub DIC. Chorzy ze słabym potransfuzyjnym przyrostem licz-
by płytek mogą odnieść korzyść z przetoczenia płytek pochodzących od
dawców zgodnych w układzie HLA. Transfuzja erytrocytów powinna być
prowadzona w celu utrzymania stężenia hemoglobiny powyżej 80 g/l (8 g/
dl), przy braku aktywnego krwawienia, DIC lub zastoinowej niewydolności
krążenia. Należy także stosować produkty krwiopochodne pozbawione
leukocytów przez fi ltrowanie w celu uniknięcia lub opóźnienia aloimmuni-
zacji, jak również reakcji gorączkowych. Produkty krwi powinny być także
napromieniane w celu profi laktyki reakcji przeszczep przeciwko gospoda-
rzowi (graft-versus-host disease – GVHD). U pacjentów seronegatywnych pod
względem zakażenia cytomegalowirusem (CMV), którzy są potencjalnymi
kandydatami do alogenicznego przeszczepienia szpiku, należy stosować
produkty krwi CMV-negatywne. Jeśli są one niedostępne, można tym cho-
rym podawać preparaty pozbawione leukocytów.
Powikłania infekcyjne pozostają główną przyczyną chorobowości i śmier-
telności w czasie indukcji i leczenia poremisyjnego u chorych na AML. Pro-
fi laktyczne podawanie przeciwbakteryjnych antybiotyków przy braku go-
rączki jest kontrowersyjne. Zaleca się stosowanie doustnej nystatyny lub
klotrimazolu w celu przeciwdziałania rozwojowi zlokalizowanej kandydiazy.
U chorych, którzy są zainfekowani wirusem opryszczki, w przeciwdziałaniu
reaktywacji latentnej infekcji skuteczne jest podawanie acyklowiru.
Gorączka pojawia się u zdecydowanej większości chorych na AML, ale
udokumentowana infekcja ma miejsce tylko u połowy z nich. Wczesne
rozpoczęcie podawania empirycznego antybiotyków przeciwbakteryj-
nych i przeciwgrzybiczych o szerokim spektrum znacząco redukuje liczbę
chorych umierających z powodu powikłań infekcyjnych (patrz rozdz. 82).
Konieczne jest natychmiastowe zastosowanie antybiotyków działających
na bakterie Gram-ujemne, jak tylko wystąpi gorączka neutropeniczna, ale
należy również dokonać pełnej oceny klinicznej z dokładnym badaniem
przemiotowym, obejrzeniem miejsca wejścia cewnika, zbadaniem okolicy
okołoodbytniczej, wykonaniem odpowiednich badań radiologicznych oraz
posiewów w celu ustalenia przyczyny gorączki. Specyfi czne schematy anty-
biotykowe powinny opierać się na ocenie antybiotykowrażliwości dokona-
nej w ośrodku, w którym chory poddany jest leczeniu. Zalecany w pierwszej
linii schemat antybiotykowy składa się z imipenemu w połączeniu z cilasta-
tyną, półsyntetycznej penicyliny o działaniu przeciwpseudomonasowym
(np. piperacyliny) w połączeniu z aminoglikozydem, trzeciorzędowej cefa-
losporyny o antypseudomonasowej aktywności (np. ceftazydym lub ce-
fepim) lub podwójnej kombinacji
β-laktamów (ceftazydym i piperacylina).
Aminoglikozydy powinny być ograniczane, jeśli to możliwe, u chorych z nie-
wydolnością nerek. U pacjentów z udowodnioną nadwrażliwością o cha-
rakterze natychmiastowej reakcji na penicylinę zamiast
β-laktamów można
zastosować aztreonam. Lek ten należy raczej łączyć z aminoglikozydami lub
chinolonami niż stosować pojedynczo.
Empiryczne leczenie wankomycyną obecnie nie jest zalecane przy muco-
sitis, a także jeśli nie ma uzasadnionego podejrzenia infekcji Gram-dodatniej,
natomiast antybiotyk ten należy zastosować, jeśli gorączka neutropeniczna
utrzymuje się 3 dni. Jeśli gorączka przedłuża się do 7 dni, powinno się roz-
począć systemowe leczenie przeciwgrzybiczne. Worykonazol jest równie
skuteczny jak amfoterycyna B, a przy tym mniej toksyczny. W przypadku
braku wrażliwości lub nietolerancji pierwszoliniowego leczenia przeciw-
grzybicznego należy rozważyć zastosowanie kaspofunginy lub lizosomal-
nej amfoterycyny B. Leczenie przeciwbakteryjnymi i przeciwgrzybiczymi
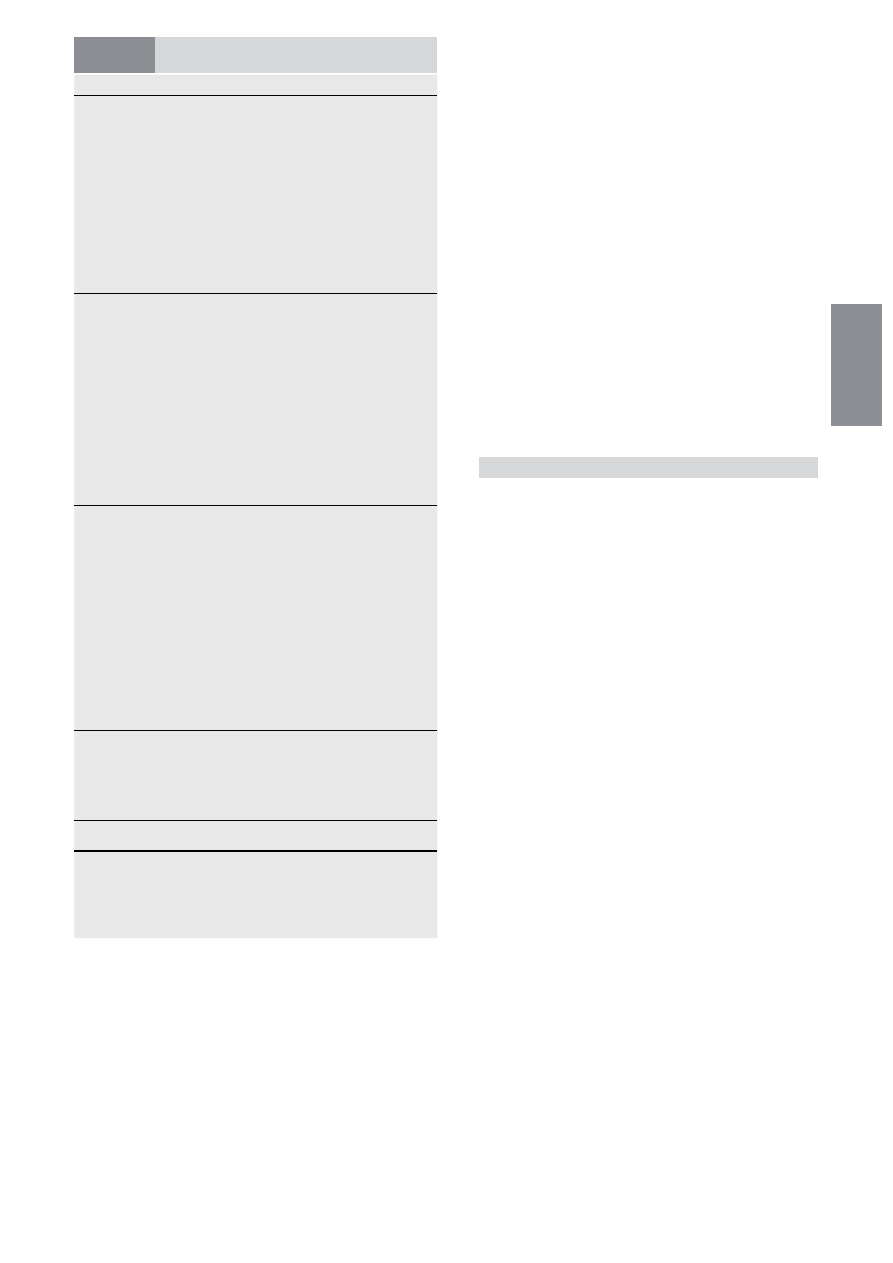
RYCINA 104-2. Schemat terapii u świeżo zdiagnozowanych chorych na ostrą białaczkę szpikową. Dla wszystkich typów AML, z wyjątkiem ostrej bia-
łaczki promielocytowej (APL) standardowa kuracja indukująca remisję składa się z cytarabiny, podawanej w 7-dniowej ciągłej infuzji (100-200 mg/m
2
/
dobę) i daunorubicyny podawanej przez 3 dni (45-60 mg/m
2
/dobę) lub idarubicyny (12-13 mg/m
2
/dobę) z/lub bez etopozydu, ewentualnie podawa-
nego przez 3 dni. Chorzy, którzy uzyskują całkowitą remisję, otrzymują leczenie konsolidujące, polegające na sekwencyjnym podawaniu dużych dawek
cytarabiny, autologicznej transplantacji komórek krwiotwórczych (SCT), połączeniu wysokodozowanej chemioterapii z transplantacją alogeniczną lub
stosowaniu nowych form terapii, w zależności od ryzyka nawrotu (risk-stratifi ed therapy). Pacjenci z APL w indukcji otrzymują zwykle tretynoinę w po-
łączeniu z antracykliną, w konsolidacji chemioterapię (daunorubicyna) i w podtrzymywaniu remisji tretynoinę z/lub bez chemioterapii. Znaczenie cyta-
rabiny w indukcji i konsolidacji w APL nie jest jednoznaczne.
ALGORYTM LECZENIA AML
Leczenie indukcyjne
Daunorubicyna + Cytarabina ± Etopozyd
Całkowita remisja
Brak całkowitej remisji
t(8;21) lub inv(16)
Prawidłowy kariotyp
z małym ryzykiem
Prawidłowy kariotyp
z dużym ryzykiem, inny
(obie opcje dopuszczalne)
Kariotyp dużego ryzyka
Pacjent mający
dawcę do alloSCT
3-4 cykle
wysokodozo-
wanej
cytarabiny
3-4 cykle wysoko-
dozowanej cytara-
bint lub autoSCT
alloSCT
Terapia
eksperymentalna
Tak: alloSCT
Nie: terapia
eksperymentalna
Tak: alloSCT
Nie: terapia
eksperymentalna
Wyszukiwarka
Podobne podstrony:
Ostra Bialaczka Szpikowa Proces Pielegnowania id 341705
Farmakoterapia przewlekłej białaczki szpikowej new
Hematologia i onkologia dziecięca, ostra białaczka nielimfoblastyczna, Wzór
Przewlekła białaczka szpikowa jest chorobą nowotworową szpiku kostnego i krwi
Przewlekła białaczka szpikowa(1), Pierwsza Pomoc Przedmedyczna, Medycyna, Onkologia
Hematologia, ostra białaczka nielimfoblastyczna, Wzór
2 Patomechanizm objawów klinicznych w ostrej białaczce szpikowejid 19599 ppt
Przewlekła białaczka szpikowa
Ostrsa białaczka szpikowa
Hematologia, ostra bialaczka limfoblastyczna, ostra białaczka limfoblastyczna
Współczesne zasady leczenia przewlekłej białaczki szpikowej
proces pielęgnowania dziecka z ostrą białaczką limfoblastyczną
Bialaczki szpikowe ostre
ostra białaczka nielimfoblastyczna1
Bialaczka szpikowa przewlekla
więcej podobnych podstron