
Współczesne zasady leczenia
przewlekłej białaczki
szpikowej
Ref: Module 2,Treatment of CML & Ph+ALL, P55

FAZA PRZEWLEKŁA

Cel leczenia
przewlekłej białaczki
szpikowej
Zmniejszenie ilości
komórek
nowotworowych aż do
ich całkowitej
eliminacji

Cele pośrednie leczenia
PBS
Cytoredukcja
Remisja cytogenetyczna
Remisja molekularna
Wyleczenie
10
10
10
10
10
10
10
10
10
10
10
10
0
13
12
11
10
9
8
7
6
5
4
3
2
C
a
łk
o
w
ita
il
o
ść
k
o
m
ó
re
k
b
ia
ła
cz
k
o
w
yc
h
100
10
1
0.1
0. 01
0. 001
0. 0001
0
Remisja
hematologiczna
Remisja
cytogenetyczna
Remisja
molekularna
Wysokie WBC
Ph’ dodatni
Ilościowy PCR
dodatni
Jakościowy PCR
dodatni
BCR-ABL
niewykrywalny
S
to
su
n
e
k
B
C
R
-A
B
L
/
A
B
L
(
%
)
Diagnoza
WYLECZENIE ?

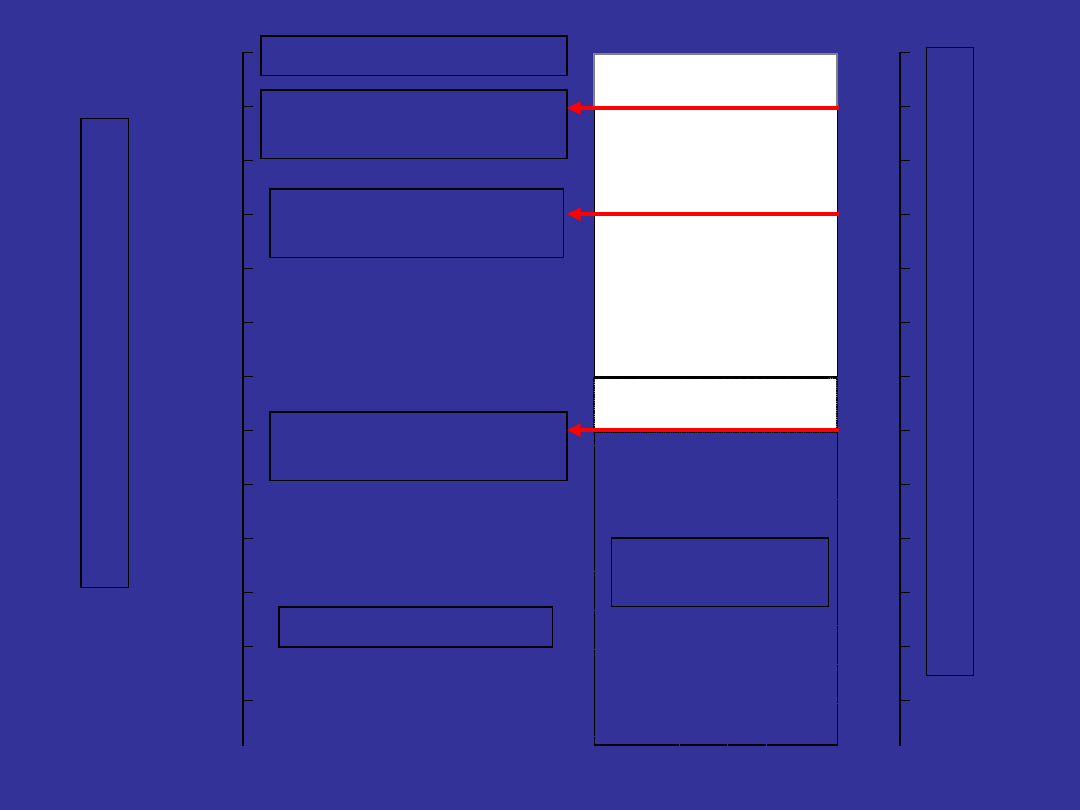
Responses in CML
BLOO
D
MARRO
W
Neutrophil
s
Progenitor
s (CFU..)
Stem
cells
Blood count
Marrow
cytogenetics
(chromosomes
)
PCR (molecular
testing)
www.cmlsupport.org.uk/ Templates/CMLSeminar.aspx?action=RCaccessed June 06
Effect of Hydroxyurea &
Busulphan
BLOO
D
MARRO
W
Neutrophil
s
Progenitor
s (CFU..)
Stem
cells
www.cmlsupport.org.uk/ Templates/CMLSeminar.aspx?action=RCaccessed Aug 06

Effect of Interferon
BLOOD
MARROW
Progenitor
s (CFU..)
Stem
cells
Progenitors
(CFU.)
Progenitors (CFU..)
Stem
cells
Stem
cells
Partial
cytogenetic
response
Complete
cytogenetic response
(5% of patients)
Minor cytogenetic
response
www.cmlsupport.org.uk/ Templates/CMLSeminar.aspx?action=RCaccessed June 06

Effect of imatinib (12
months+)
BLOOD
MARROW
Progenitors (CFU..)
Stem
cells
Stem
cells
Molecular
responses
Complete
cytogenetic
response
Stem
cells
Druker BJ, O’Brien SG, Cortes J, Radich J. Chronic Myelogenous Leukaemia. Haematology. 2002; American Society of Haematology.

Wyleczenie
Definicja: Brak nawrotu objawów
choroby u większości chorych
poddanych określonemu leczeniu w
ciągu 5 lat od zakończenia leczenia
.
Dla wyleczenia PBS być może całkowita
eliminacja komórek Ph(+) nie jest
niezbędna, ale wydaje się, że jest
pożądana

•
prowadzi do osiągnięcia remisji hematologicznej
= wyniki krwi obwodowej w granicach normy
ale wszystkie komórki są Ph(+)
•
nie wpływa na przebieg naturalny choroby, nie
wydłuża więc istotnie przeżycia chorych
•
Rekomendowanym lekiem w leczeniu
cytoredukcyjnym jest obecnie hydroksymocznik
(wcześniej stosowano busulfan)
•
W przypadku konieczności szybkiego
zmniejszenia bardzo wysokiej leukocytozy
należy wykonać leukaferezę
Cytoredukcja
Cytoredukcja

•
Typowa dawka: początkowo 2g/m
2
a
następnie 1-2 g/dobę
•
Inhibitor syntezy DNA (hamuje reduktazę
rybonukleotydów), działa na późne
prekursory hematopoezy
•
Nie wywołuje nieodwracalnej hipoplazji
szpiku - jest bezpieczniejszy niż wcześniej
stosowany busulfan, wydłuża 5 letnie
przeżycie chorych z 32 do 44 miesięcy
(p=0,008)
Hydroksymocznik
Hydroksymocznik

Dalsza eliminacja komórek
Ph+ po osiągnięciu
cytoredukcji
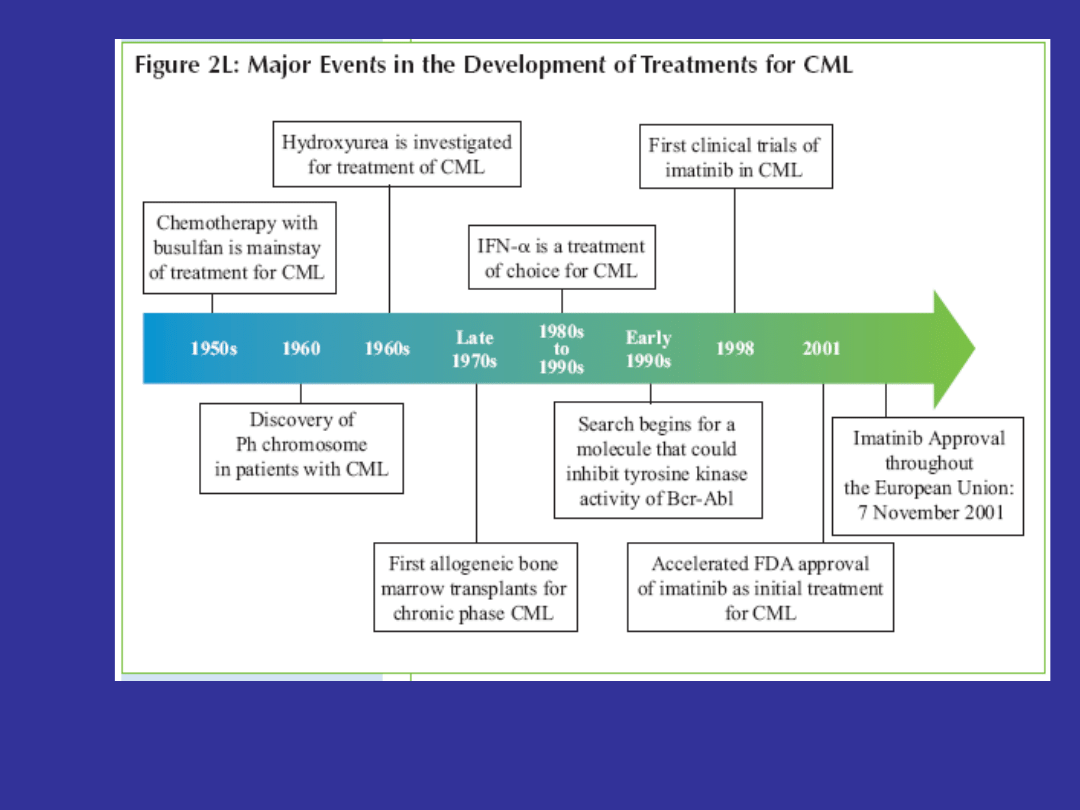
Tylko 3 dostępne metody
leczenia:
1. Allogeniczna transplantacja komórek
hematopoetycznych - od 1970
2. Zastosowanie interferonu alfa - od
1980
3. Zastosowanie imatinibu - od 1998

Medycyna oparta na faktach
ery „interferonowej”
1. Całkowita odpowiedź cytogenetyczna (CCR)
najlepszym wskaźnikiem wydłużenia
przeżycia
2. Ponowny wzrost ilości komórek Ph+ po
uzyskaniu odpowiedzi cytogenetycznej
rozwój oporności na stosowane leczenie +
zapowiedź fazy transformacji blastycznej
kwalifikacja do transplantacji lub innych
form leczenia
1. Najlepsza metoda leczenia- jak najwięcej chorych
uzyskuje MCR, a najlepiej CCR i utrzymuje ją jak
najdłużej
2. Konieczność jak najlepszego monitorowania leczenia
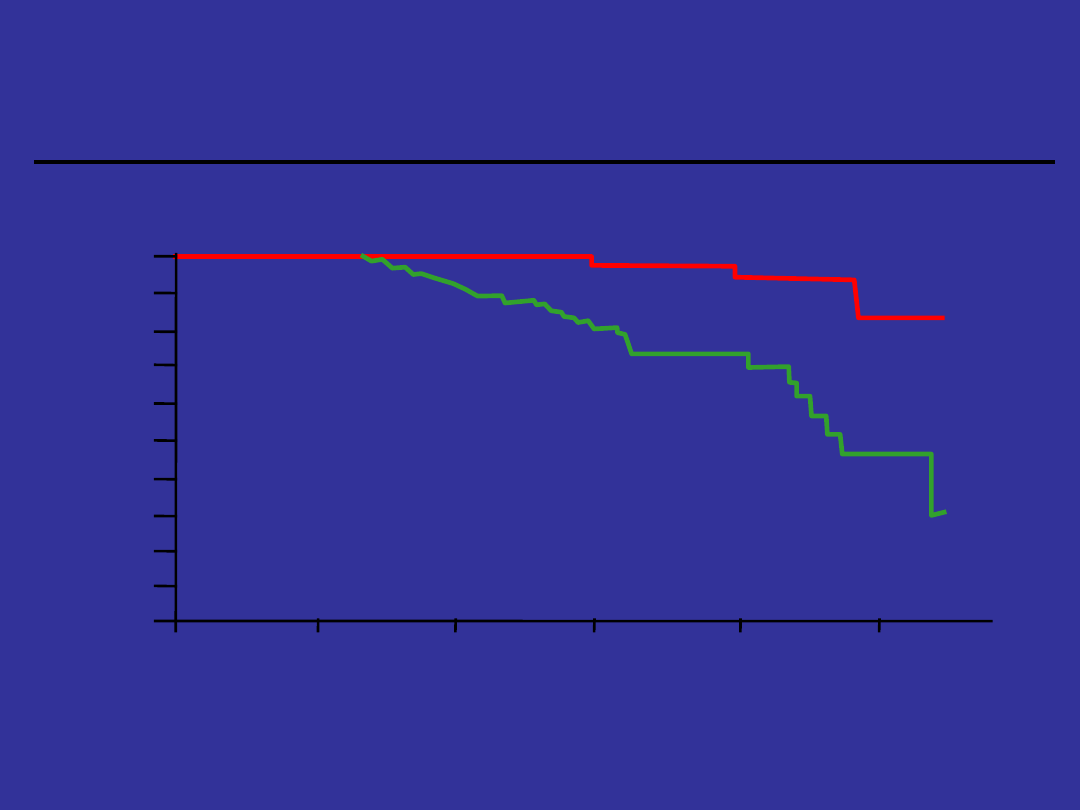
Odpowiedź
Odpowiedź
cytogenetyczna a przeżycie
cytogenetyczna a przeżycie
Guilhot F et al.. N Engl J Med.. 1997:337:223-229
Pr
a
w
d
o
p
o
d
o
b
ie
ń
st
w
o
Większa
odpowiedź
Brak lub mniejsza
odpowiedź
Miesiące po leczeniu
1.
0
0.
9
0.
8
0.
7
0.
6
0.
5
0.
4
0.
3
0.
2
0.
1
0.
0
P < .001
12
24
36
48
60

28 May
2001

Mechanizm
działania
Gliveku

BCR-ABL Gene Structure
•
Faderl S, Talpaz M, Estrov Z, Kantarjian HM. Ann Intern Med. 1999;131:207-219.
•
Faderl S, Talpaz M, Estrov Z, et al N Engl J Med. 1999;341:164-172.
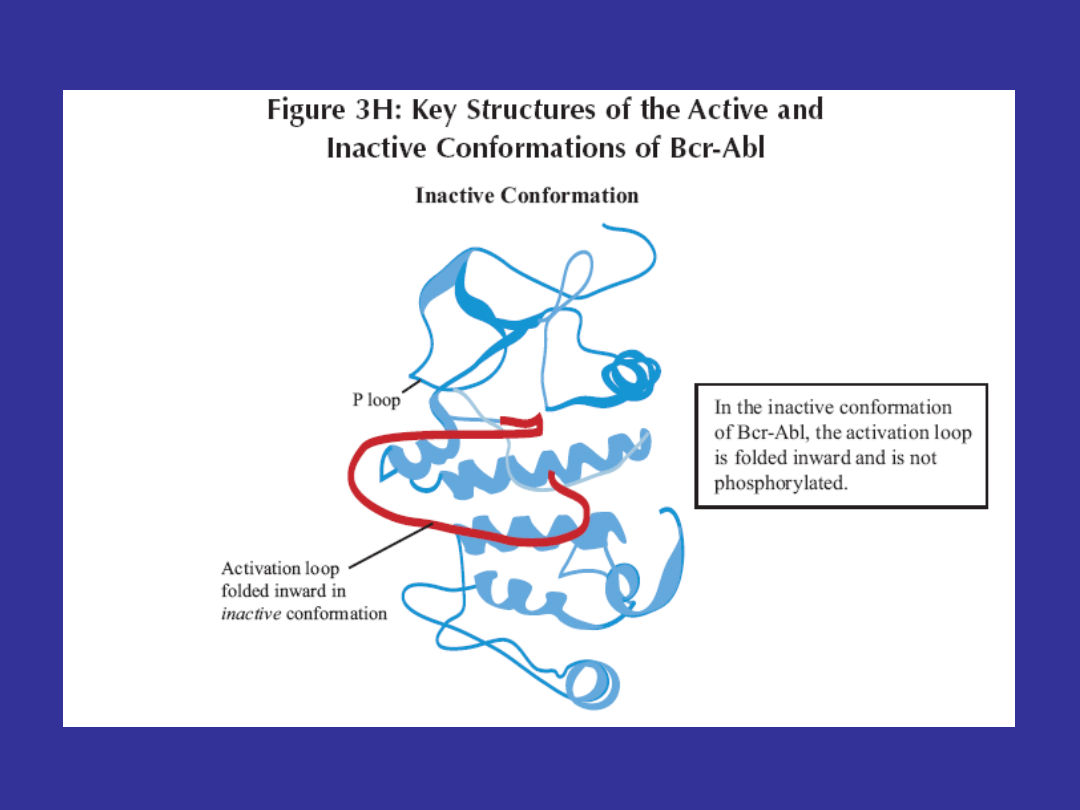
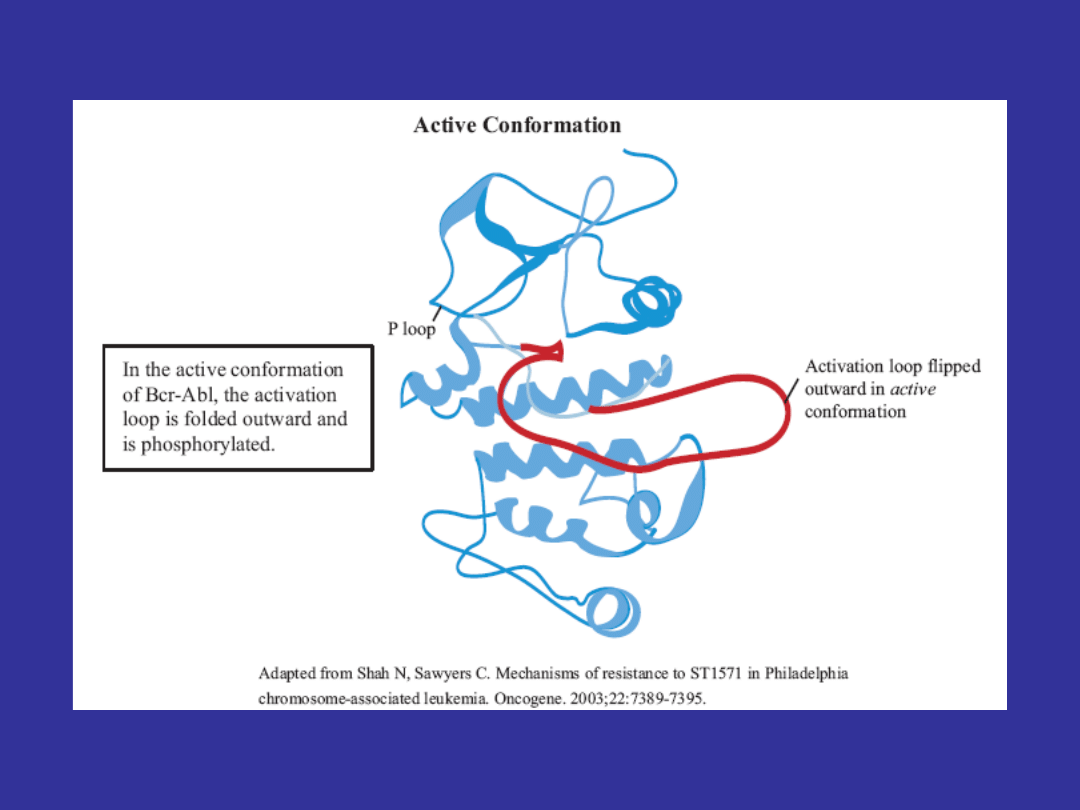
Key Structures of the Active and Inactive Conformations
of Bcr-Abl


Wiązanie imatinibu do kinazy BCR-ABL
• Kinaza BCR-ABL nieustannie zmienia konformację (z
nieaktywnej na aktywną i na odwrót)
• Imatinib ma zdolność wiązania się wyłącznie z
nieaktywną formą kinazy BCR-ABL
• od momentu przyłączenia się imatinibu, kinaza BCR-
ABL pozostaje w konformacji nieaktywnej, co w
konsekwencji zapobiega fosforylacji substratów i
prowadzi do zahamowania szlaków przewodzenia
sygnału (STI- signal transduction inhibitor)
• Imatinib powoduje również zmiany strukturalne w
pętli P (P loop), która ma wpływ na zdolność wiązania
leku i stabilność kinazy BCR-ABL w konformacji
nieaktywnej.

Leczenie celowane imatinibem
Goldman JM, Melo JV. N Engl J Med.. 344:1084-1086

Normal Bcr-Abl Signaling
P
P P
ADP
P
P
P
P P
ATP
SIGNALING
Substrate
Effector
•The Abl kinase
domain activates a
substrate protein,
eg, PI3 kinase, by
phosphorylation
•This activated
substrate initiates
a signaling cascade
culminating in cell
proliferation and
survival
ADP = adenosine diphosphate
ATP = adenosine triphosphate
P = phosphate
ABL Kinase domain
Druker et al, Hematology 2002, 1; 111-135. Savage and Antman. N Engl J Med. 2002;346:683
.

Imatinib Mesylate:
Mechanism of Action
• Imatinib mesylate
occupies the ATP
binding pocket of
the Abl kinase
domain
• This prevents
substrate
phosphorylation
and signaling
• A lack of signaling
inhibits
proliferation and
survival
P
P
P P
ATP
SIGNALING
Imatinib
mesylate
Garcia-Manero et al. Cancer. 2003;98:437- 457. Savage and Antman. N Engl J Med. 2002;346:683.
ABL Kinase domain
Imatinib Mesylate:
Background
•A selective tyrosine
kinase inhibitor of
– KIT
– Bcr-Abl
– PDGFR-A/B
•First used in Ph+
CML
Druker BJ, O’Brien SG, Cortes J, Radich J. Chronic Myelogenous Leukaemia. Haematology. 2002; American Society of Haematology.
•Class: Phenylaminopyrimidines
C
29
H
31
N
7
O•CH
4
S
O
3
Molecular weight
589.7

Dawkowanie
imatinibu

Glivec
®
is a trademark of Novartis
Europharm Ltd

Administration
•
Very dark yellow to brownish-orange film-coated
tablet in 100mg or 400mg strengths.
•
The prescribed dose should be administered
orally with a meal and a large glass of water to
minimise the risk of gastrointestinal irritations.
•
Doses of 400 mg or 600 mg should be
administered once daily, whereas a daily dose of
800 mg should be administered as 400 mg twice
a day, in the morning and in the evening.
Glivec SmPC; updated Feb 2006

Administration (cont)
• For patients unable to swallow the film-
coated tablets, the tablets may be dispersed
in a glass of mineral water or apple juice.
• The required number of tablets should be
placed in the appropriate volume of beverage
(approximately 50 ml for a 100 mg tablet,
and 200 ml for a 400 mg tablet) and stirred
with a spoon. The suspension should be
administered immediately after complete
disintegration of the tablet(s).
Glivec SmPC; updated Feb 2006

Dosing
• The recommended dosage of Glivec
®
is 400
mg/day for patients in chronic phase CML
• The recommended dosage of Glivec
®
is 600
mg/day for patients in accelerated phase or blast
crisis
• Dose increases to 600mg or 800mg per day are
permitted in the absence of severe toxicity under
some circumstances…
Glivec SmPC; updated Feb 2006
Glivec
®
is a trademark of Novartis
Europharm Ltc

Circumstances for further
dose escalation
•Disease progression at any time
•Failure to achieve a satisfactory
haematological response after at least 3
months of treatment
•Failure to achieve a cytogenetic response after
12 months of treatment
•Loss of a previously achieved haematological
and/or cytogenetic response
Glivec SmPC; updated Feb 2006

Factors requiring imatinib
therapy dose adjustment
• Non haematological adverse reactions
– Elevations in bilirubin or transaminases
– Severe events
• Treatment must be withheld until the event has
resolved, thereafter treatment may be resumed as
appropriate depending on the initial severity
• Haematological adverse reactions
– Severe neutropenia and thrombocytopenia
• Management depends on phase of and relation to
the disease and persistence of the cytopenia
Glivec SmPC; updated Feb 2006

Adapted from Glivec SmPC; updated Feb 2006
All neutrophil and platelet counts in 10
6
/L
Managing Myelosuppression: Chronic
Phase
ANC >1500 and
Plts >75,000
Resume imatinib
at 400mg
ANC <1000 or
Plts <75,000
Withhold imatinib
ANC >1500 and
Plts >75,000
Reduce imatinib
at 300mg
Withhold imatinib
ANC <1500 or
Plts <75,000
ANC <1000 and/or
Plts <50,000
Starting dose
400mg
Withhold imatinib

Adapted from Glivec SmPC; updated Feb 2006
All neutrophil and platelet counts in 10
6
/L

Profil bezpieczeństwa
Imatinibu

Precautions associated with
imatinib use
• When co-administered with other medicinal
products there is potential for interaction
–
Concomitant use of imatinib and medicinal products
that induce CYP3A4
• Occurrences of severe fluid retention
–
Pleural effusion, oedema, pulmonary oedema, ascites
• Haemorrhage
• Laboratory Tests
–
Regular complete blood counts, liver function tests
and creatinine clearance must be performed
Glivec SmPC; updated Feb 2006

Standardy
postępowania we
wczesnej fazie
przewlekłej PBS

Wnioski
• Imatinib powinien być stosowany jako
pierwsza linia terapii u pacjentów z
nowo rozpoznaną PBS
• Całkowite przeżycie 89%
(śmiertelność związana z PBS<5%) po
5 latach terapii imatinibem jest
wynikiem lepszym niż uzyskiwano za
pomocą wcześniej stosowanych
terapii

Wnioski
• Ryzyko progresji ulega zmniejszeniu w
kolejnych latach terapii
• Osiągnięcie CCR po 12 miesiącach leczenia
jest istotnym czynnikiem prognostycznym
PFS (istotniejszym niż skala Sokala i
Hasforda)
• Osiągnięcie CCR i CMoR (bez względu na
czas i wyjściowy stopień zaawansowania)
jest najistotniejszym czynnikiem
prognostycznym

Badania przy rozpoznaniu
PBS
• Morfologia krwi obwodowej z
rozmazem
• Badanie cytogenetyczne (metodą
prążkową)
• Badanie FISH (del9q+)
• Zabezpieczenie materiału do badań
molekularnych (jakościowy PCR,
ilosciowy PCR, analiza mutacji)

Całkowita remisja
hematologiczna
• PLT < 450 X 10
9
/L
• WBC < 10 x 10
9
/L
• Rozmaz bez niedojrzałych form
granulocytów (mielocytów,
promielocytów, mieloblastów), < 5%
bazofilów
• Śledziona niepowiększona
* Morfologia co 2 tygodnie do uzyskania
remisji hematologicznej, potem co 1-3
miesiące

Odpowiedź cytogenetyczna
• Całkowita Ph+ 0
• Częściowa Ph+ 1-35%
• Mniejsza Ph+ 36-65%
• Minimalna Ph+ 66-95%
• Brak Ph+ > 95%
*Co 6 miesięcy, do osiągnięcia całkowitej remisji
cytogenetycznej, potem co 12 miesięcy
**FISH wyjściowy, potem tylko jeżeli nie można
uzyskać materiału do klasycznej cytogenetyki

Odpowiedź molekularna
• Całkowita – transkrypt BCR-ABL nie
wykrywalny przy zastosowaniu
nested RT-PCR
• Większa – BCR-ABL
IS
< 0.10*
*
Stosunek BCR/ABL do genu kontrolnego wyrażony
zgodnie ze skalą międzynarodową
Po uzyskaniu całkowitej remisji cytogenetycznej
ilościowy PCR co 3 miesiące

Analiza mutacji
• Przed leczeniem – zabezpieczenie
materiału do badań
• Podczas leczenia:
- w przypadku niepowodzenia
leczenia lub odpowiedzi
suboptymalnej
- w przypadku wzrostu poziomu
transkryptu BCR-ABL (2 log?)





Odpowiedź optymalna
• 3 miesiące – całkowita odpowiedź
hematologiczna
• 6 miesięcy – częściowa odpowiedź
cytogenetyczna (Ph+ < 35%)
• 12 miesięcy – całkowita odpowiedź
cytogenetyczna (0 Ph+)
• 18 miesięcy – większa odpowiedź
molekularna

Niepowodzenie terapii
• 3 months - brak odpowiedzi hematologicznej
• 6 months - brak całkowitej odpowiedzi
hematologicznej, brak odpowiedzi
cytogenetycznej (Ph+>95%)
• 12 months – brak częściowej odpowiedzi
cytogenetycznej (Ph+ >35%)
• 18 months – brak całkowitej odpowiedzi
cytogenetycznej
• Zawsze – utrata odpowiedzi hematologicznej,
utrata odpowiedzi cytogenetycznej, mutacje
oporne na imatinib

Odpowiedź suboptymalna
• 3 miesiące – brak całkowitej odpowiedzi
hematologicznej
• 6 miesięcy – brak częściowej odpowiedzi
cytogenetycznej (Ph+ > 35%)
• 12 miesięcy – brak całkowitej odpowiedzi
cytogenetycznej
• 18 miesięcy – brak większej odpowiedzi
molekularnej (MMoR)
• Zawsze – utrata MMoR, ewolucja klonalna
w komórkach Ph+

Uwaga!
• Diagnoza – wysokie ryzyko (Sokal,
Hasford), del 9q+, dodatkowe
aberracje w klonie Ph+
• 12 miesięcy – brak większej
odpowiedzi molekularnej
• Zawsze – każdy wzrost poziomu
transkryptu BCR-ABL, aberracje
chromosomalne w klonie Ph-

Postępowanie
• Odpowiedź optymalna
– kontynuacja IM
• Niepowodzenie terapii
– kontynuowanie IM w
dotychczasowej dawce nie jest korzystne dla
pacjenta ( dawki IM, nowe inhibitory kinazy,
alloprzeszczep
)
• Odpowiedź suboptymalna
– kontynuowanie IM
może wciąż być korzystne dla pacjenta, ale
odległe rokowanie prawdopodobnie gorsze (
dawki IM, nowe inhibitory kinazy, alloprzeszczep)
• Uwaga!
– kontynuacja IM ale pacjent wymaga
bardzo uważnego monitorowania

Dylemat przy niepowodzeniu terpii
Glivekiem
Czy rekomendować
transplantacje szpiku
czy leczenie
innymi inhibitorami
kinazy

•
szansę nie tylko całkowitego
przeżycia, ale również przeżycia
najbliższych lat
•
wyniki leczenia w danej grupie
wiekowej
•
czynniki rokownicze
•
preferencje i sytuacje chorego
Wybór optymalnej metody leczenia
Wybór optymalnej metody leczenia
Powinien uwzględniać:

Remisje molekularne (MR) po allogenicznej transplantacji w CML
Remisje molekularne (MR) po allogenicznej transplantacji w CML
MR: negatywny wynik badania w kier.BCR-ABL w gniazdowej RT-PCR (nested PCR)
MR: negatywny wynik badania w kier.BCR-ABL w gniazdowej RT-PCR (nested PCR)
Czas trwania MR
w latach po alloHSCT
Czas trwania MR
w latach po alloHSCT
Trwała MR
%
Trwała MR
%
Monitorowanie
lata
Monitorowanie
lata
Autor
Autor
0,5 83 3 Olavarria et al.Blood 2001
>3 99 BD Radich et al.Blood 2001
5 97 10 Mughal et al. BJH 2001
0,5 83 3 Olavarria et al.Blood 2001
>3 99 BD Radich et al.Blood 2001
5 97 10 Mughal et al. BJH 2001
Remisja molekularna jest długotrwała u większości pacjentów
Remisja molekularna jest długotrwała u większości pacjentów
T.Lange i wsp
T.Lange i wsp

Remisje molekularne (MR) w trakcie leczenia imatinibem
Remisje molekularne (MR) w trakcie leczenia imatinibem
Odsetek Gniazdowa Faza CML Dawka Autor
Negatywnych RT-PCR imatinibu
W RT-PCR
Odsetek Gniazdowa Faza CML Dawka Autor
Negatywnych RT-PCR imatinibu
W RT-PCR
3% nie de novo 400 Hughes i ws. NEJM 2003
0% - oporni na IFN 400 Merx i wsp.Leukemia 2002
13% tak oporni na IFN 400 Kantarijan i wsp.Clin
Cancer Res 2003
12% nie oporni na IFN 400 Rosti i wsp.Blood 2004
28% nie oporni na IFN 800 Kantarijan i wsp.Blood 2004
41% nie oporni na IFN 800 Cortes i wsp.Blood 2004
3% nie de novo 400 Hughes i ws. NEJM 2003
0% - oporni na IFN 400 Merx i wsp.Leukemia 2002
13% tak oporni na IFN 400 Kantarijan i wsp.Clin
Cancer Res 2003
12% nie oporni na IFN 400 Rosti i wsp.Blood 2004
28% nie oporni na IFN
800
Kantarijan i wsp.Blood 2004
41% nie oporni na IFN
800
Cortes i wsp.Blood 2004
Nie obserwowano długotrwałych remisji molekularnych
Nie obserwowano długotrwałych remisji molekularnych
T.Lange i wsp
T.Lange i wsp

Ryzyko nawrotu molekularnego po
alloHSCT i w przebiegu leczenia imatinibem
Ryzyko nawrotu molekularnego po
alloHSCT i w przebiegu leczenia imatinibem
Czas obserwacji Odsetek nawrotów
alloHSCT: 60 mcy 17%
Imatinib: 15 mcy 80%
Czas obserwacji Odsetek nawrotów
alloHSCT: 60 mcy 17%
Imatinib: 15 mcy 80%
P = 0.0001
P = 0.0001
T.Lange i wsp
T.Lange i wsp

Wyniki badania ilości transkryptu BCR-ABL po
alloHSCT i w przebiegu leczenia imatinibem
Wyniki badania ilości transkryptu BCR-ABL po
alloHSCT i w przebiegu leczenia imatinibem
Imatinib allograft zdrowi dawcy
n=17 n=19 n=20
Imatinib allograft zdrowi dawcy
n=17 n=19 n=20
Ilość próbek 36 45 20
Ilość próbek z
przynajmniej jednym 18(50%) 8(17%) 4(20%)
dodatnim wynikiem
w 10x powtórzonym
RT-PCR p=0.003 p=0.9
Ilość próbek 36 45 20
Ilość próbek z
przynajmniej jednym 18(50%) 8(17%) 4(20%)
dodatnim wynikiem
w 10x powtórzonym
RT-PCR
p=0.003
p=0.9
T.Lange i wsp
T.Lange i wsp

Wnioski z badania ilości transkryptu BCR-ABL po
alloHSCT i w przebiegu leczenia imatinibem
Wnioski z badania ilości transkryptu BCR-ABL po
alloHSCT i w przebiegu leczenia imatinibem
leczenie imatinibem wywołuje krótsze remisje moleukalrne niż alloHSCT
ilość transkryptu BCR-ABL pozostaje wyższa u chorych leczonych imatinibem
w porównaniu z pacjentami po alloHSCT
określenie znaczenia prognostycznego remisji molekularnej i nawrotu
molekularnego podczas terapii imatinibem wymaga badań na większych
grupach chorych.
leczenie imatinibem wywołuje krótsze remisje moleukalrne niż alloHSCT
ilość transkryptu BCR-ABL pozostaje wyższa u chorych leczonych imatinibem
w porównaniu z pacjentami po alloHSCT
określenie znaczenia prognostycznego remisji molekularnej i nawrotu
molekularnego podczas terapii imatinibem wymaga badań na większych
grupach chorych.
T.Lange i wsp
T.Lange i wsp

Długość trwania remisji molekularnych w trakcie
leczenia imatinibem.
Długość trwania remisji molekularnych w trakcie
leczenia imatinibem.
• Duża odpowiedź molekularna:
- utrzymująca się odpowiedź u 72% chorych
- średnia obserwacji 19 mcy (3-33)
• Całkowita odpowiedź molekularna
- utrzymująca się odpowiedź u 43% chorych
- średnia obserwacji 18 mcy (3-27)
• 28% utraciło odpowiedź po zaprzestaniu leczenia
• Duża odpowiedź molekularna:
- utrzymująca się odpowiedź u 72% chorych
- średnia obserwacji 19 mcy (3-33)
• Całkowita odpowiedź molekularna
- utrzymująca się odpowiedź u 43% chorych
- średnia obserwacji 18 mcy (3-27)
• 28% utraciło odpowiedź po zaprzestaniu leczenia
Cortes i wsp.
Cortes i wsp.

Allogeniczna transplantacja komórek
Allogeniczna transplantacja komórek
hematopoetycznych
hematopoetycznych
•
Jedyna metoda leczenia pozwalająca na
trwałe wyleczenie u większości chorych
•
Najlepsze wyniki osiągane są przy
przeszczepieniu szpiku w przewlekłej fazie
choroby, w jak najkrótszym czasie od
rozpoznania PBS (< 1 roku) oraz u chorych
młodszych i mających dawców rodzinnych
lub w pełni zgodnych (10/10) dawców
niespokrewnionych
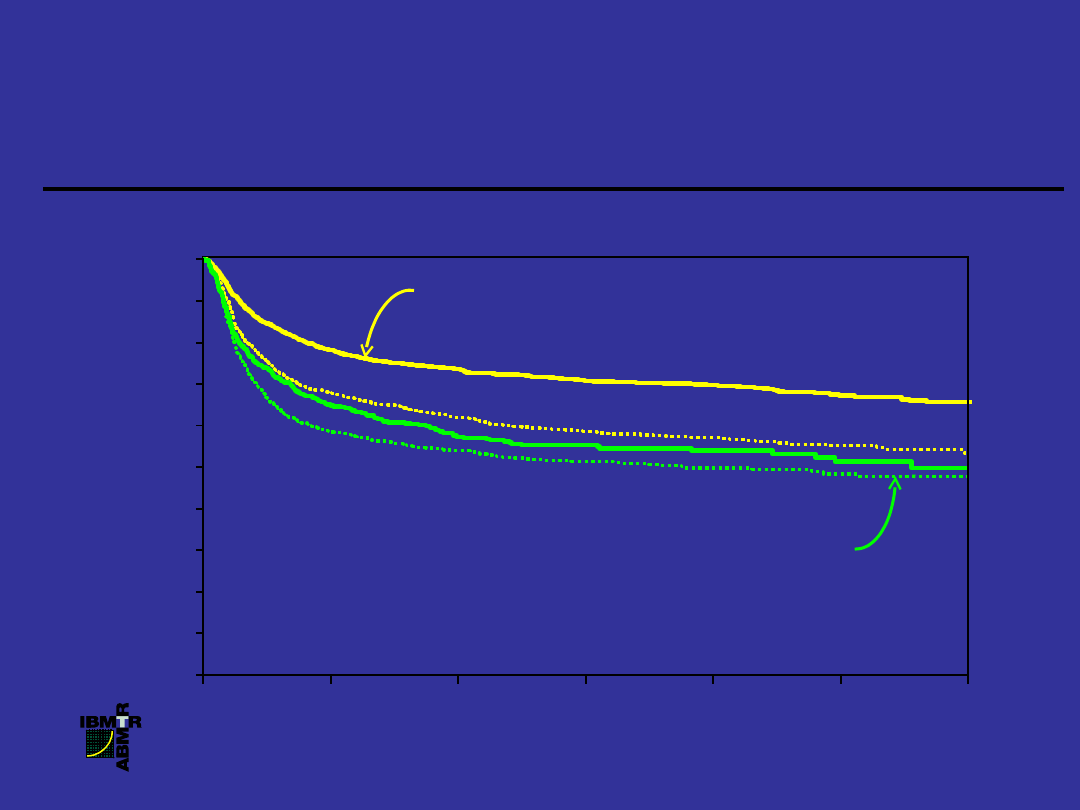
Prawdopodobieństwo przeżycia chorych z
PBS po allogenicznej transplantacji szpiku,
1996-2001
z uwzględnieniem typu dawcy i czasu trwania choroby
P
R
A
W
D
O
P
O
D
O
B
IE
Ń
S
T
W
O
,
%
100
0
20
40
60
80
LATA
HLA-zgodne rodzeństwo
, 1 rok (N
= 2,720)
HLA-zgodne rodzeństwo, 1 rok (N =
1,317)
Niespokrewnione
1 rok (N = 677)
Niespokrewnione, 1 rok (N = 951)
0
1
2
3
4
6
5
P = 0.0001
70%
50%


Lata
4,
5
BMT
P
ra
w
d
o
p
o
d
o
b
ie
ń
s
tw
o
Skrzyżowanie przeżycia chorych z PBS leczonych BMT lub INF
IFN

Allogeniczna transplantacja komórek
Allogeniczna transplantacja komórek
hematopoetycznych
hematopoetycznych
•
Większość niepowodzeń (80-90%)
występuje w ciągu pierwszego roku po
transplantacji
•
Najczęściej (60-70%) wiążą się z chorobą
przeszczep przeciw gospodarzowi,
powikłaniami infekcyjnymi i rzadziej (10-
15%) toksycznością związaną z
postępowaniem przygotowawczym
•
Skala Gratwohla pozwala przewidzieć
ryzyko powikłań okołotransplantacyjnych
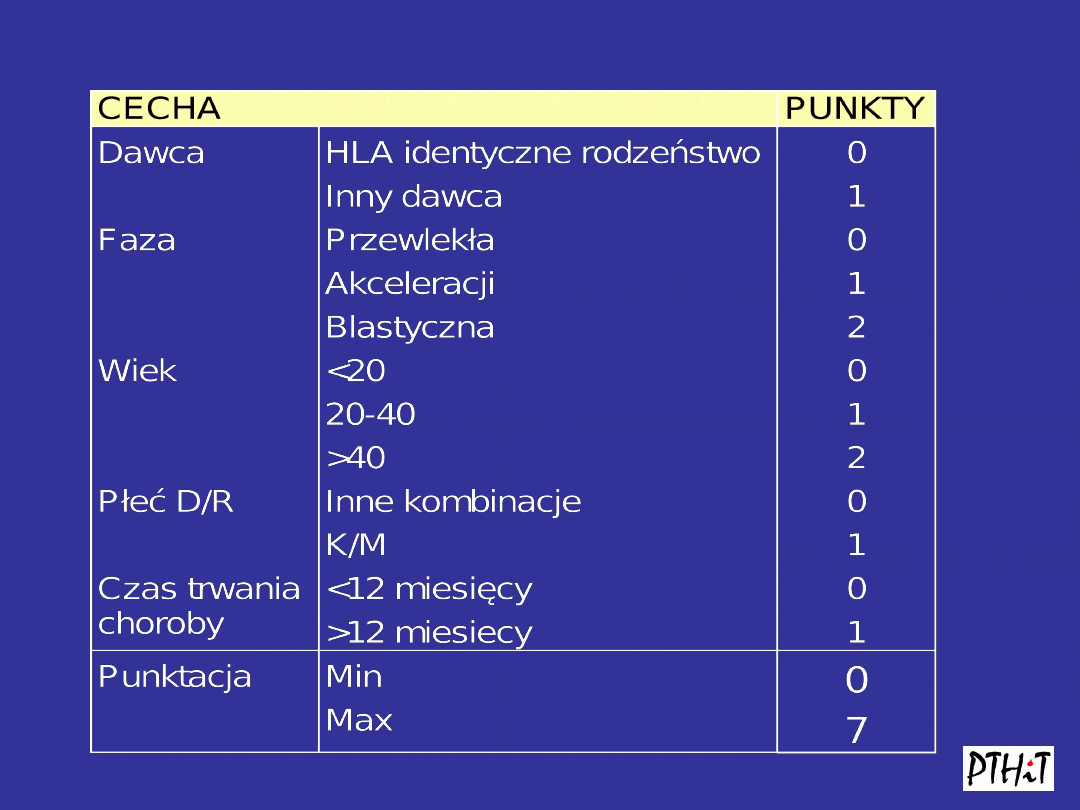
Skala Gratwohla
Skala Gratwohla

FAZA ZAAWANSOWANA

FAZA AKCELERACJI PBS
FAZA AKCELERACJI PBS
Obowiązują te same zasady co w leczeniu fazy
przewlekłej
Należy jednak pamiętać:
1. Leczenie imatinibem zaczynamy od dawki co najmniej
600mg
2. Częściej występuje oporność pierwotna i nabyta
3. Po stwierdzeniu oporności chorych należy jak
najszybciej kwalifikować do innych dostępnych form
leczenia

FAZA BLASTYCZNA PBS
FAZA BLASTYCZNA PBS
1. W fazie kryzy blastycznej celem leczenia jest
uzyskanie
„drugiej”
fazy przewlekłej (odpowiedź
hematologiczna), a nie odpowiedzi cytogenetycznej
czy molekularnej.
2. Dawka: najlepiej 800 mg
3. W leczeniu imatinib często kojarzy się z
cytostatykami celem zwiększenia szansy
odpowiedzi.
4. Z uwagi, że odpowiedź na imatinib w fazie kryzy
blastycznej jest krótkotrwała (4-8 tygodni) chorych
od początku leczenia kwalifikuje się, o ile to możliwe
do transplantacji szpiku
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
Wyszukiwarka
Podobne podstrony:
Farmakoterapia przewlekłej białaczki szpikowej new
Przewlekła białaczka szpikowa jest chorobą nowotworową szpiku kostnego i krwi
Współczesne zasady leczenia osteoporozy
Przewlekła białaczka szpikowa(1), Pierwsza Pomoc Przedmedyczna, Medycyna, Onkologia
Przewlekła białaczka szpikowa
Współczesne zasady leczenia osteoporozy
13 Przewlekła białaczka szpikowa
Podstawowe zasady leczenia ostrego i przewlekłego bólu w praktyce lekarza rodzinnego
Bialaczka szpikowa przewlekla
Oparzenia Zasady Leczenia krĂłtkie
OGÓLNE ZASADY LECZENIA OSTRYCH ZATRUĆ
16 Ogolne zasady leczenia ostrych zatrucid 16903 ppt
zasady leczenia zakazen
Leczenie przewlekłych zapaleń wątroby
WSPOLCZESNE WYTYCZNE LECZENIA ZABURZEN LIPIDOWYCH
Leczenie przewleklego WZW typu B
więcej podobnych podstron