POLSKIE WWW
ŚWIATOWE WWW
Układ okresowy
Powłoki
Obliczenia
Definicje
Linki do tematu
Chemia organiczna
Chemia ogólna
POWRÓT
Natura związków organicznych i ich budowa
Spis treści rozdziału - tutaj kliknij
Ogólna charakterystyka związków organicznych
Węglowodory alifatyczne
Węglowodory aromatyczne
Struktura związków organicznych
Ogólna charakterystyka związków organicznych
Pierwszą definicję Chemii organicznej podali Gmelin 1848, Kekule 1851 twierdząc że,
"Chemia organiczna jest chemią
związków węgla"
ale definicję Chemii organicznej słuszną do dziś podał Schurlenmer w 1889 r:
- "Chemia organiczna jest
chemią węglowodorów i ich pochodnych"
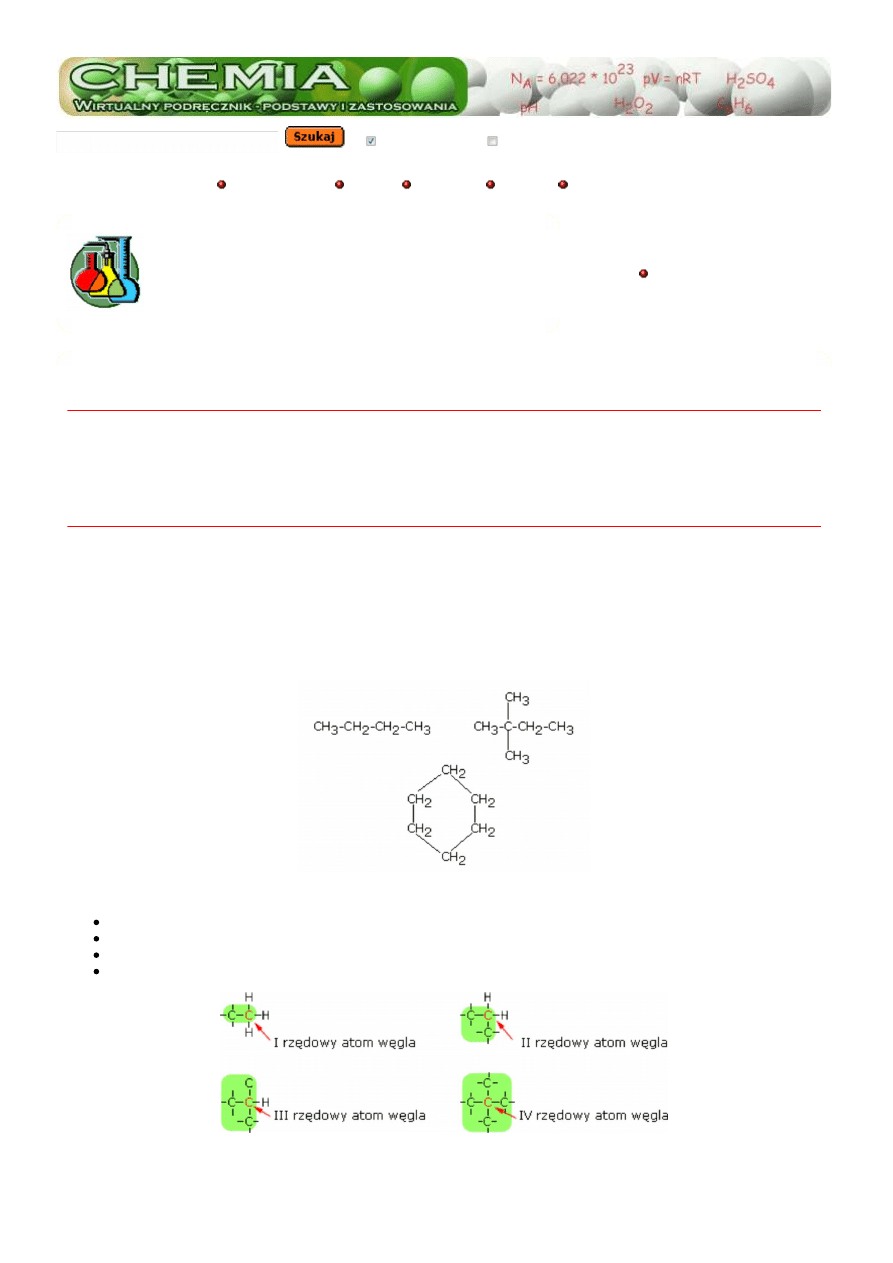
Podstawowym pierwiastkiem w połączeniach organicznych jest węgiel. Atomy węgla posiadają zdolność łączenia się pomiędzy
sobą w nawet bardzo długie łańcuchy. Te z kolei mogą być proste lub rozgałęzione, a poza tym łańcuch może ulec zamknięciu
tworząc pierścień. Oto przykłady.
Ze zdolnością łączenia się atomów węgla pomiędzy sobą wiąże się zagadnienie rzędowości atomu węgla.
atom węgla połączony tylko z jednym atomem węgla określa się jako węgiel
pierwszorzędowy
połączony z dwoma atomami węgla -
drugorzędowy
połączony z trzema atomami węgla jako
trzeciorzędowy
atom węgla połączony z czterema atomami węgla nosi nazwę
czwartorzędowego
lub węgla "neo"
Podstawową grupą połączeń organicznych są związki zbudowane z atomów węgla i wodoru, nazywane
węglowodorami.
.
Węglowodory ze względu na budowę szkieletu węglowego dzielimy na dwie główne klasy:
węglowodory alifatyczne i
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna1.htm
1 z 5
2012-01-22 22:10
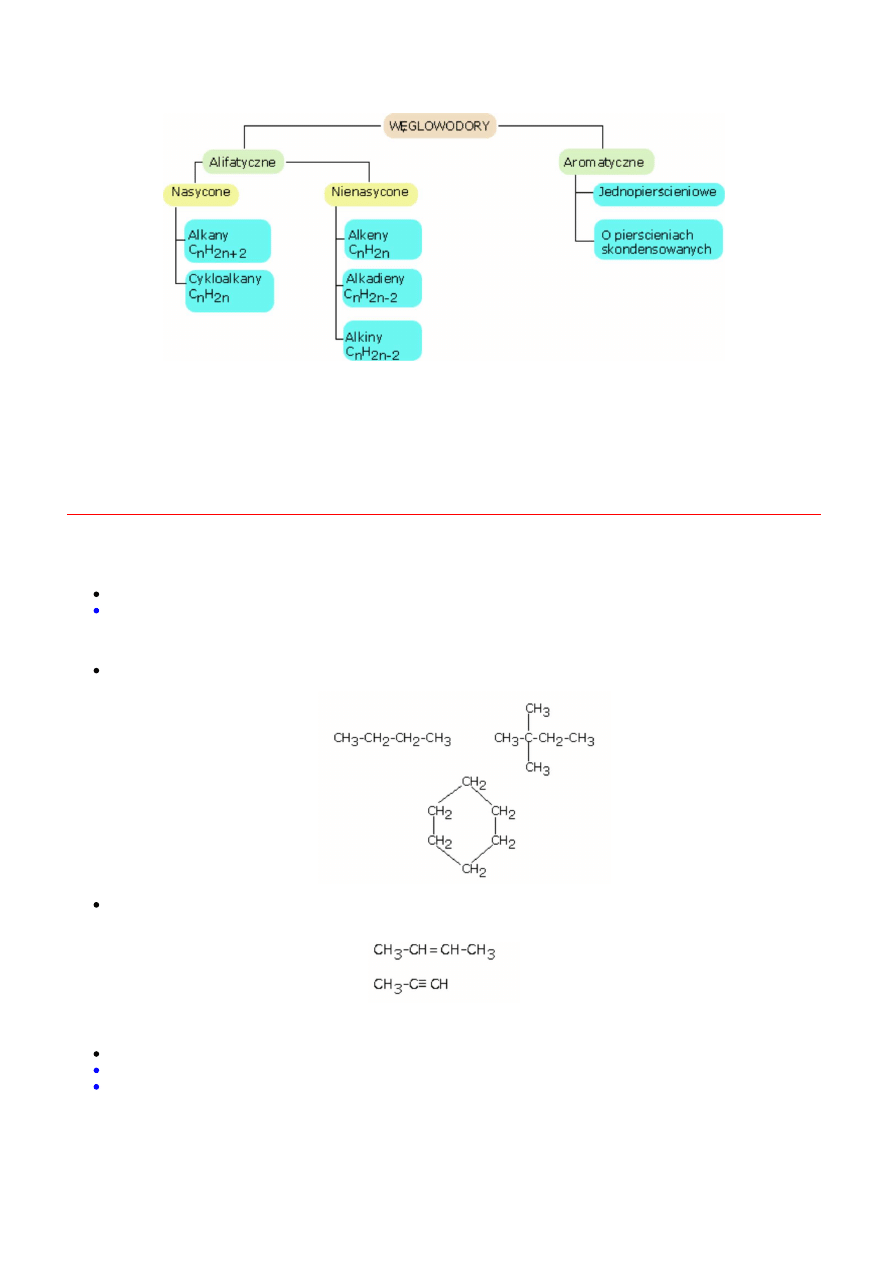
weglowodory aromatyczne.
Węglowodory alifatyczne z kolei dzielą się na
alkany, alkeny, alkiny oraz ich analogi pierścieniowe
(cykloalkany itd.)
Same węglowodory są substancjami macierzystymi wszystkich związków organicznych, które nazywane są pochodnymi
węglowodorów.
Pochodne są to związki, powstałe wskutek podstawienia pojedyńczych atomów wodoru przez inne atomy lub grupy atomów,
które noszą nazwę podstawników.Przykład - CH3COOH jest pochodną CH4 (metan). Jeden atom wodoru w CH
4
został
podstawiony grupą atomów (-COOH).
Inne przykłady:C
2
H
5
Cl, C
3
H
7
OH, C
4
H
9
NO
2
, C
2
H
5
CHO, itd.
Węglowodory alifatyczne
Węglowodory alifatyczne, mogą łączyć sie ze sobą tworząc;
struktury łańcuchowe
struktury cykliczne
Węglowodory posiadające struktury łańcuchowe
mogą mieć łańcuchy proste lub rozgałęzione a te z kolei mogą być:
nasycone
tzn. atomy węgla połączone są tylko za pomocą wiązań pojedyńczych (-C-C-).
nienasycone
tzn. atomy węgla połączone są za pomocą wiązań podwójnych (-C=C-) lub potrójnych. Wiązania wielokrotne
(podwójne i potrójne) moga występować w różnych ilościach.
Przy dwóch wiązaniach podwójnych wyróżnia się układy:
układ skumulowany C=C=C
układ sprzężony C=C-C=C
układ izolowany C=C-C-C-C=C
Połączenia cykliczne
mogą być trój-, cztero-, pięcio-, sześcio-, .... wieloczłonowe, na przykład:
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna1.htm
2 z 5
2012-01-22 22:10
Węglowodory aromatyczne
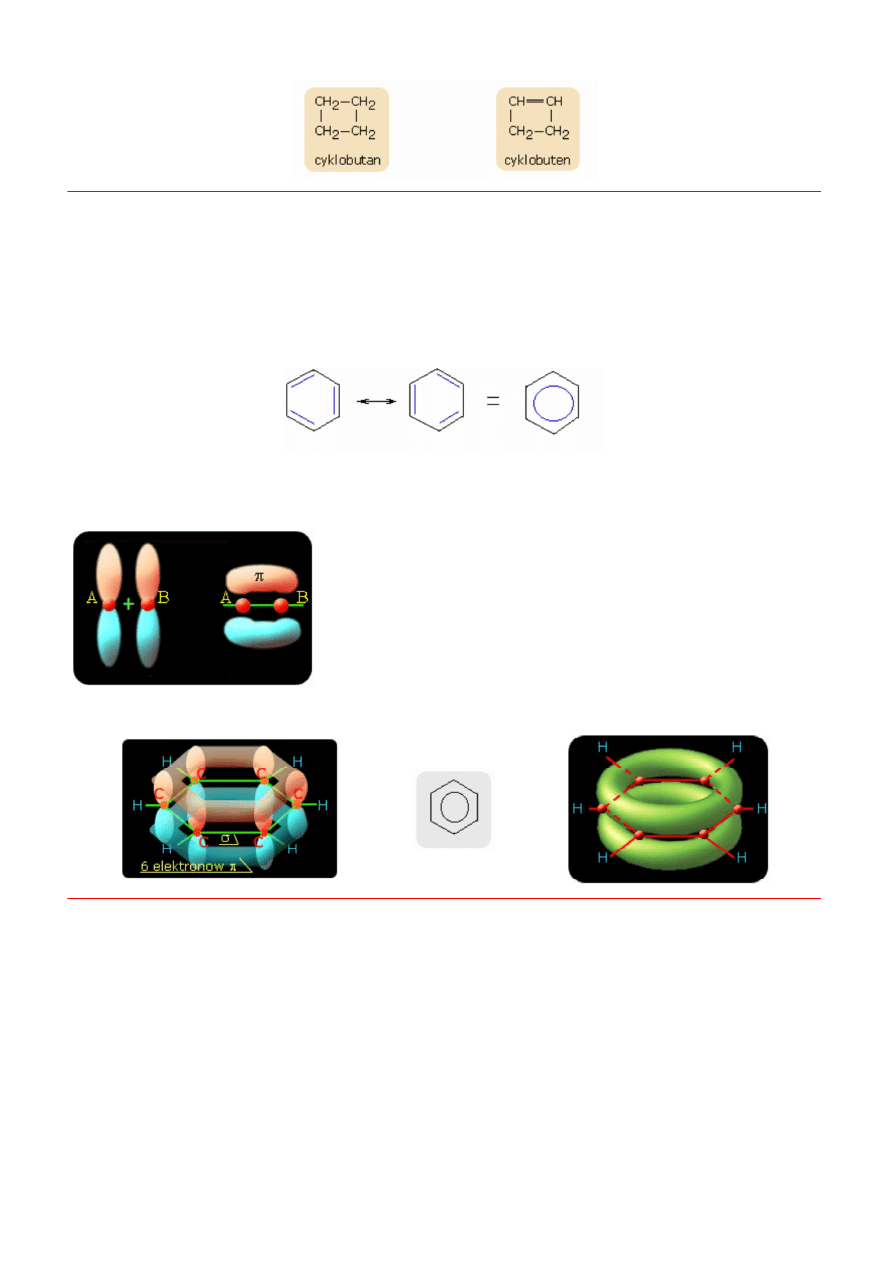
Wsród połączeń cyklicznych wyróżnia się połączenia aromatyczne o specyficznym układzie wiązań podwójnych, sprzężonych. Są
to połączenia o budowie płaskiej, zawierające elektrony (p), których ilość obliczamy zgodnie z regułą
Huckla
Reguła Huckla
Układ aromatyczny ma 4n + 2 elektronów (p), gdzie n - ilość pierścieni
Przykładem jest węglowodór o nazwie benzen, który posiada 6 elektronów p
W takim układzie elektrony mogą przesuwać się wzdłuż łańcucha co prowadzi do wyrównania gęstości elektronowej w całym
pierścieniu. Mamy tutaj przypadek delokalizacji elektronów, który przedstawiany jest za pomocą specjalnego symbolu wiązania
(kółko). To przesuwanie się elektronów wzdłuż pierścienia, zawdzięczamy obecności wiązania p.
Wiązanie podwójne składa się z wiązania s i p. Wiązanie p jest to wiązanie
chemiczne utworzone w wyniku bocznego nakładania się orbitali atomowych.
Wiązanie (p) charakteryzuje się występowaniem maksymalnego zagęszczenia
uwspólnionych par elektronów ponad linią łączącą jądra na płaszczyznie
przechodzącej przez linię łączącą oba jądra. Wiązanie s powstaje w wyniku
osiowego nakładania się orbitali. Na rysunku linia zielona łącząca atomy A i B.
Przykład - benzen
Struktura związków organicznych
Najprostszym węglowodorem jest metan o wzorze CH
4
i tetraedrycznej strukturze cząsteczki. Taka struktura jest wynikiem
hybrydyzacji sp
3
w atomie węgla a powstałe orbitale wiążące sp
3
, skierowane są ku wierzchołkom czworościanu. Takie właśnie
rozmieszczenie orbitali umożliwia maksymalne ich oddalenie (rys. 14.1) i przyjęcie struktury tetraedrycznej.
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna1.htm
3 z 5
2012-01-22 22:10

Rys. 14.1 Cząsteczka metanu
Aby każdy z orbitali sp
3
utworzył najmocniejsze wiązanie ze sferycznym orbitalem s atomu wodoru, każdy atom wodoru musi
znalezć się dokładnie w wierzchołku czworościanu.
Ponieważ atomy węgla i atomy wodoru mają prawie taką samą elektroujemność, dlatego opócz wiązania węgiel - wodór mogą
być utworzone wiązania węgiel - węgiel. I dlatego liczba węglowodorów nie ogranicza się tylko do najprostszego węglowodoru
CH
4
, lecz jest możliwy szereg związków, jak np. C
2
H
6
(etan), C
3
H
8
(propan). Szereg nie zatrzymuje sie na propanie, lecz biegnie
dalej w sposób nie kończący, przy czym każdy człon ma wzór ogólny C
n
H
2n+2
. Mówimy wtedy, że węglowodory tworzą szereg
homologiczny. W szeregu homologicznym węglowodory jak ich pochodne, różnią się o stałą różnicę, zwaną różnicą
homologiczną, którą jest
grupa metylenowa -CH
2
-.
Przykładem jest szereg homologiczny alkanów, alkenów i alkinów (tablica 12.1)
Tablica 12.1
Szeregi homologiczne węglowodorów (różnica homologiczna - grupa metylowa)
Wzór
Nazwa
Wzór
Nazwa
Wzór
Nazwa
Wzór
Nazwa
Alkany
C
n
H
2n+2
Alkile
C
n
H
2n+1
Alkeny
C
n
H
2n
Alkiny
C
n
H
2n-2
CH
4
Metan
CH
3
Metyl
C
2
H
6
Etan
C
2
H
5
Etyl
C
2
H
4
Eten, etylen
C
2
H
2
Etyn, acetylen
C
3
H
8
Propan
C
3
H
7
Propyl
C
3
H
6
Propen, propylen
C
3
H
4
Propyn
C
4
H
10
Butan
C
4
H
9
Butyl
C
4
H
8
Buten
C
4
H
6
Butyn
C
5
H
12
Pentan
C
5
H
11
Amyl, Pentyl C
5
H
10
Penten
C
3
H
4
Pentyn
C
6
H
14
Heksan
C
6
H
13
Heksyl
C
6
H
12
Heksen
C
6
H
10
Heksyn
C
7
H
16
Heptan
C
7
H
15
Heptyn
C
7
H
14
Hepten
C
7
H
12
Heptyn
C
8
H
18
Oktan
C
8
H
17
Oktyl
C
8
H
16
Okten
C
8
H
14
Oktyn
C
9
H
20
Nonan
C
9
H
19
Nonyl
C
9
H
18
Nonen
C
9
H
16
Nonyn
C
10
H
22
Dekan
C
10
H
21
Dekyl
C
10
H
20
Deken
C
10
H
18
Dekyn
C
11
H
24
Undekan
C
12
H
26
Dodekan
Czytelnik powinien bezwarunkowo zapamiętać nazwy przynajmniej pierwszych dziesięciu alkanów. Jeżeli to uczynił, to
w zasadzie nauczył się również nazw pierwszych dziesięciu alkenów, alkinów, alkoholi, itd., ponieważ nazwy wielu
klas związków są ściśle z sobą związane.
Ponadto daje się zauważyć, że wraz ze wzrostem ilości atomów węgla w cząsteczce, wzrasta ilość możliwych przestrzennych
rozmieszczeń atomów. Takie związki różniące się przestrzennym rozmieszczeniem atomów nazywa się
izomerami
. Więcej o
izomerii związków organicznych w kolejnym rozdziale.
POWRÓT
DALEJ
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna1.htm
4 z 5
2012-01-22 22:10

Pojęcia i prawa
/
Reakcje chemiczne
/
Budowa atomu
/
Powłoki elektronowe
/
Układ okresowy
/
Wpływ budowy
/
Wiązania chemiczne
/
Energetyka
/
Roztwory
/
Elektrolity
/
Procesy
"Redox"
/
Elektrochemia
/
Nieorganiczna
/
Organiczna
/
Chemia w przemysle
/
Spis treści serwisu - liceum
/
Kontakt z autorem strony
/
ă
Copyright - "CHEMIA OGÓLNA -2002-2006"
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna1.htm
5 z 5
2012-01-22 22:10
Wyszukiwarka
Podobne podstrony:
Chemia Natura związków organicznych i ich budowa
Naturalne związki organiczne spotykane w życiu codziennym
izomeria zwiazkow organicznych
Naturalne źródła węglowodorów i ich pochodne
Zarządzanie konfliktami w organizacji i ich rozwiązywanie, EKONOMIA, Zarządzanie, Zarządzanie(1)
Witaminy są związkami organicznymi, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa
Analiza klasyczna związku organicznego I 2012
Identyfikacja zwiazkow organicznych
Izomeria związków organicznych
analiza zwiazkow organiczna id Nieznany (2)
chemia sprawdzian ze zwiazkow organicznych
Cw 8 Utlenianie zwiazkow organicznych
Analiza klasyczna związku organicznego II 2012
okb- wykłady-ściąga do druku, Politechnika Krakowska, VI Semestr, Organizacja kierowanie budowa i BH
,organizacja produkcji budowalnych, pozwolenie na budowę i użytkowanie dla domku jednorodzinnegox
więcej podobnych podstron