Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
1
BADANIE WYNIKÓW NAUCZANIA Z CHEMII
POZIOM ROZSZERZONY
(ważne doświadczenia)
Czas pracy 45 minut
Za rozwiązanie wszystkich zadań można otrzymać łącznie 30 punktów.
Informacja do zadań 1–3
Temat doświadczenia: Badanie rozpuszczalności metanolu w wodzie.
Opis czynności: Do zlewki z wodą dodano metanol. Zawartość naczynia wymieszano za pomocą szklanej
bagietki.
Zadanie 1. (1 pkt)
1.1
wybierz i podkreśl właściwą obserwację.
Obserwacja: Zawartość zlewki uległa rozdzieleniu na dwie warstwy / Otrzymano klarowny roztwór.
Zadanie 2. (1 pkt)
2.1
Uzupełnij poniższy wniosek. w tym celu wybierz i podkreśl odpowiednie sformułowanie. Swój wybór
uzasadnij, odnosząc się do budowy cząsteczki metanolu.
Wniosek: Metanol bardzo dobrze rozpuszcza się / praktycznie nie rozpuszcza się w wodzie.
Uzasadnienie: ................................................................................................................................................
.........................................................................................................................................................................
Zadanie 3. (1 pkt)
3.1
Spośród podanych niżej metod rozdziału mieszanin wybierz i podkreśl tę metodę, za pomocą której
rozdzielisz składniki otrzymanej w doświadczeniu mieszaniny.
destylacja , sączenie , rozdział za pomocą rozdzielacza
Zadanie 4. (1 pkt)
4.1
Poniższa tabela przedstawia zależność rozpuszczalności amoniaku w wodzie od temperatury.
Temperatura, ºc
Źródło: Małe tablice chemiczne,
Wydawnictwo Adamantan,
Warszawa 2005.
0
20
40
60
80
100
Rozpuszczalność,
g/100 g H
2
O
88,7
52,2
32,2
23,8
15,4
7,4
Nasycony w temperaturze 20ºC roztwór amoniaku ogrzano do temperatury 100ºC.
napisz, jakie zmiany zaobserwowano.
.........................................................................................................................................................................
.........................................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
2
Zadanie 5. (3 pkt)
5.1 5.2
Zadaniem laboranta było przygotowanie 0,5 dm
3
roztworu kwasu azotowego(V) o stężeniu 0,2 mol ∙ dm
–3
.
Dysponował następującymi odczynnikami i sprzętem laboratoryjnym:
Odczynniki: kwas azotowy(V) o stężeniu C
p
= 65% i gęstości d = 1,4 g ∙ cm
–3
, woda destylowana.
Sprzęt laboratoryjny: kolba miarowa (500 cm
3
) z korkiem, pipeta, zlewka.
wykonaj potrzebne obliczenia (z dokładnością do pierwszego miejsca po przecinku), a następnie
uzupełnij opis czynności z uwzględnieniem podanego powyżej sprzętu laboratoryjnego.
Obliczenia:
Czynności:
Kolbę miarową o objętości 500 cm
3
napełnić do połowy wodą destylowaną. Za pomocą pipety odmierzyć
i dodać ............. cm
3
65-proc. kwasu azotowego(V). Zawartość kolby wymieszać, a następnie .................
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
Zadanie 6. (2 pkt)
6.1 6.2
Na dwóch wagach analitycznych położono szkiełka zegarkowe. Wagi wyzerowano. Następnie na pierw-
szym szkiełku zegarkowym położono mały kawałek sodu, a na drugie szkiełko zegarkowe nasypano krysz-
tałki jodu. Wskazania wag były jednakowe – równe 0,50 g. Pomiar masy przeprowadzono w temperaturze
pokojowej.
Po upływie kilku minut sprawdzono wskazania obu wag.
a) Uzupełnij poniższe obserwacje. w tym celu wybierz i podkreśl odpowiednie sformułowanie w każ-
dym nawiasie.
Wskazanie wagi, na której znajdował się sód, ( wzrosło , zmalało , nie uległo zmianie ).
Wskazanie wagi, na której znajdował się jod, ( wzrosło , zmalało , nie uległo zmianie ).
b) odwołując się do swojej wiedzy na temat właściwości użytych w doświadczeniu pierwiastków,
podaj uzasadnienie poczynionych obserwacji.
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
3
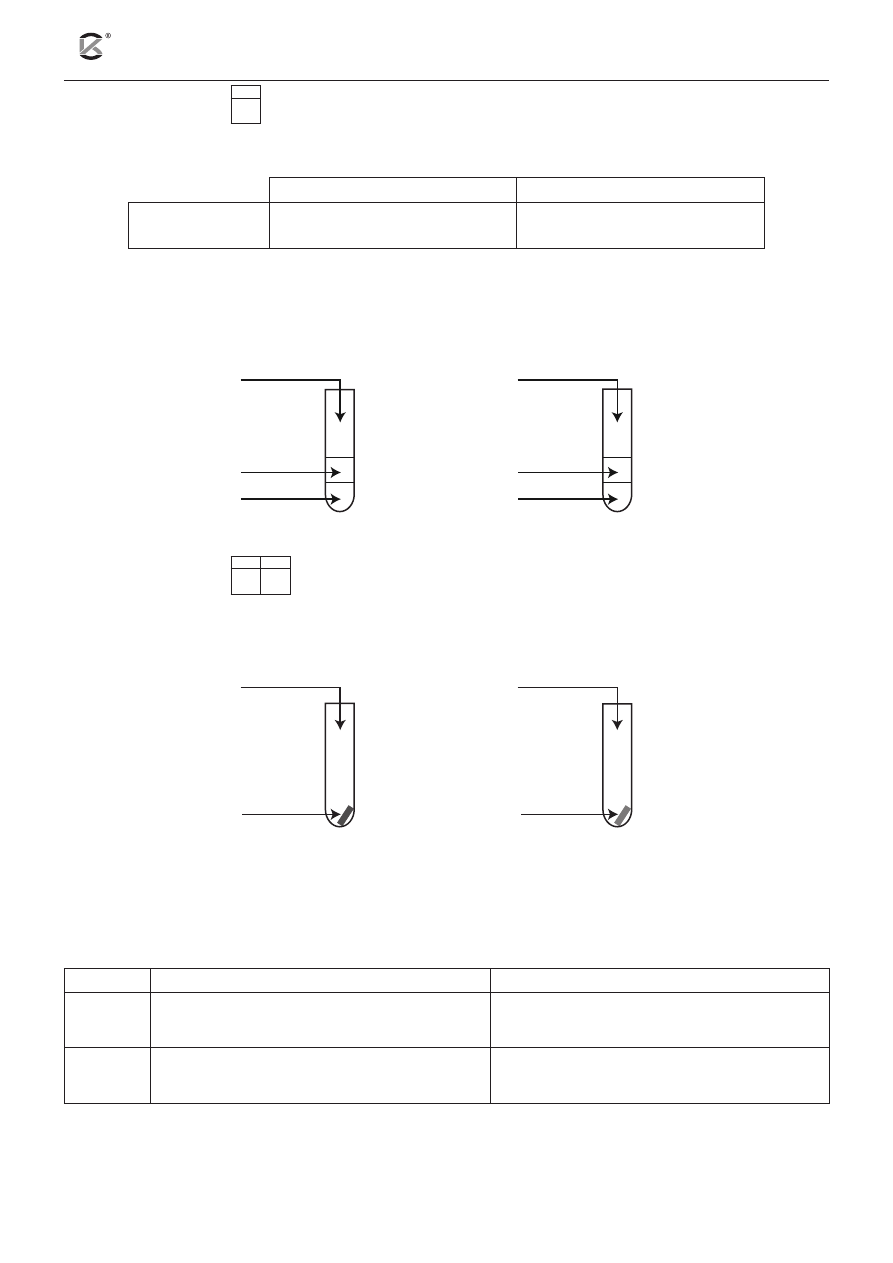
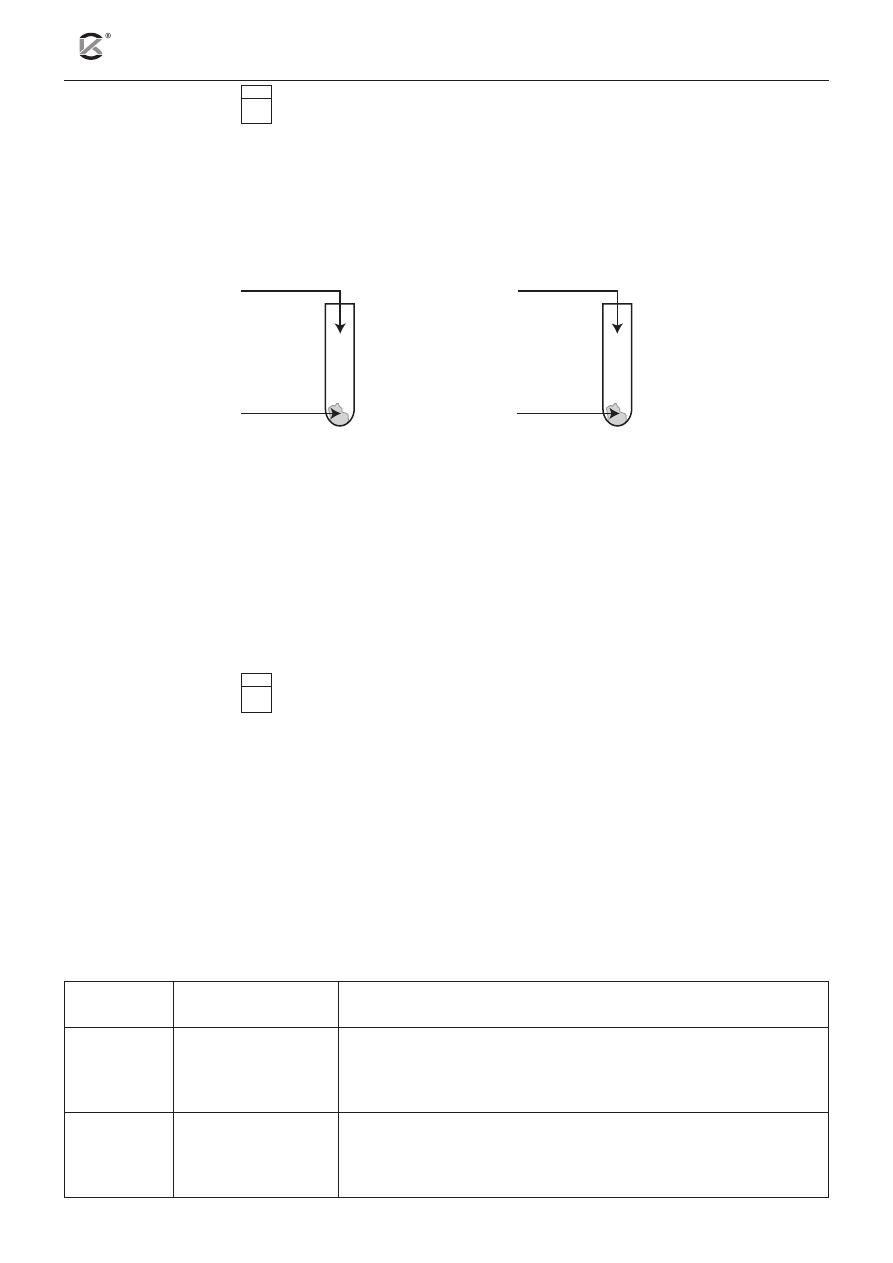
Zadanie 7. (1 pkt)
7.1
Przeprowadzono doświadczenie, którego celem było porównanie aktywności fluorowców. Obserwacje za-
notowano w tabeli.
Probówka 1
Probówka 2
Obserwacje
Warstwa organiczna przyjmuje
różowofioletowe zabarwienie.
Warstwa organiczna przyjmuje
żółtobrunatne zabarwienie.
na podstawie podanych obserwacji uzupełnij schemat doświadczenia. w tym celu wybierz i podkreśl
na schemacie oznaczenia literowe odpowiednich odczynników.
Lista odczynników: A. KCl
(aq)
B. KI
(aq)
C. Br
2(aq)
D. I
2(aq)
C / D
C / D
A / B
1.
2.
A / B
CHCl
3
CHCl
3
Zadanie 8. (3 pkt)
8.1 8.2
Do dwóch probówek wrzucono po małym kawałku żelaza i srebra. Następnie do każdej probówki wlano
odpowiedni kwas, co zilustrowano na poniższym schemacie:
1.
2.
Fe
Ag
HCl
(stęż.)
H
2
SO
4(stęż.)
W obu próbach zaobserwowano wydzielanie się bezbarwnych gazów.
a) Uzupełnij poniższą tabelę. opisz krótko sposób, w jaki zidentyfikujesz wydzielające się gazy. Po-
daj zapis procesu lub równanie reakcji, wykorzystanych do identyfikacji otrzymanych gazów.
Probówka Sposób identyfikacji wydzielającego się gazu
Równanie reakcji/zapis procesu
1
2
b) określ barwy roztworów, jakie powstały po zakończeniu doświadczenia.
Probówka 1: ................................................................
Probówka 2: ...............................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
4
Informacja do zadań 9–10
Aby zbadać charakter chemiczny tlenku manganu(II), do trzech probówek wprowadzono substraty zgodnie
z podanym niżej wykazem:
Probówka 1: MnO
(s)
+ H
2
O
Probówka 2: MnO
(s)
+ HCl
(aq)
Probówka 3: MnO
(s)
+ NaOH
(aq)
Zadanie 9. (1 pkt)
9.1
Uzupełnij poniższą tabelę. dla każdej probówki zapisz równanie zachodzącej reakcji (w formie jono-
wej skróconej) lub zaznacz, że reakcja nie zachodzi. określ charakter chemiczny badanego tlenku.
Probówka 1
Probówka 2
Probówka 3
Charakter chemiczny tlenku manganu(II): kwasowy / amfoteryczny / zasadowy / obojętny.
Zadanie 10. (3 pkt)
10.1 10.2
Po zakończeniu doświadczenia w probówce oznaczonej numerem 2 za pomocą bagietki pobrano kroplę
otrzymanego roztworu i naniesiono ją na uniwersalny papierek wskaźnikowy. Następnie do probówki do-
dano roztwór wodorotlenku sodu, po czym pozostawiono ją w pracowni laboratoryjnej na kilka godzin.
a) określ barwę, jaką przyjmie wskaźnik. Podaj równanie procesu (w formie jonowej skróconej)
odpowiedzialnego za poczynioną obserwację.
Barwa wskaźnika: ................................................................
Uzasadnienie obserwacji: ..............................................................................................................................
b) Uzupełnij poniższą tabelę. napisz, jakie zmiany zaobserwowano bezpośrednio po dodaniu roztwo-
ru wodorotlenku sodu i po upływie kilku godzin. zapisz równania zachodzących reakcji w formie
cząsteczkowej.
Obserwacja
Równanie reakcji
Bezpośrednio
po dodaniu
NaOH
(aq)
Po upływie
kilku godzin
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
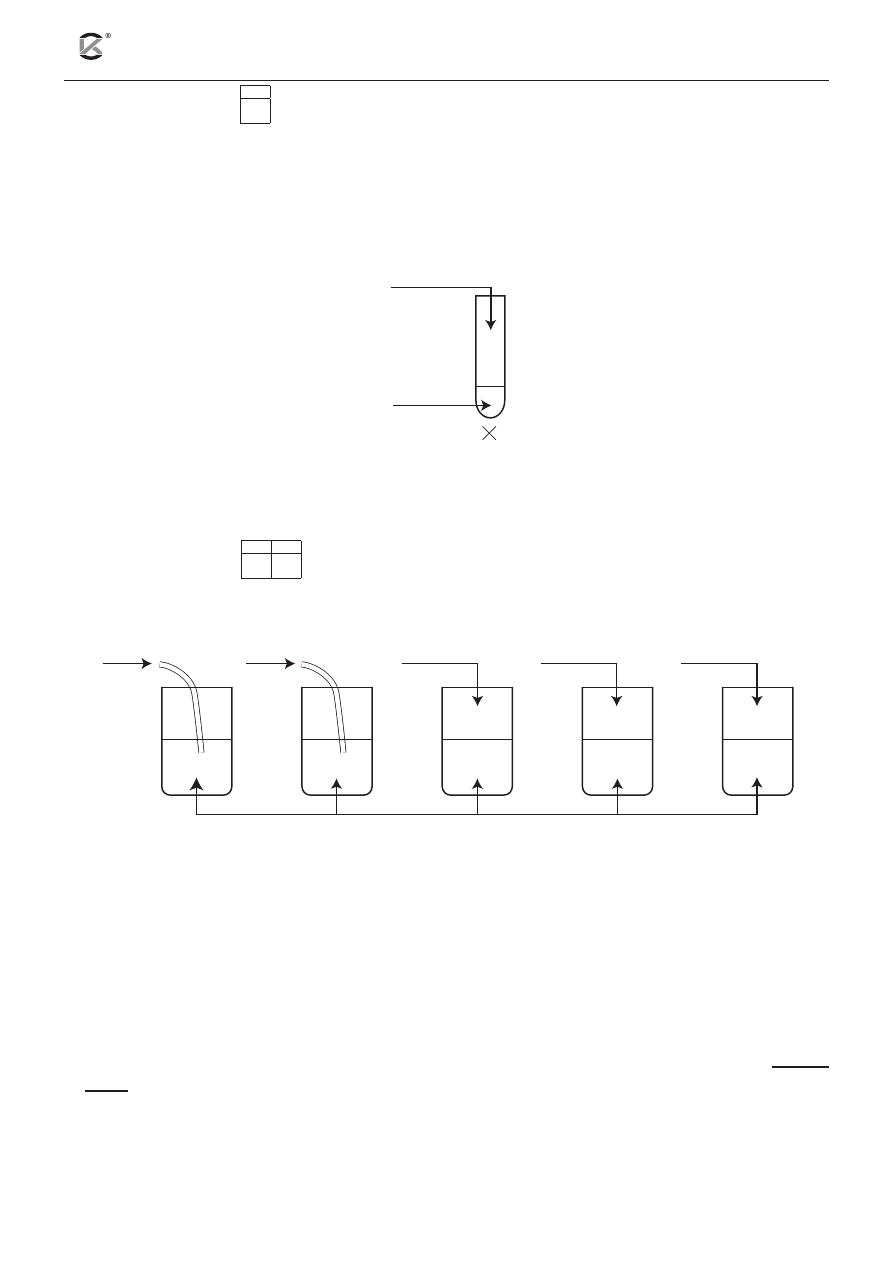
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
5
Zadanie 11. (1 pkt)
11.1
Tematem doświadczenia było wykazanie redukujących właściwości jonów chromu na III stopniu utlenienia.
Podczas ogrzewania zaobserwowano, że zawartość probówki zmienia barwę z zielonej na żółtą.
Uzupełnij schemat doświadczenia. w tym celu uwzględnij środowisko reakcji, wpisując w wolne
miejsce wzór odpowiedniego jonu lub cząsteczki (H
+
, oH
–
lub H
2
o).
Podaj nazwę jonów, w postaci jakich występuje chrom po zakończeniu doświadczenia.
Cr
3+
H
2
O
2
, ..........
Nazwa jonów: ..............................................................................................
Zadanie 12. (2 pkt)
12.1 12.2
Przeprowadzono doświadczenie zilustrowane poniższym schematem:
1.
2.
3.
4.
5.
roztwór Br
2
w CCl
4
kwas
oleinowy
toluen
benzen
eten
etan
a) Podaj numer lub numery zlewek, w których dodawany odczynnik spowoduje szybkie odbarwienie
roztworu bromu. określ typ reakcji i podaj, według jakiego mechanizmu ona zachodzi. w tym
celu podkreśl odpowiednie nazwy.
Numer / numery zlewek: .............................................
Typ reakcji: substytucja / addycja
Mechanizm: nukleofilowy / elektrofilowy / wolnorodnikowy
b) Podaj numer lub numery zlewek, w których roztwór bromu ulega odbarwieniu dopiero po naświe-
tleniu mieszaniny reakcyjnej. określ typ reakcji i podaj, według jakiego mechanizmu ona zachodzi.
w tym celu podkreśl odpowiednie nazwy.
Numer / numery zlewek: .............................................
Typ reakcji: substytucja / addycja
Mechanizm: nukleofilowy / elektrofilowy / wolnorodnikowy
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
6
Zadanie 13. (2 pkt)
13.1
Poniżej podano nazwy pochodnych węglowodorów, których cząsteczki zawierają co najmniej jedną grupę
hydroksylową:
A. etanol
B. glikol etylenowy
C. fenol
D. glukoza
E. kwas 2-hydroksypropanowy
Spośród podanych wyżej substancji wybierz wszystkie, które spełniają podane w tabeli warunki.
wpisz przypisane im oznaczenia literowe w odpowiednie miejsca.
Charakterystyka
Oznaczenie literowe związku
spełniającego warunek
Wodny roztwór tej substancji przewodzi prąd elektryczny.
Wodny roztwór tej substancji wykazuje odczyn obojętny.
Po dodaniu zawiesiny Cu(OH)
2
do roztworu tej substancji
i wymieszaniu powstaje klarowny, szafirowy roztwór.
Po dodaniu zawiesiny Cu(OH)
2
do roztworu tej substancji i ogrzaniu
powstaje pomarańczowoczerwony osad.
Reaguje z zasadą sodową.
Zadanie 14. (1 pkt)
14.1
Celem doświadczenia było porównanie właściwości chemicznych monohydroksylowych alkoholi zawiera-
jących cztery atomy węgla w cząsteczce. Obserwacje dla wykonanych prób zestawiono w poniższej tabeli.
Badane alkohole
Opis przeprowadzonej próby
Alkohol 1
Alkohol 2
Alkohol 3
Rozgrzany w płomieniu palnika drut
miedziany pokryty warstwą czarnego
tlenku miedzi(II) wprowadzono
do probówki z badanym alkoholem.
Nie widać zmian. Czarny osad znika. Czarny osad znika.
Do otrzymanych w poprzedniej próbie
roztworów dodano odczynnik Tollensa
[Ag(NH
3
)
2
]OH.
Zawartość probówek ogrzano.
–
Na ściankach
probówki pojawia
się lśniący nalot.
Nie widać zmian.
Podaj wzory półstrukturalne (grupowe) alkoholi, które stanowiły substraty w przeprowadzonych
próbach.
Alkohol nr 1: ...................................................
Alkohol nr 2: ...................................................
Alkohol nr 3: ...................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
7
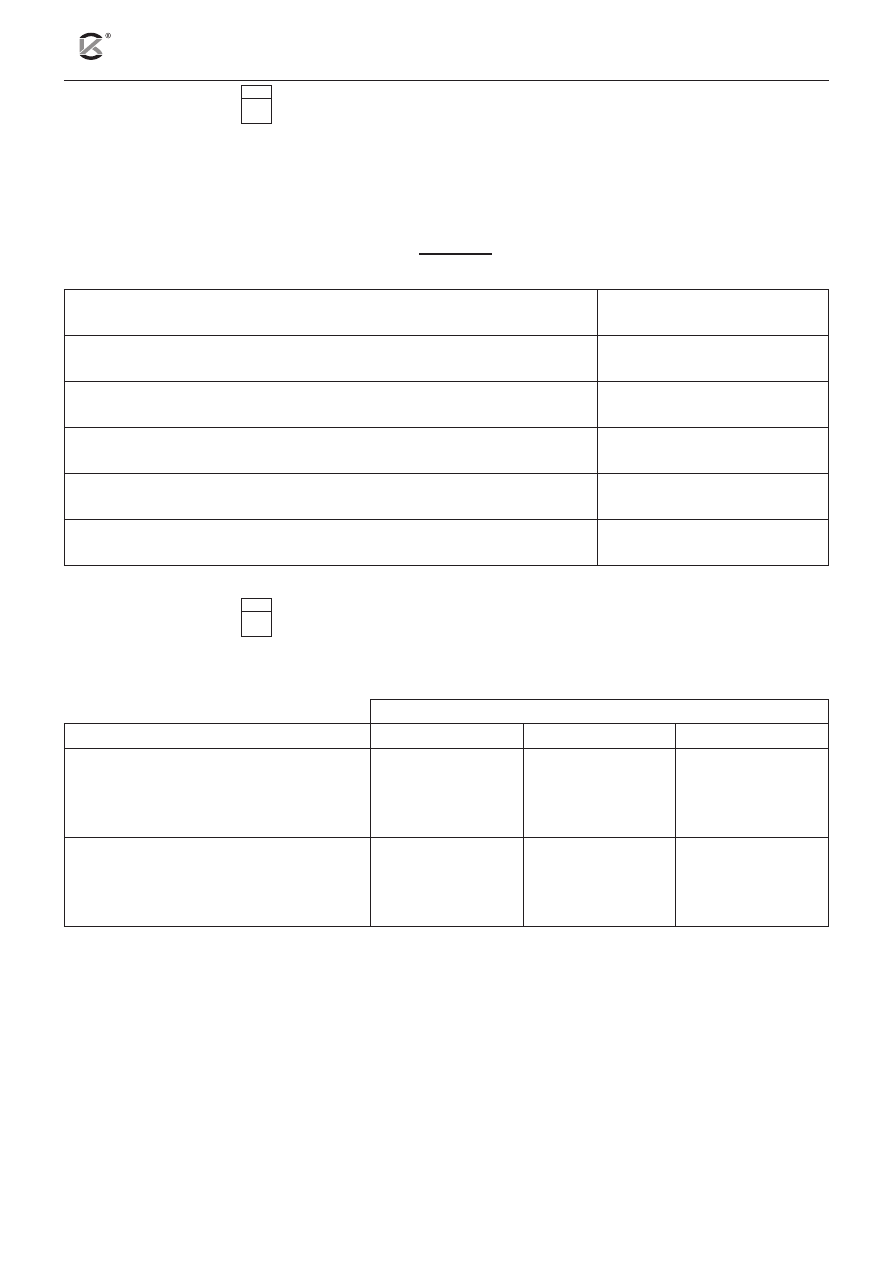
Zadanie 15. (1 pkt)
15.1
W dwóch probówkach umieszczono kawałek marmuru, którego głównym składnikiem jest węglan wapnia.
Następnie do pierwszej probówki wlano roztwór kwasu mrówkowego (K
HCOOH
= 1,8 ∙10
–4
), a do drugiej roz-
twór kwasu octowego (K
CH
3
COOH
= 1,8 ∙ 10
–5
) o tym samym stężeniu równym 1 mol ∙ dm
–3
. Doświadczenie
zilustrowano na poniższym schemacie.
K
1 H
2
CO
3
= 4,5 ∙ 10
–7
1.
2.
marmur
marmur
HCOOH
(aq)
CH
3
COOH
(aq)
opisz zmiany, jakie można zaobserwować podczas przebiegu doświadczenia. zwróć uwagę na różnicę
w przebiegu obu procesów, która mogłaby stanowić podstawę rozróżnienia badanych kwasów.
Obserwacje: ...................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
Zadanie 16. (2 pkt)
16.1
Pewien organiczny wskaźnik kwasowo-zasadowy o wzorze ogólnym HR ma charakter słabego kwasu.
W roztworze wodnym pomiędzy formą niezdysocjowaną a formą zdysocjowaną tego kwasu ustala się stan
równowagi, co ilustruje poniższy zapis:
HR →
← H
+
+ R
–
Jeśli w roztworze przeważa forma niezdysocjowana HR, to roztwór jest bezbarwny, jeśli zaś przeważa for-
ma zdysocjowana R
–
– roztwór ma barwę żółtą.
Przeprowadzono doświadczenie, w którym dodano po kilka kropli roztworu wskaźnika HR do zlewki
z wodnym roztworem chlorowodoru i zlewki z wodnym roztworem wodorotlenku sodu.
Uzupełnij poniższą tabelę. wybierz i podkreśl barwę, jaką przyjmie wskaźnik w badanych roztwo-
rach. Swoją odpowiedź uzasadnij, odwołując się do reguły przekory.
Zlewka
z roztworem
Barwa wskaźnika
Uzasadnienie
HCl
bezbarwny / żółty
NaOH
bezbarwny / żółty
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
8
Zadanie 17. (1 pkt)
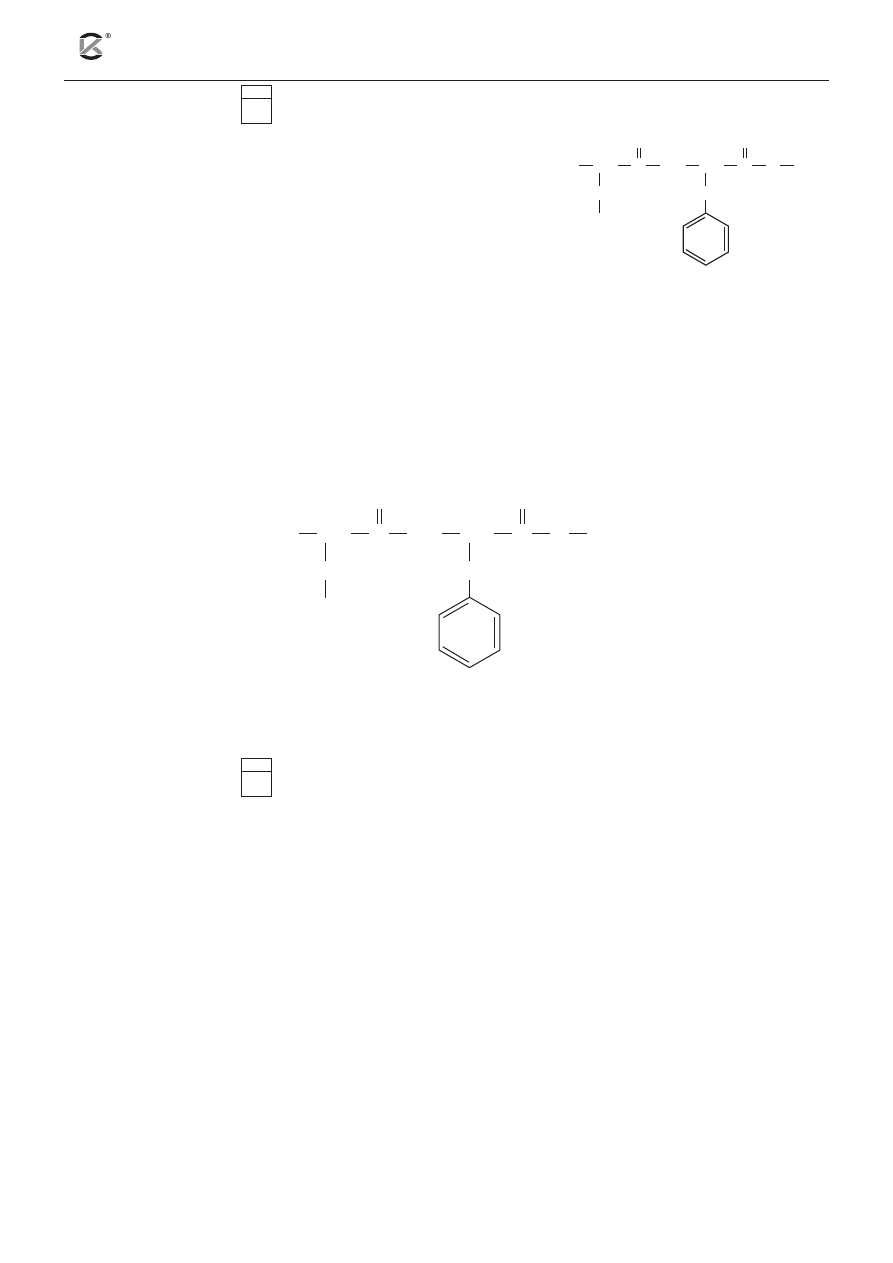
17.1
Na rysunku obok przedstawiono wzór półstrukturalny (grupowy)
aspartamu – syntetycznego związku używanego jako słodzik.
W probówce sporządzono wodny roztwór aspartamu. Następnie
dodano do niego odczynnik X i całość wymieszano. Zaobserwo-
wano, że zawartość probówki przyjęła różowofioletowe zabar-
wienie.
z podanej niżej listy wybierz i podkreśl nazwę odczynnika, którego użyto w doświadczeniu (odczynnik X).
następnie w podanym niżej wzorze półstrukturalnym (grupowym) cząsteczki aspartamu zaznacz frag-
ment odpowiedzialny za obserwowane zmiany.
woda bromowa
świeżo strącony wodorotlenek miedzi(II)
wodny roztwór chlorku żelaza(III)
H
2
N
O CH
3
CH
COOH
CH
2
NH
C
O
CH
CH
2
C
O
Zadanie 18. (1 pkt)
18.1
Podczas prowadzonej przy użyciu elektrod grafitowych elektrolizy wodnego roztworu pewnej substancji
stwierdzono, że:
• na obu elektrodach wydzielały się gazy (w stosunku objętościowym 1 : 2),
• po wymieszaniu roztworów z przestrzeni katodowej i anodowej pH roztworu wzrosło.
wybierz i podkreśl wzór tej substancji, której wodny roztwór poddano procesowi elektrolizy.
H
2
SO
4
KOH
AgNO
3
KNO
3
NaCl
H
2
N
O
CH
COOH
CH
2
NH
C
O
CH
CH
2
C
O
CH
3
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
9
Zadanie 19. (2 pkt)
19.1 19.2
Zaprojektowano ogniwo złożone z dwóch półogniw metalicznych, w którym:
• nikiel pełni funkcję elektrody dodatniej,
• siła elektromotoryczna ogniwa w warunkach standardowych wynosi 1,43 V (stężenia odpowiednich
jonów wynoszą 1 mol ∙ dm
–3
).
a) na podstawie odpowiednich obliczeń ustal, jaka elektroda pełni funkcję elektrody ujemnej. zapisz
schemat tego ogniwa.
Obliczenia:
Schemat ogniwa: ................................................................
b) Uzupełnij obserwacje. w tym celu wybierz i pokreśl odpowiednie sformułowania w każdym na-
wiasie.
1. Podczas pracy tego ogniwa:
a) masa elektrody dodatniej ( rośnie , maleje nie ulega zmianie ).
b) masa elektrody ujemnej ( rośnie , maleje , nie ulega zmianie ).
2. Podczas pracy tego ogniwa:
a) w półogniwie dodatnim barwa roztworu ( staje się bardziej intensywna , staje się mniej intensywna ,
nie ulega zmianie ).
b) w półogniwie ujemnym barwa roztworu ( staje się bardziej intensywna , staje się mniej intensywna ,
nie ulega zmianie ).
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Wyszukiwarka
Podobne podstrony:
doswiadczenia arkusz rs 6 1392900606
doswiadczenia arkusz rs 6 1392900606
obliczenia arkusz rs 5 1392900864
doswiadczenia model rs 6 1392900786
nieorganiczna 2 arkusz rs 2 1392901336
organiczna 2 arkusz rs 4 1392901126
obliczenia arkusz rs 5 1392900864
doswiadczenia model rs 6 1392900786
nieorganiczna 2 arkusz rs 2 1392901336
doswiadczenia model rs 6 1392900786
obliczenia arkusz rs 5 1392900864
organiczna 2 arkusz rs 4 1392901126
obliczenia model rs 5 1392900934
organiczna 2 model rs 4 1392901170
organiczna 1 model rs 3 1392901271
nieorganiczna 2 model rs 2 1392901381
obliczenia model rs 5 1392900934
więcej podobnych podstron