
Związki karbonylowe
Aldehydy i ketony
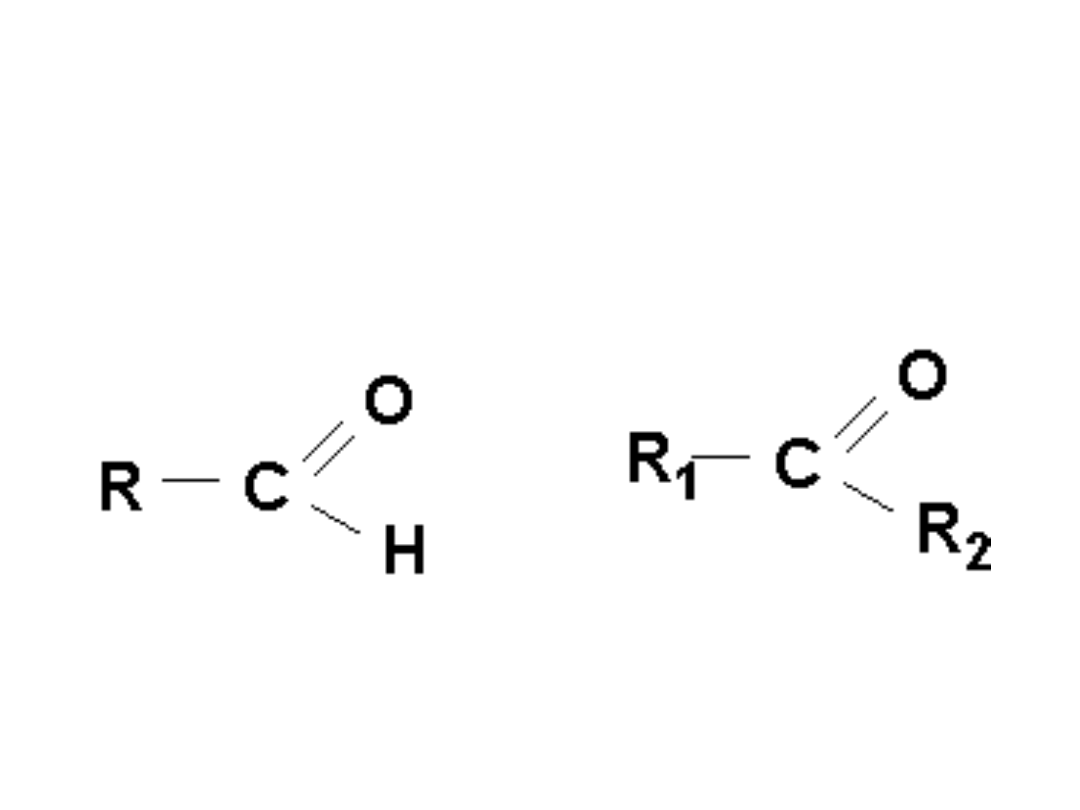
Budowa
aldehyd
keton
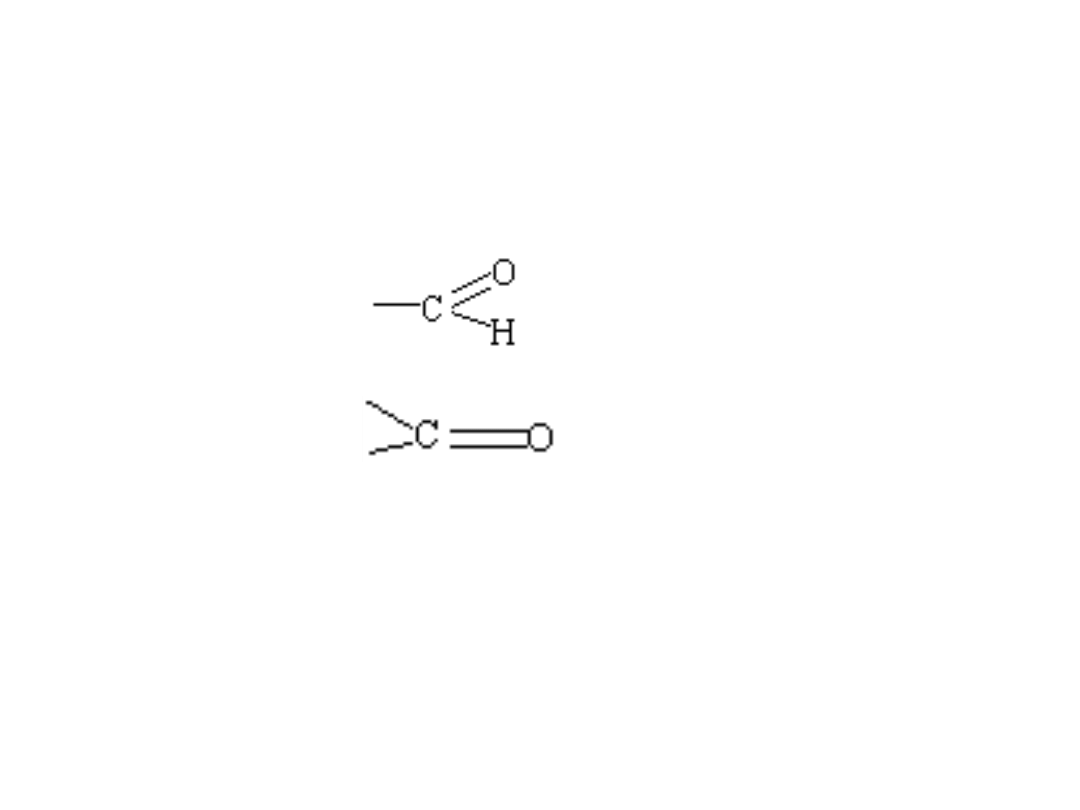
Nazewnictwo
Według zasad słownictwa systematycznego IUPAC
grupy aldehydowe
oznacza się końcówką -al,
a grupy ketonowe
końcówką -on.

Nazewnictwo
Tworząc nazwę aldehydu wybieramy najdłuższy łańcuch
w cząsteczce zawierający grupę aldehydową -CHO.
Łańcuch ten numerujemy rozpoczynając od grupy aldehydowej.
Położenia oraz rodzaj podstwników zaznaczamy w zwykły sposób.
Tworząc nazwę ketonu wybieramy najdłuższy łańcuch węglowy
zawierający grupę karbonylową.
Jej położenie w łańcuchu określa liczba dana na początku nazwy.
W przypadku ketonów zawierających dwie lub trzy grupy
karbonylowe stosujemy końcówkę dion lub trion i za pomocą
dwu lub trzech cyfr określamy położenie tych grup.
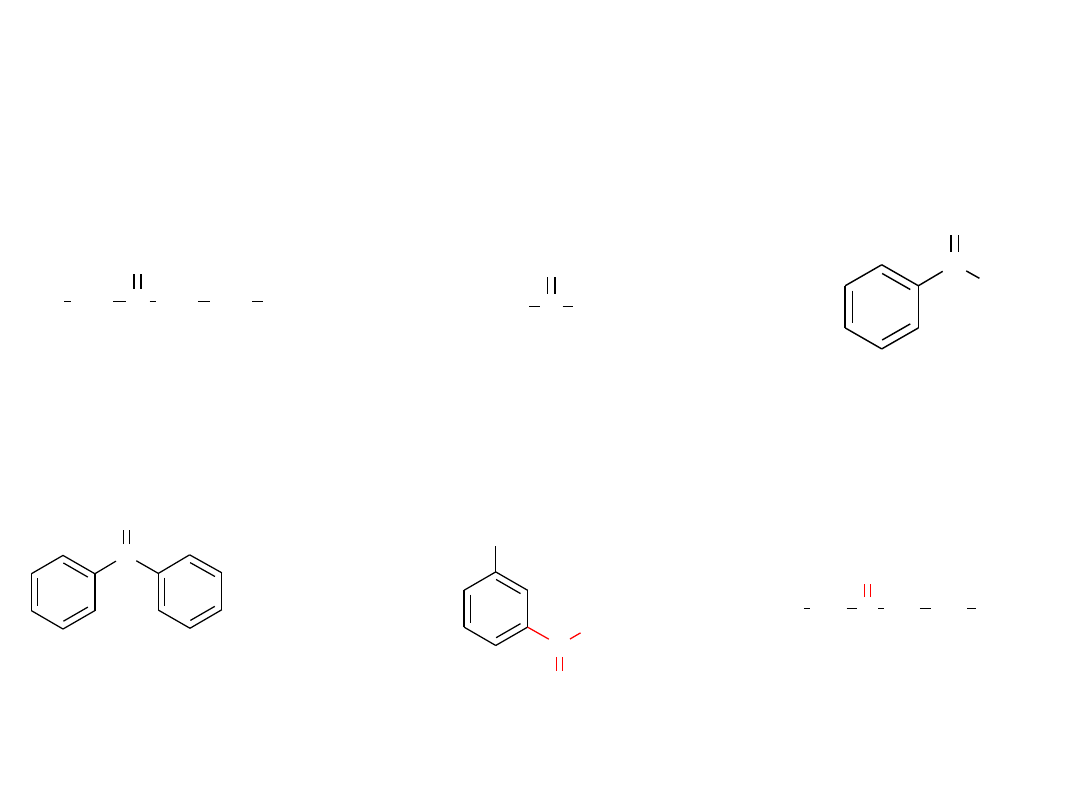
Przykłady
CH
3
CH
2
C CH
2
CH
2
CH
3
O
CH
3
C
O
CH
3
C
CH
3
O
C
O
COOH
C
O
CH
3
CH
3
CH
2
C CH
2
CH
2
O
COOH
heksan-3-on
propanon
aceton
acetofenon
benzofenon
kwas m-acetylobenzoesowy
kwas 4-oksoheksanowy
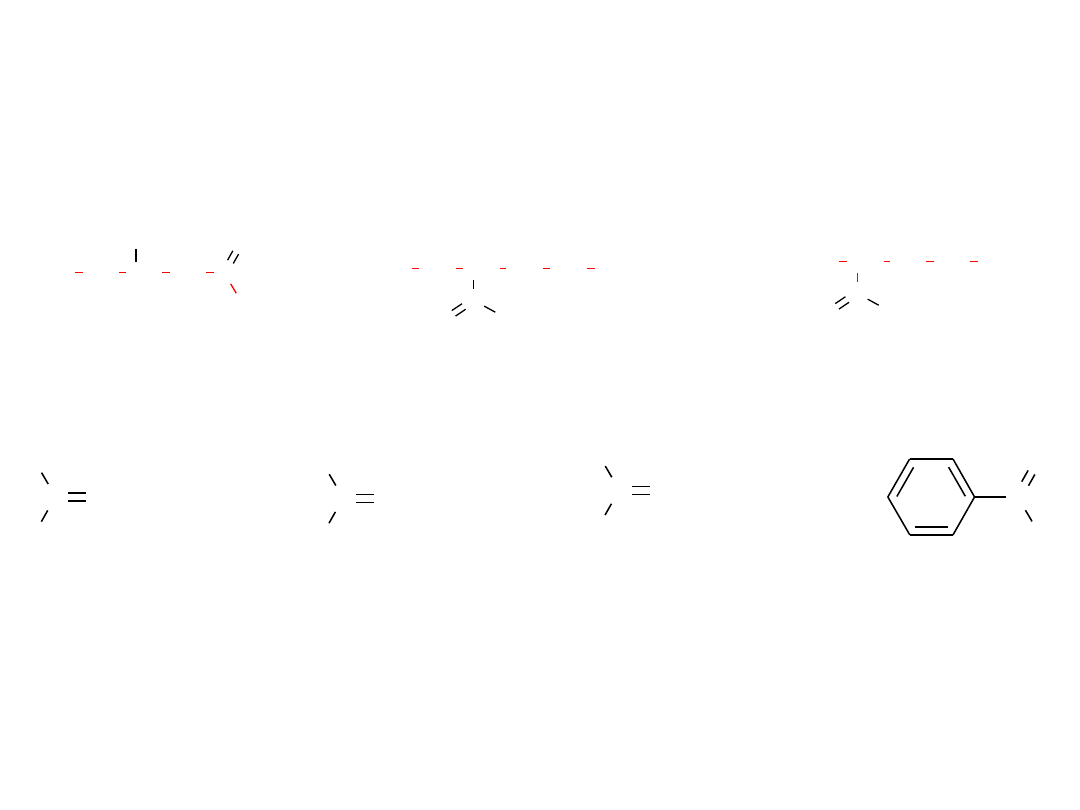
Przykłady
CH
3
CH
2
CH CH
2
C
H
O
OH
CH
3
CH
2
CH CH
2
CH
2
C
O
H
COOH
CH
3
CH CH
2
CH
2
C
O
H
COOH
3-hydroksypentanal
kwas 4-formyloheksanowy kwas 4-metylo-5-oksopentanowy
C O
H
H
C O
C
H
3
H
C O
C
2
H
5
H
C
O
H
Metanal
Formaldehyd
Aldehyd mrówkowy
Etanal
Acetaldehyd
Aldehyd octowy
Propanal
Propionaldehyd
Aldehyd propionowy
Benzenokarboaldychyd
Benzaldehyd
Aldehyd benzoesowy

Właściwości fizyczne
• Wysokie momenty dipolowe 2,3-2,8 D,
wynikające z polarności wiązania C=O
• Stosunkowo wysokie temperatury wrzenia,
będące konsekwencją wysokiej polarności
wiązania C=O
• Rozpuszczalność w wodzie zależy od
wielkości łańcucha hydrofobowego
• Brak wiązań wodorowych zwiększa
lotność aldehydów i ketonów.
Właściwości chemiczne
C
C
O
C
H
H
H
H
R
H
H
H
C
-
OH
-
Nu
+
E
R C
H
H
C
H
O
+
E
-
Nu
-
OH
:
:
utleniacz
CH
3
CH
2
CH
2
C
O
R
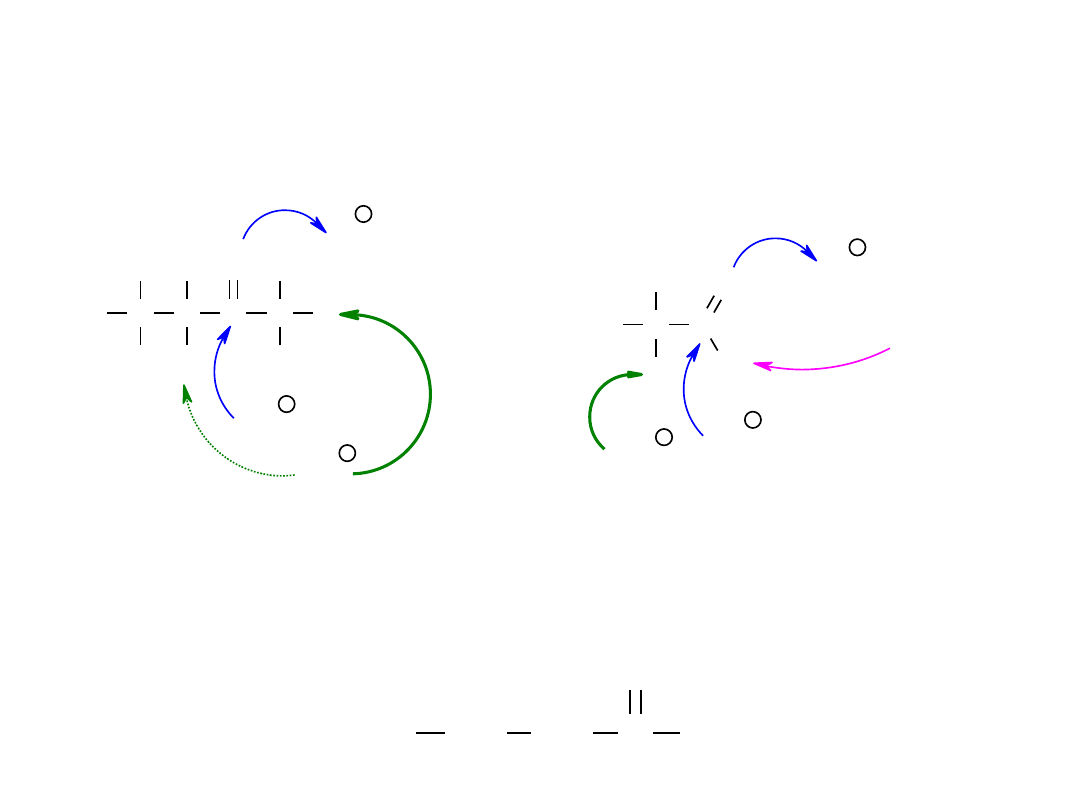
Oznaczanie
atomów węgla i wodoru w zależności od
odległości od grupy funkcyjnej:
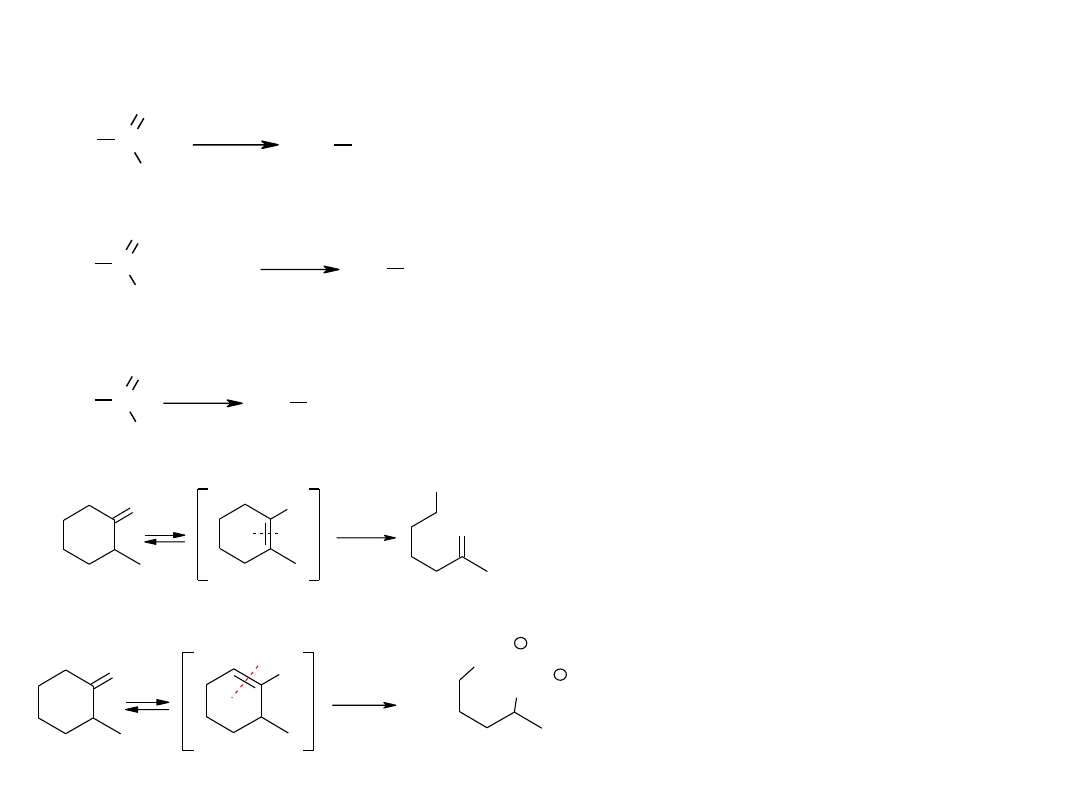
Reakcje związków karbonylowych –
reakcje utlenienia i redukcji
R
C
H
O
R
COOH
[O]
R
C
H
O
R
COO
-
+ 2Ag
+ Ag
2
O
R
C
H
O
R
COO
-
Cu(OH)
2
+Cu
2
O + 2H
2
O
O
H
+
OH
KMnO
4
O
COOH
Utlenianie aldehydów zachodzi bardzo łatwo.
[O]= K
2
Cr
2
O
7
/H
+
; KMnO
4
/H
+
lub OH
-
; Br
2
Reakcje: Tollensa oraz Fehlinga
służą do odróżnienia aldehydów od ketonów
Utlenianie ketonów w środowisku
kwaśnym zachodzi tylko wobec
energicznych środków utleniających
(drastyczne warunki). W tych warunkach
powstaje enol trwalszy termodynamicznie,
który ulega utlenieniu.
W środowisku alkalicznym utlenianie
ketonów zachodzi dość łatwo
O
OH
COO
COO
-
-
OH
-
KMnO
4
O
H
2
/Pt
OH
O
LiAlH
4
/eter
lub NaBH
4
/H
2
O
OH
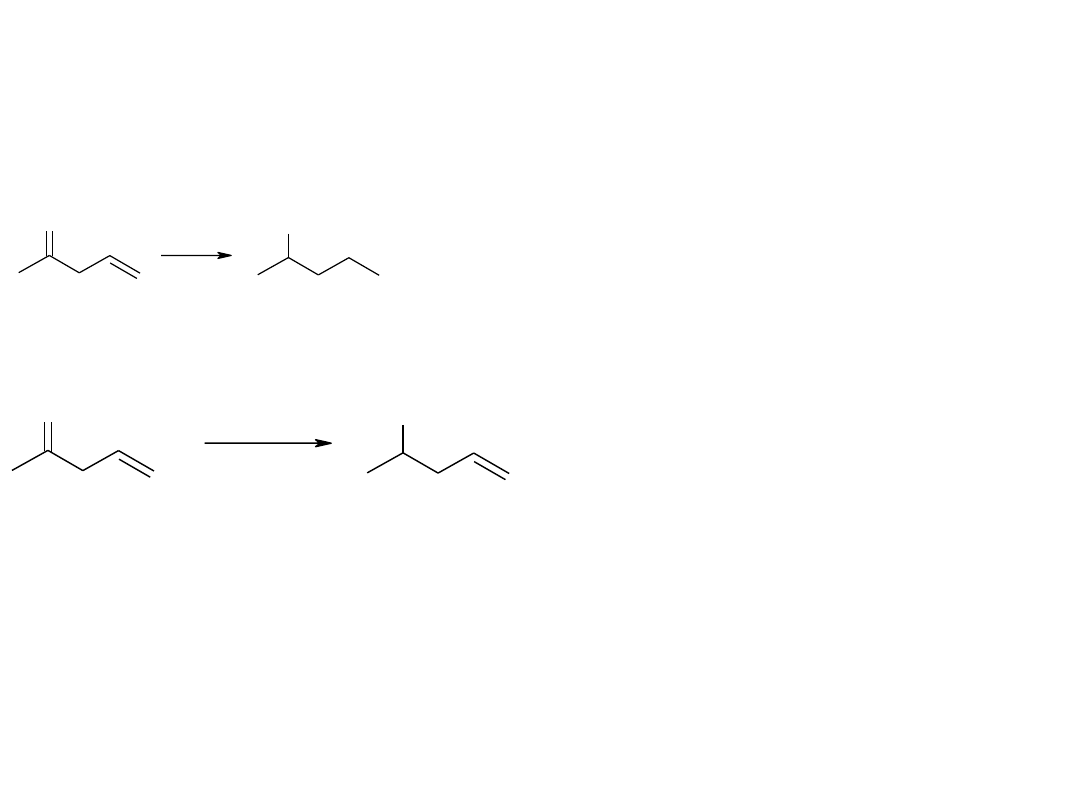
Grupa karbonylowa, wodorem na platynie, ulega
trudniej redukcji od wiązania podwójnego C=C
Redukcję grupy karbonylowej bez
naruszenia wiązań C=C można
przeprowadzić glinowodorkiem litu (LAH)
lub borowodorkiem sodu.
Reakcje związków karbonylowych –
reakcje utlenienia i redukcji
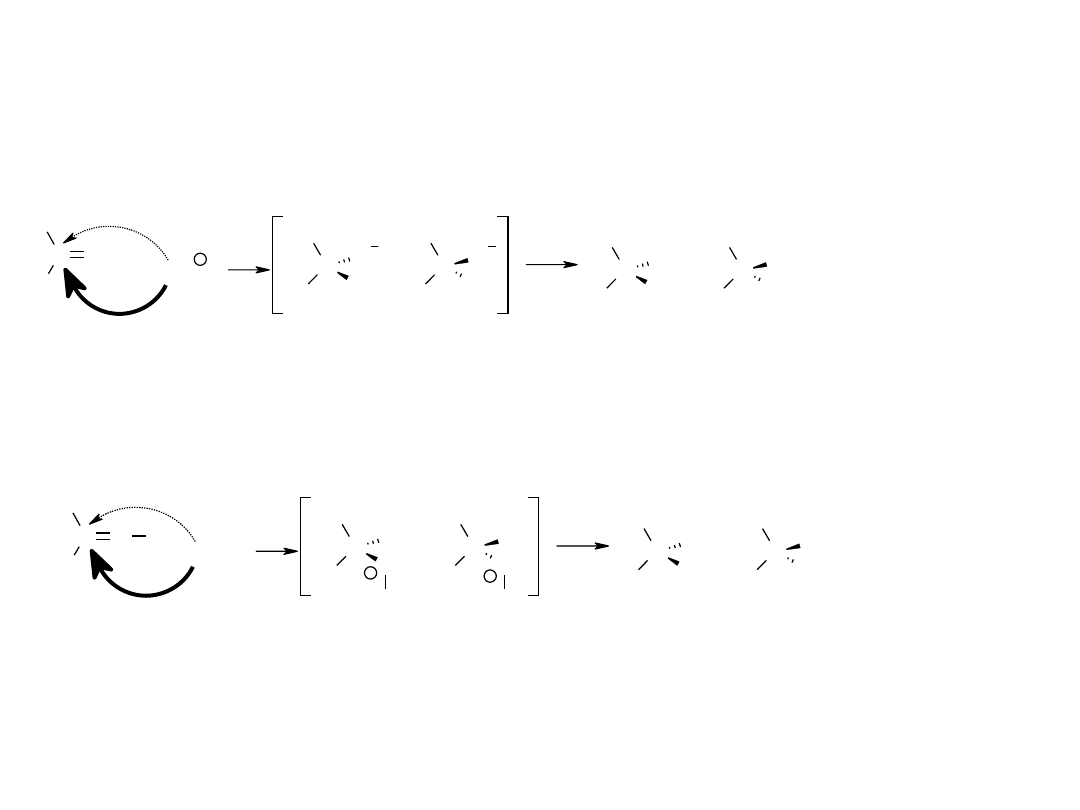
Reakcje związków karbonylowych –
reakcje nukleofilowej addycji do grupy karbonylowej
-
O
C
R'
R"
C
R'
R"
O
Nu
C
R'
R"
O
Nu
C
R'
R"
OH
Nu
C
R'
R"
OH
Nu
+ :Nu
+
+
H
2
O
-OH
-
O
+
C
R'
R"
H
C
R'
R"
OH
Nu
H
C
R'
R"
OH
Nu
H
C
R'
R"
OH
Nu
C
R'
R"
OH
Nu
+
+
+ :Nu-H
+
+
-H
+
Powstaje para enancjomerów
Powstaje para enancjomerów
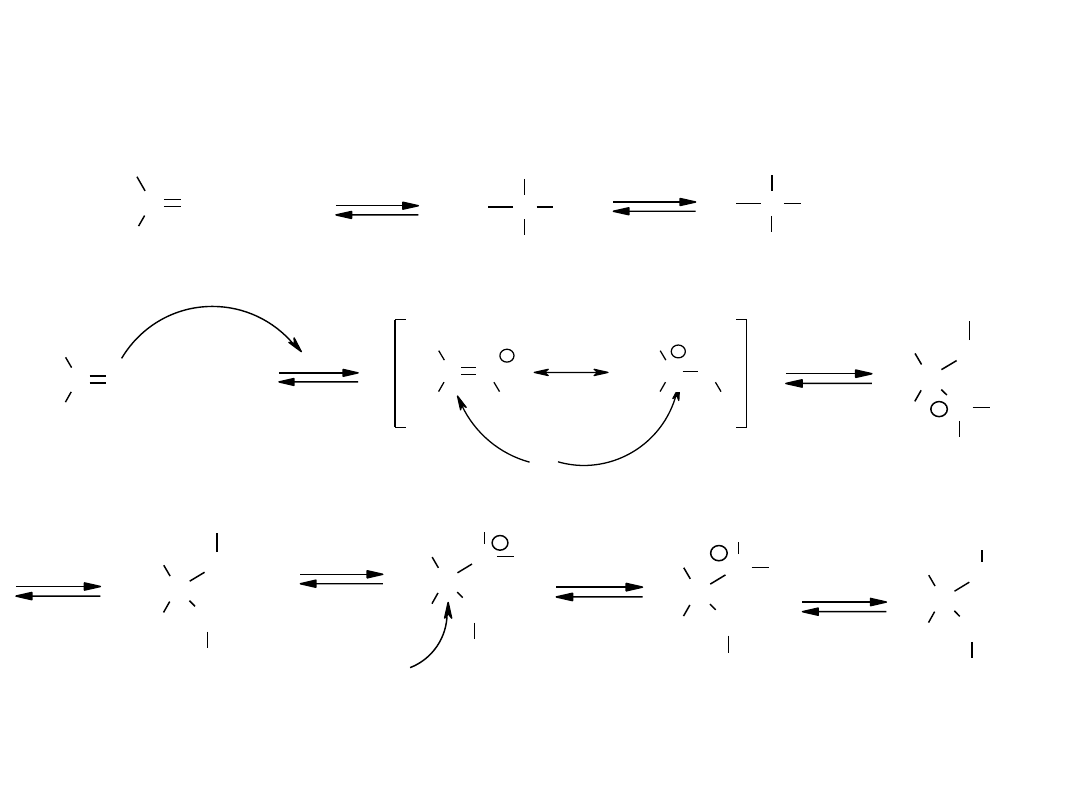
C
O
R'
R"
OH
C
R'
R"
OR
OR
C
R'
R"
OR
+ R-OH
H
+
lub OH
-
H
+
Reakcje związków karbonylowych –
reakcje nukleofilowej addycji do grupy karbonylowej
C O
C
H
3
H
+ C
2
H
5
-OH
H
+
..
..
C
O
C
H
3
H
H
C
O
C
H
3
H
H
+
+
..
..
:
R-OH
..
..
C
O
C
H
3
H
H
O H
C
2
H
5
+
..:
..
C
O
C
H
3
H
H
O
C
2
H
5
..:
..
:
-H
+
C
O
C
H
3
H
C
2
H
5
O
C
2
H
5
-H
+
..
..
:
:
C
O
C
H
3
H
H
O
C
2
H
5
H
+
H
+
..
..
:
R-OH
..
..
C
O
C
H
3
H
C
2
H
5
O
C
2
H
5
H
+
..
..
:
-H
2
O
hemiacetal
(hemiketal)
acetal
(ketal)
hemiacetal etylowy
acetaldehydu
acetal etylowy acetaldehydu
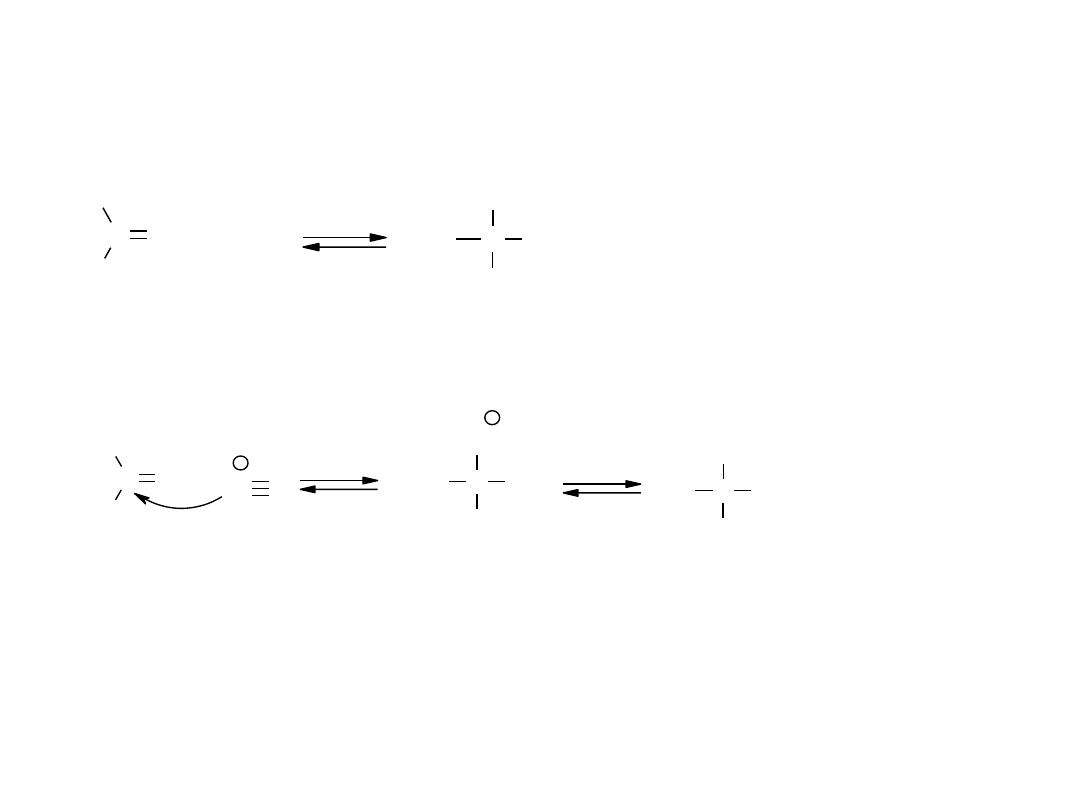
C O
R'
R"
OH
C
R'
R"
CN
+ CN
-
H
2
O/H
+
Reakcje związków karbonylowych –
reakcje nukleofilowej addycji do grupy karbonylowej
cyjanohydryna
C O
C
H
3
C
H
3
O
C
C
H
3
CH
3
CN
C N
-
-
OH
C
C
H
3
CH
3
CN
+
H
2
O/H
+
:
..
..
: :
H
2
O
-OH
-
..
:
Cyjanohydryna acetonu
(2-hydroksy-2-metylopropanonitryl
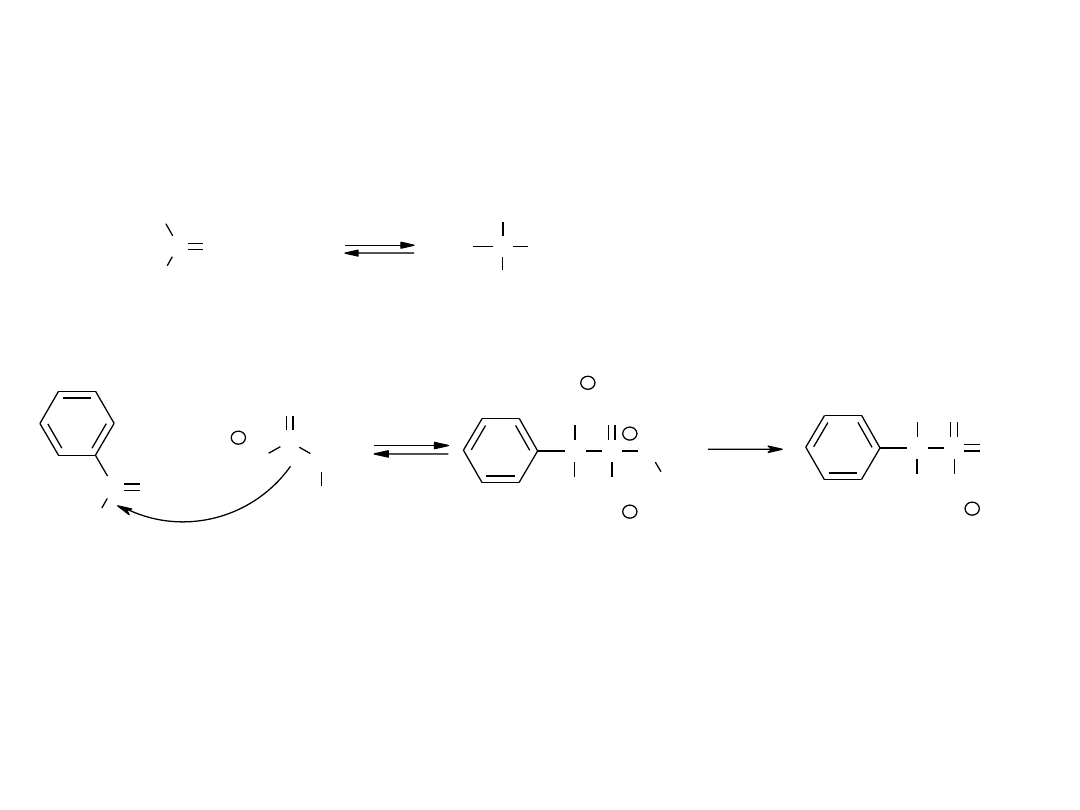
C
O
R'
R"
OH
C
R'
R"
SO
3
Na
+ NaHSO
3
C
O
H
O
C
S
H
O
O
O
H
O
S
O
O
H
Na
+
-
+
-
-
Na
+
OH
C
S
H
O
O
O
-
Na
+
+
:
..
..
..
..
: :
..
: :
..
: :
..
:
fenylohydroksysulfonian
sodu
Reakcje związków karbonylowych –
reakcje nukleofilowej addycji do grupy karbonylowej
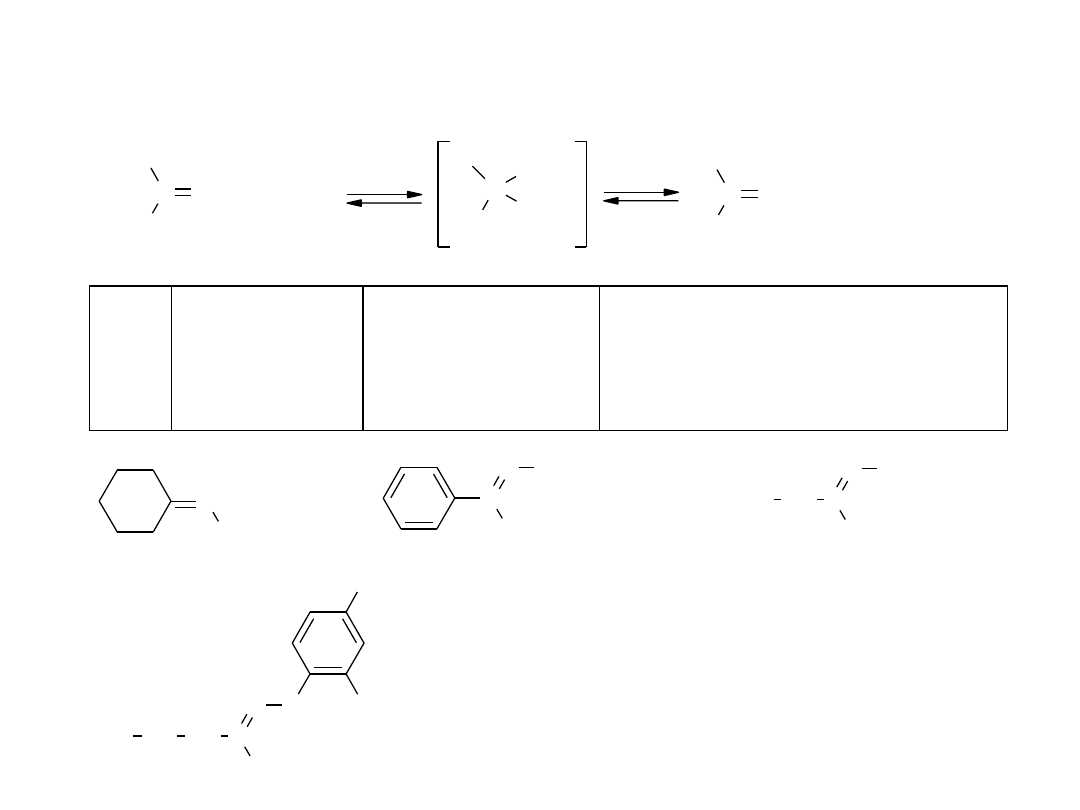
C O
R'
R"
C
R'
R"
OH
NH-Y
C N-Y
R'
R"
+ H
2
N-Y
H
+
-H
2
O
Reakcje związków karbonylowych –
reakcje nukleofilowej addycji do grupy karbonylowej
Y=:
OH
R
NH-Ph
hydroksyloamina
amina
fenylohydrazyna
oksym aldehydu (ketonu)
imina aldehydu (ketonu)
fenylohydrazon aldehydu (ketonu)
N
OH
C
H
N OH
CH
3
CH
2
C
N
CH
3
CH
3
CH
3
CH
2
CH
2
C
N N
H
H
NO
2
NO
2
oksym
cykloheksanonu
oksym benzaldehydu
metyloimina
butan-2-onu
2,4-dinitrofenylohydrazon butanalu
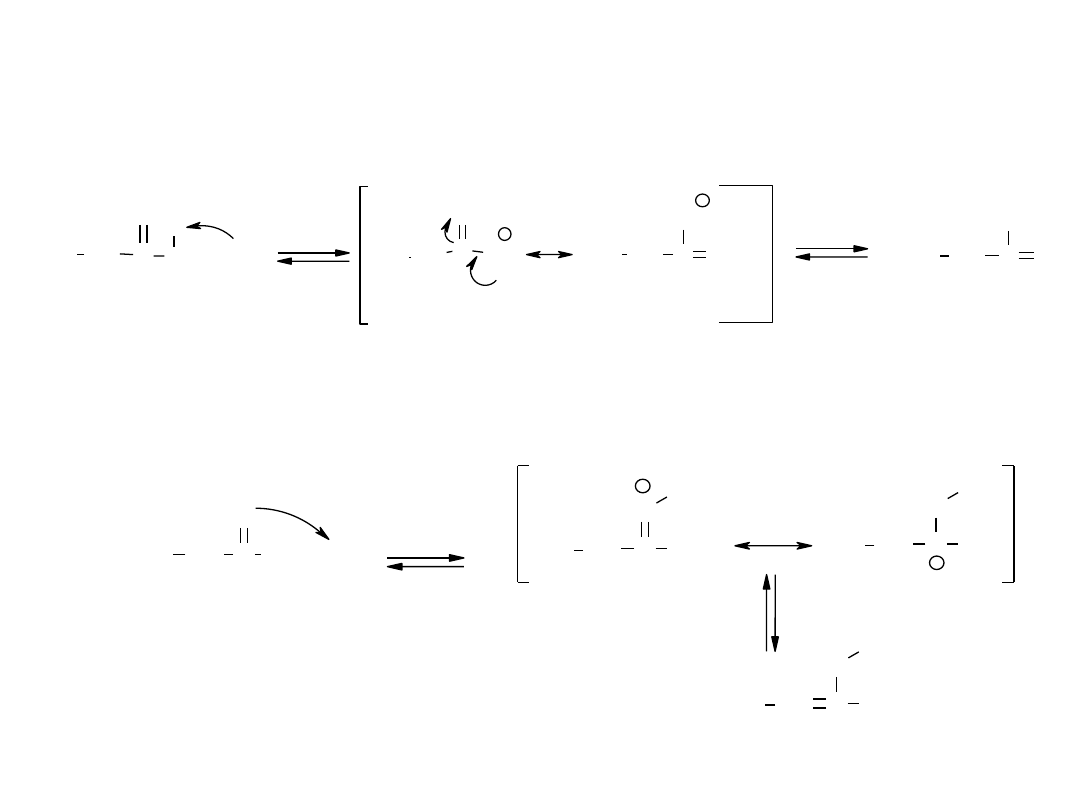
O
C
CH
2
CH
2
C
H
3
H
OH
C
CH
2
CH
2
C
H
3
O
C
CH
2
CH
2
C
H
3
O
C
CH
2
CH
2
C
H
3
-
-
+ OH
-
-H
2
O
H
2
O
..
:
..
: :
..
-OH
-
Najwolniejszym etapem reakcji jest reakcja
oderwania protonu od związku karbonylowego
Reakcje związków karbonylowych –
reakcje w środowisku alkalicznym i kwaśnym
but
en
-2-
ol
O
C
CH
2
CH
3
C
H
3
O
C
CH
2
CH
3
C
H
3
H
O
C
CH
2
CH
3
C
H
3
H
+
+
O
C
CH
CH
3
C
H
3
H
+ H
+
:
:
..
:
..
-H
+
but-2-
en
-2-
ol
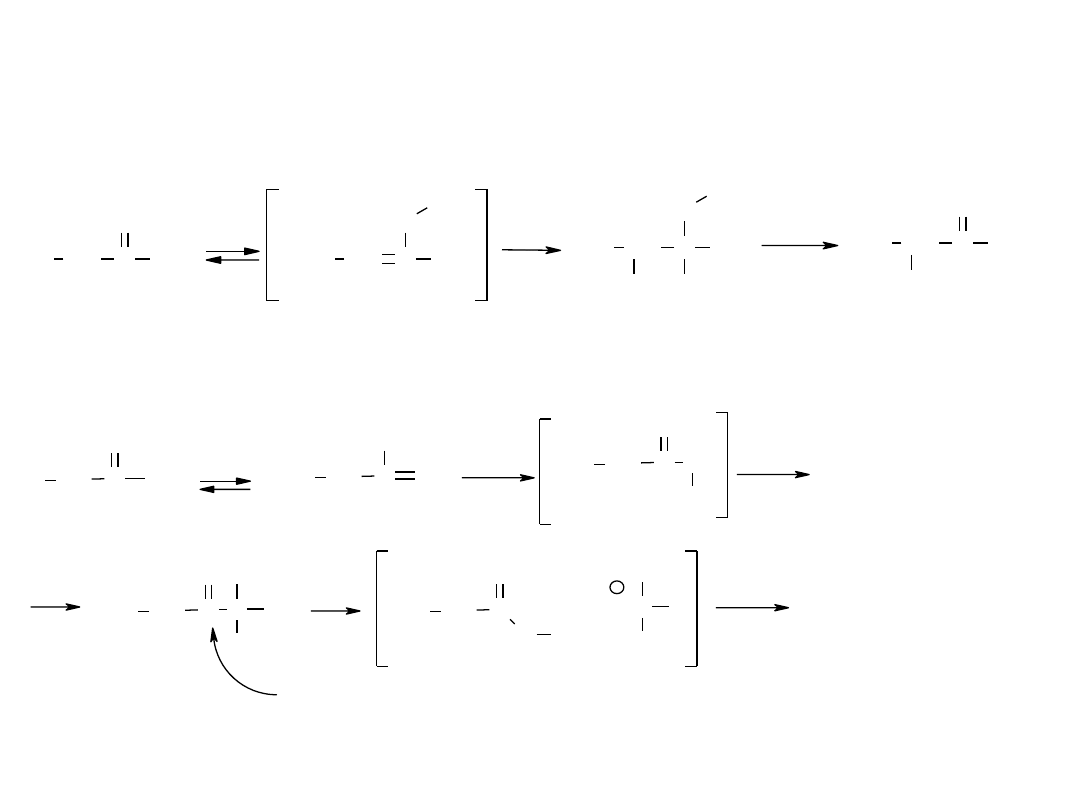
O
C
CH
2
CH
3
C
H
3
O
C
CH
CH
3
C
H
3
H
O
C
CH
CH
3
C
H
3
H
X
X
O
C
CH
CH
3
C
H
3
X
H
+
X
2
-HX
O
C
CH
2
CH
3
C
H
3
OH
C
CH
2
CH
2
C
H
3
O
C
CH
2
CH
2
C
H
3
X
O
C
CH
2
C
C
H
3
X
X
X
O
C
CH
2
C
H
3
O H
C
X
X
X
-
OH
-
X
2
X
2
OH
-
OH
-
:
C
2
H
5
COO
-
+
CHX
3
X= Cl, Br, I
Cl: chloroform; Br: bromform; I: jodoform
Reakcje związków karbonylowych –
reakcje w środowisku alkalicznym i kwaśnym
reakcja haloformowa, ulegają jej jedynie metyloketony, acetaldehyd i etanol
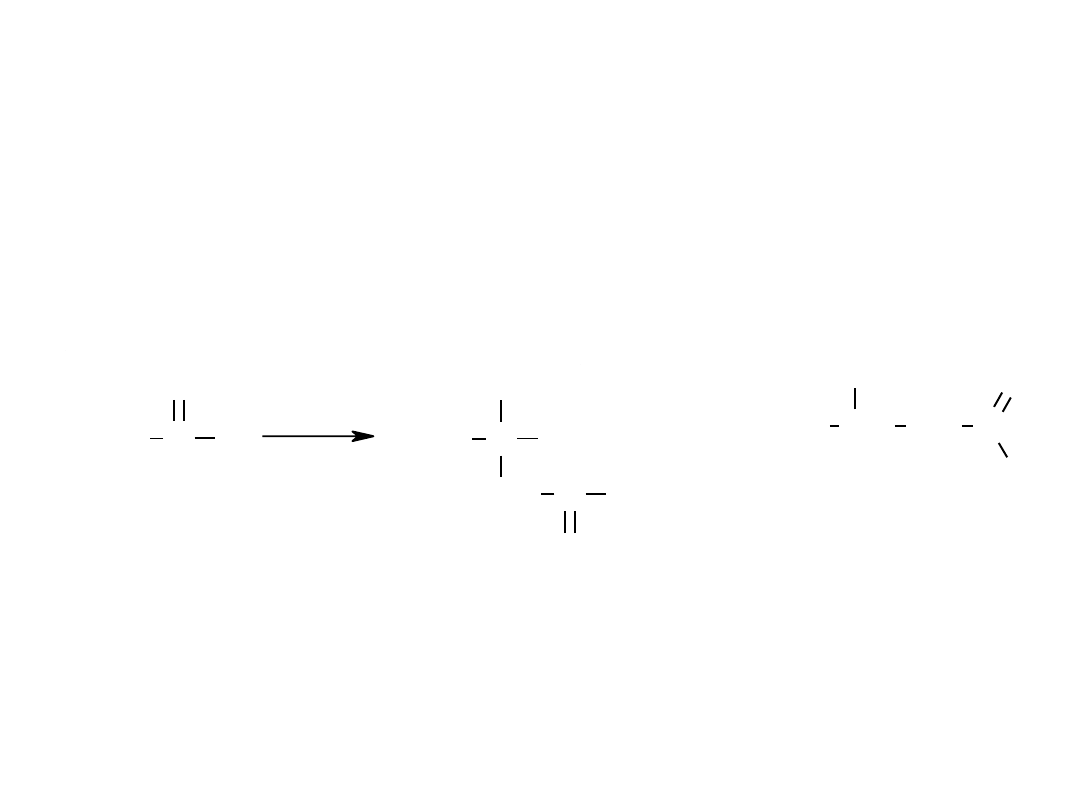
Reakcje związków karbonylowych –
reakcje w
środowisku alkalicznym –
kondensacja aldolowa
CH
3
O
C H
CH
2
O
C H
CH
3
OH
C H
CH
3
CH CH
2
C
OH
O
H
NaOH
=
aldol
CH
C
H
3
O
C H
H
CH
C
H
3
O
C H
-
OH
-
-H
2
O
..
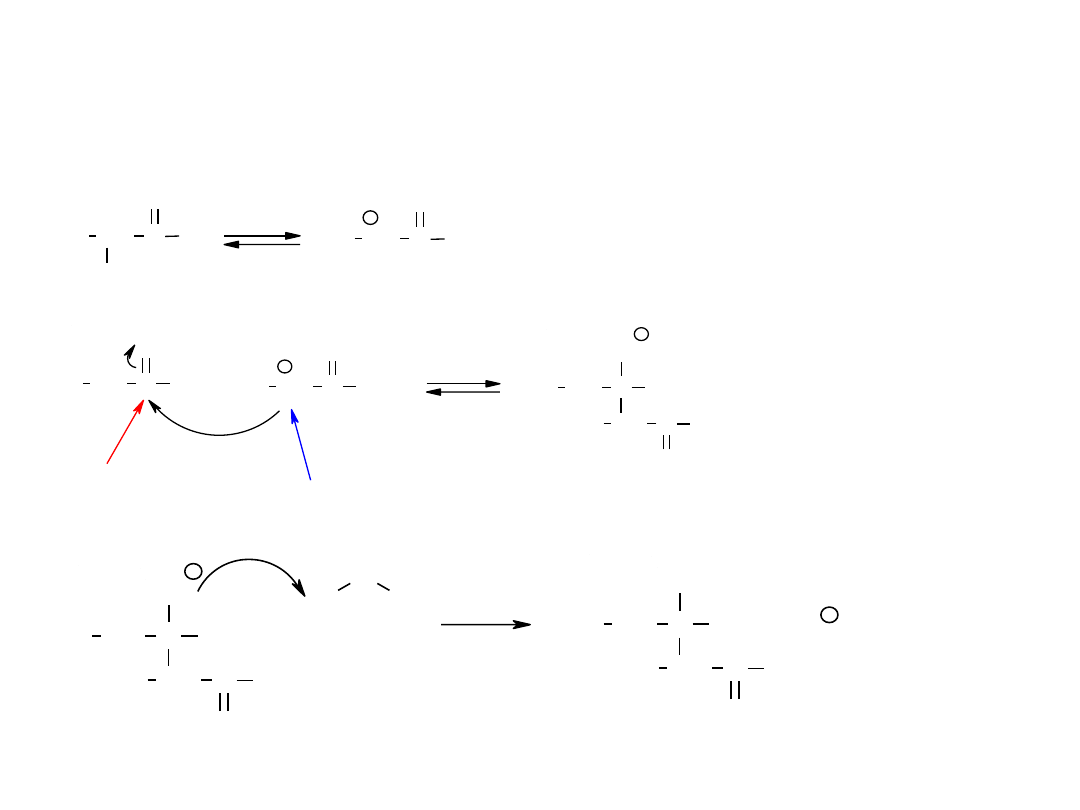
Reakcje związków karbonylowych –
reakcje w
środowisku alkalicznym –
kondensacja aldolowa
CH
2
C
H
3
O
C
H
CH
C
H
3
O
C H
-
CH
C
H
3
O
C H
CH
2
C
H
3
O
C H
-
..
c.e
c.n
..
: :
CH
C
H
3
O
C H
CH
2
C
H
3
O
C H
-
H
O
H
CH
C
H
3
O
C H
CH
2
C
H
3
OH
C H
-
..
: :
..
:
+ OH
Reakcje związków karbonylowych –
reakcje w
środowisku alkalicznym –
reakcja Cannizzaro
C
H
O
CH
2
OH
C
ONa
O
NaOH
+
2
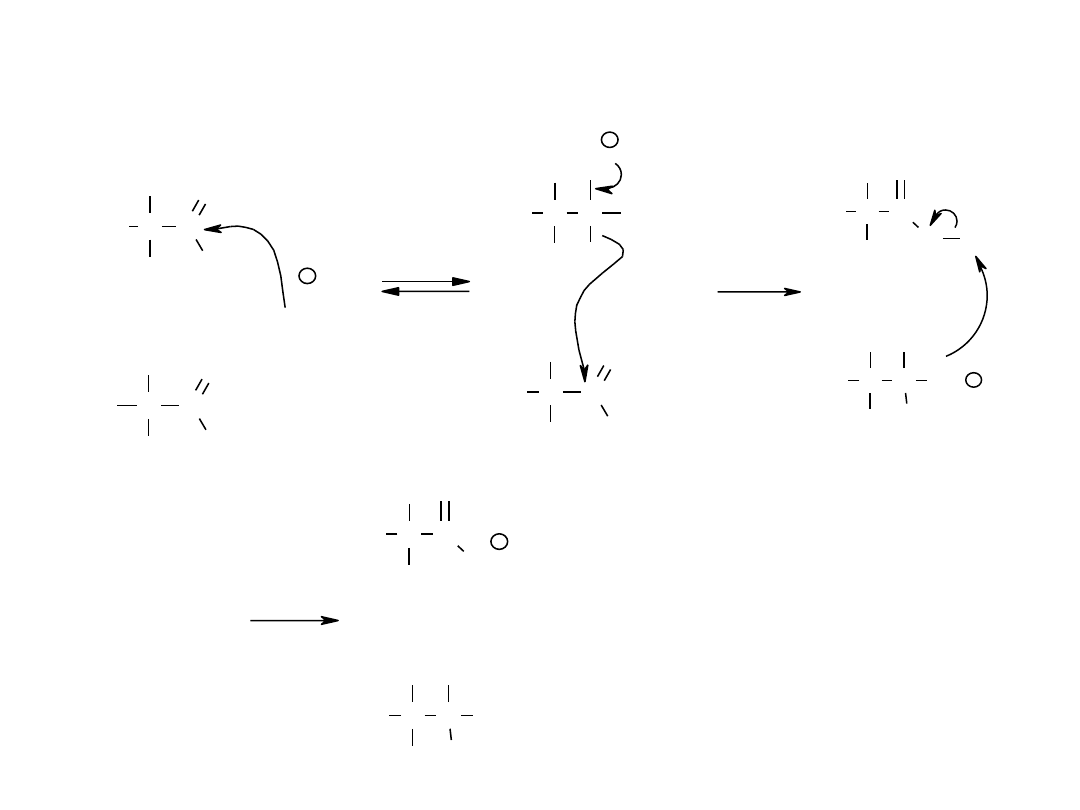
CH
3
C
C
H
3
CH
3
C
H
O
CH
3
C
C
H
3
CH
3
C
H
O
-
C
H
3
C
C
H
3
C
H
3
C
H
O
OH
C
H
3
C
C
H
3
CH
3
C
H
O
-
OH
:
..
..
: :
..
C
H
3
C
C
H
3
C
H
3
C
O
O H
C
H
3
C
C
H
3
C
H
3
C
H
O
H
-
:
..
:
..
..
-
C
H
3
C
C
H
3
C
H
3
C
O
O
C
H
3
C
C
H
3
C
H
3
C
H
OH
H
:
:
..
..
..
..
Reakcje związków karbonylowych –
reakcje w
środowisku alkalicznym –
reakcja Cannizzaro
Wyszukiwarka
Podobne podstrony:
Chemia organiczna czesc I poprawiona
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia Organiczna 4
Chemia organiczna IV
CHEMIA- CHEMIA ORGANICZNA, CHEMIA
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
chemia organiczna 2003 cała PDF(1)
Egzamin Chemia organiczna zestawy 1 8
więcej podobnych podstron