
Materiały Funkcjonalne
Ćwiczenie nr 2
Analiza procesu desorpcji wody z hydrożeli
Politechnika Łódzka, Katedra Fizyki Molekularnej
Temat: „Analiza procesu desorpcji wody z hydrożeli”
Cel ćwiczenia:
Poznanie zjawiska desorpcji wody przez hydrożele polimerowe, wpływ objętościowego
przejścia fazowego na proces desorpcji wody. Wyznaczenie równowagowego stopnia
uwodnienia żelu.
Zakres obowiązującego materiału:
Hydrożele: definicja, rodzaje metody otrzymywania, właściwości, zastosowania.
Objętościowe przejście fazowe. Stopień uwodnienia hydrożeli. Hydrożele czułe na bodźce.
Przyrządy i materiały użyte w doświadczeniu:
Waga laboratoryjna, szkiełka lub szalki Petry’ego, pęseta, próbka hydrożelu (radiacyjnie
usieciowanego poli(vinylometyloeteru)), stolik grzejny.
Wprowadzenie
1. Podstawowe pojęcia
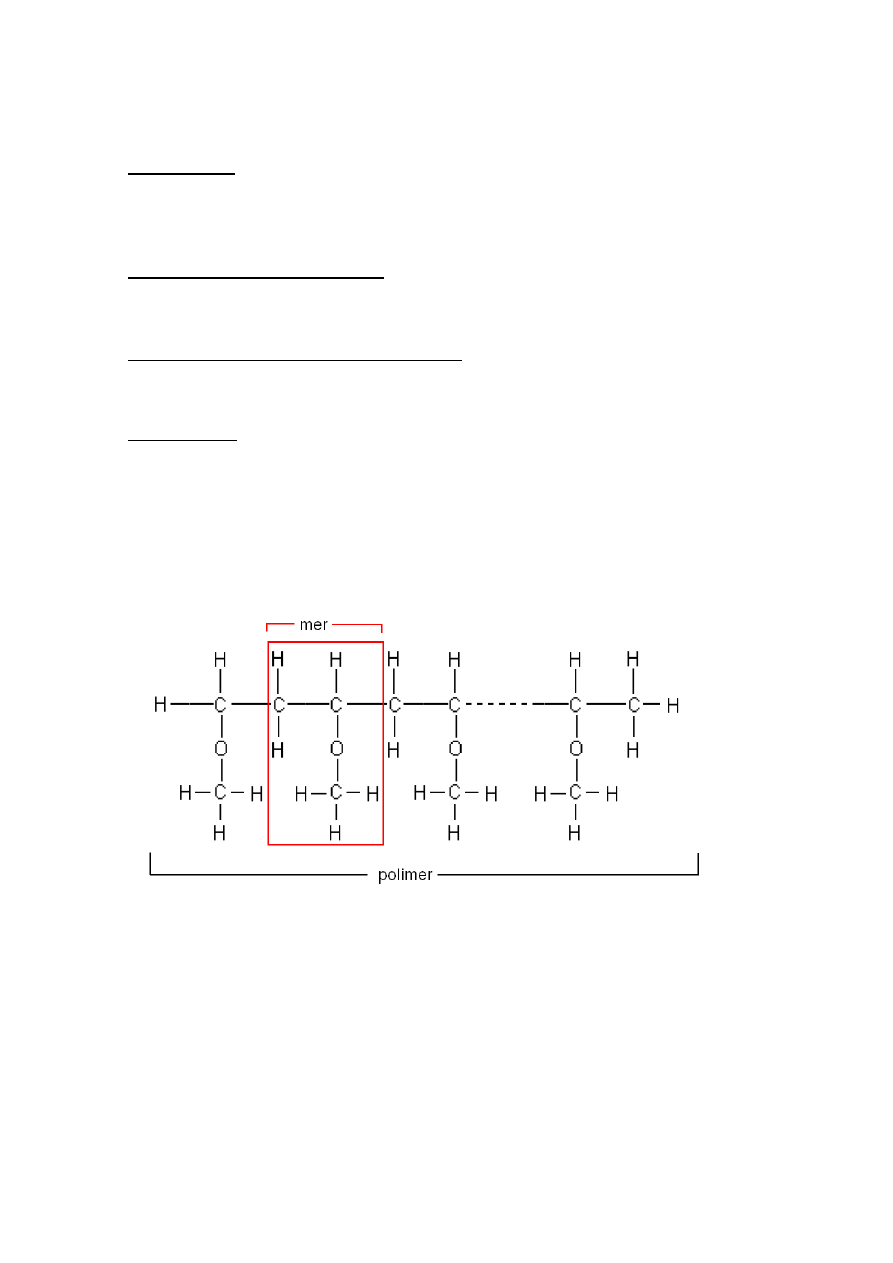
Makrocząsteczka (polimer) jest to związek chemiczny zbudowany z wielokrotnie
powtarzających się zespołów lub grup atomowych (zwanych merami), połączonych ze
sobą wiązaniami chemicznymi i występujących w takiej ilości, że dodanie lub odjęcie
kilku tych jednostek nie wywiera znaczącego wpływu na jego właściwości.
Mer jest to powtarzający się element strukturalny w łańcuchu makrocząsteczki
(polimeru), zbudowany z atomów rozmieszczonych w przestrzeni w określonym porządku
i połączonych ze sobą wiązaniami chemicznymi (rys. 1).
Rys 1. Fragment makrocząsteczki poli(winylometyloeteru) PVME
W wyniku wytworzenia wiązań chemicznych pomiędzy łańcuchami polimerowymi
możliwe jest wytworzenie przestrzennej struktury zwanej siecią polimerową. Proces
tworzenia tego typu struktur nazywany jest sieciowaniem.
Zdecydowanie trudniej zdefiniować żel. Według Hermansa żel jest ciałem
spełniającym następujące warunki:
- jest to jednorodny układ dwuskładnikowy utworzony przez substancję stałą
zdyspergowaną lub rozpuszczoną w fazie ciekłej (rozpuszczalniku);
- pod działaniem sił mechanicznych układ zachowuje się jak ciało stałe;
- zarówno składniki zdyspergowane, jak i rozpuszczalnik, wypełniają w sposób ciągły cały
układ i nawzajem się przenikają.
2
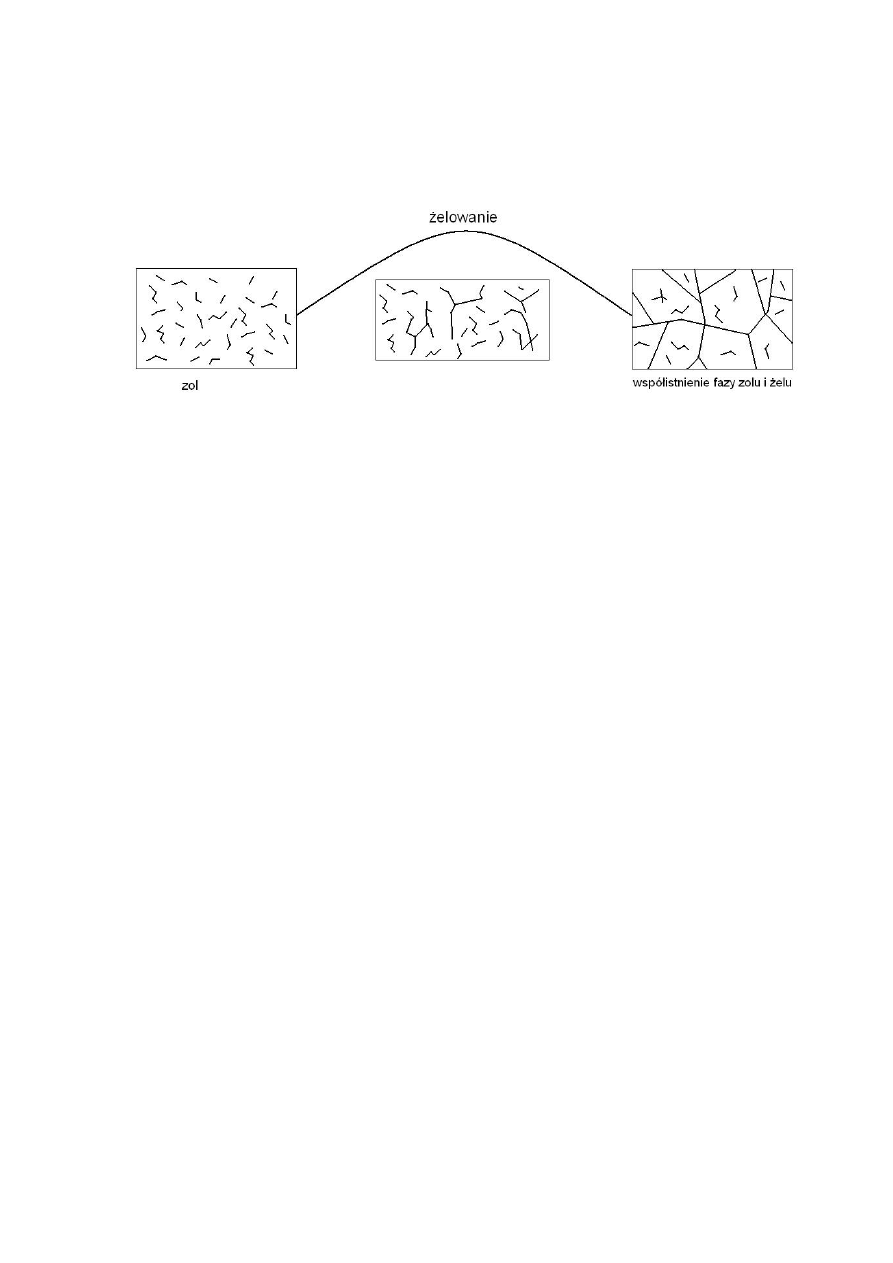
Proces powstawania cząsteczki żelu nazywamy żelowaniem, a jej pojawienie się na
określonym etapie reakcji – punktem żelowania lub przejściem zol – żel. Powyżej punktu
żelowania żel współistnieje z zolem (patrz rys. 2). Po usunięciu (ekstrakcji) fazy zolu, żel
można traktować jako jedną makrocząsteczkę, której struktura zależy od metody i
warunków jej otrzymywania.
Rys. 2 Schemat ideowy procesu żelowania
Chłonność żeli, zwana również stopniem spęcznienia, wyrażona jest najczęściej w
gramach rozpuszczalnika (np. wody) pochłoniętego przez 1g suchego żelu. W przypadku
hydrożeli polimerowych nosi ona nazwę stopnia uwodnienia. Może wynosić od kilku do
kilkuset g
wody
/g
polimeru
w zależności od charakteru grup funkcyjnych i stopnia usieciowania
polimeru. Obecność elektrolitów oraz związków chemicznych zdolnych do reakcji z
grupami funkcyjnymi żelu zazwyczaj pogarsza jego chłonność.
Pęcznienie jest zjawiskiem dyfuzyjnym kierowanym przez powinowactwo
cząsteczek pęczniejącego materiału do cząsteczek płynu. Równowago pęcznienia żelu jest
określona przez bilans czynników sprzyjających i przeciwdziałających temu procesowi. Do
pierwszej grupy zalicza się energię swobodną łańcuchów sieci i rozpuszczalnika, zaś do
drugiej elastyczną odpowiedź sieci.
2. Typy żeli
W zależności od rodzaju oddziaływań pomiędzy cząsteczkami tworzącymi
usieciowaną strukturę żelu, możemy podzielić je na:
1. Żele chemiczne, w których makrocząsteczki są połączone ze sobą poprzez
wiązania kowalencyjne, w związku z czym są one zazwyczaj odporne chemicznie i
termicznie, zaś zerwanie wiązań sieciujących w wyniku reakcji chemicznych bądź też
działania naprężeń skutkuje zniszczeniem sieci w sposób nieodwracalny.
2. Żele fizyczne, które powstają w wyniku oddziaływań fizycznych (najczęściej
wiązania wodorowe, bądź oddziaływania jonowe). W podwyższonej temperaturze, przy
zmianie pH, bądź pod wpływem innych substancji żele fizyczne mogą ulegać przejściu w
stan zolu, przy czym przejście to najczęściej jest odwracalne. o stabilności żelu decyduje
przede wszystkim rodzaj oddziaływań polimer – rozpuszczalnik, polimer – polimer i
rozpuszczalnik – rozpuszczalnik, gdyż istnienie żelu zależy zarówno od rodzaju polimeru,
jak i rodzaju rozpuszczalnika.
Różnorodne procesy fizyczne związane z powstawaniem silnych oddziaływań
międzycząsteczkowych mogą prowadzić do „połączenia” łańcuchów (sieciowania)
polimeru, a w konsekwencji doprowadzić do powstania żelu. Przykładem mogą być
procesy związane z przejściami konformacyjnymi występujące często w biopolimerach, w
których powstają struktury helikalne z udziałem dwóch lub więcej helis. Zjawisko
żelowania tego typu może być obserwowane w powszechnie stosowanej żelatynie
(zdenaturowany kolagen) lub niektórych poliwęglowodanach.
3
Generalnie ze względu na rodzaj substancji tworzącej trójwymiarową sieć żele
można podzielić na organiczne i nieorganiczne. Innym kryterium podziału jest masa
cząsteczkowa substancji użytej do produkcji żelu. Z tego punktu widzenia rozróżniamy
żele niskocząsteczkowe (najczęściej tworzące żele fizyczne) oraz polimerowe, przy czym
ta druga grupa dzieli się dodatkowo na żele polimerowe naturalne i syntetyczne.
Do produkcji hydrożeli nieorganicznych najczęściej używa się: bentonitu, krzemionki
koloidalnej bądź krzemianu glinowo – magnezowego. W przypadku produkcji żeli
organicznych zdecydowanie najczęściej wykorzystuje się polimery. Syntetyczne żele
polimerowe najczęściej otrzymywane są w wyniku kopolimeryzacji monomerów
winylowych i diwinylowych, wśród których największe znaczenie mają akrylamid, kwas
akrylowy, kwas metakrylowy oraz ich pochodne N,N – metyleno-bisakryloamid,
poli(glikol etylowy)(PEG), polki(kwas asparaginowy), poli(alkohol winylowy), poli-N-
winylopirolidyn. Wśród polimerów naturalnych (często są one poddawane chemicznej
modyfikacji) największe znaczenie mają: pochodne węglowodanów, pochodne celulozy,
chitozan, fibryna, białka
Własności fizyczne hydrożeli zależą od wielu czynników, m. in. rodzaju polimeru,
z którego są utworzone, charakteru grup funkcyjnych, stopnia usieciowania polimeru,
stopnia rozdrobnienia produktu, składu chemicznego pochłanianej cieczy. Wśród
właściwości hydrożeli polimerowych, które stanowią o ich szerokim zastosowaniu należy
przede wszystkim wymienić:
- zdolność wchłaniania bardzo dużych ilości wody
- pochłaniania wody jest w znacznym stopniu procesem odwracalnym
- nietoksyczność
- często biokompatybilność i biodegradowalność
- odporność chemiczna i termiczna (w przypadku żeli chemicznych)
- elastyczność
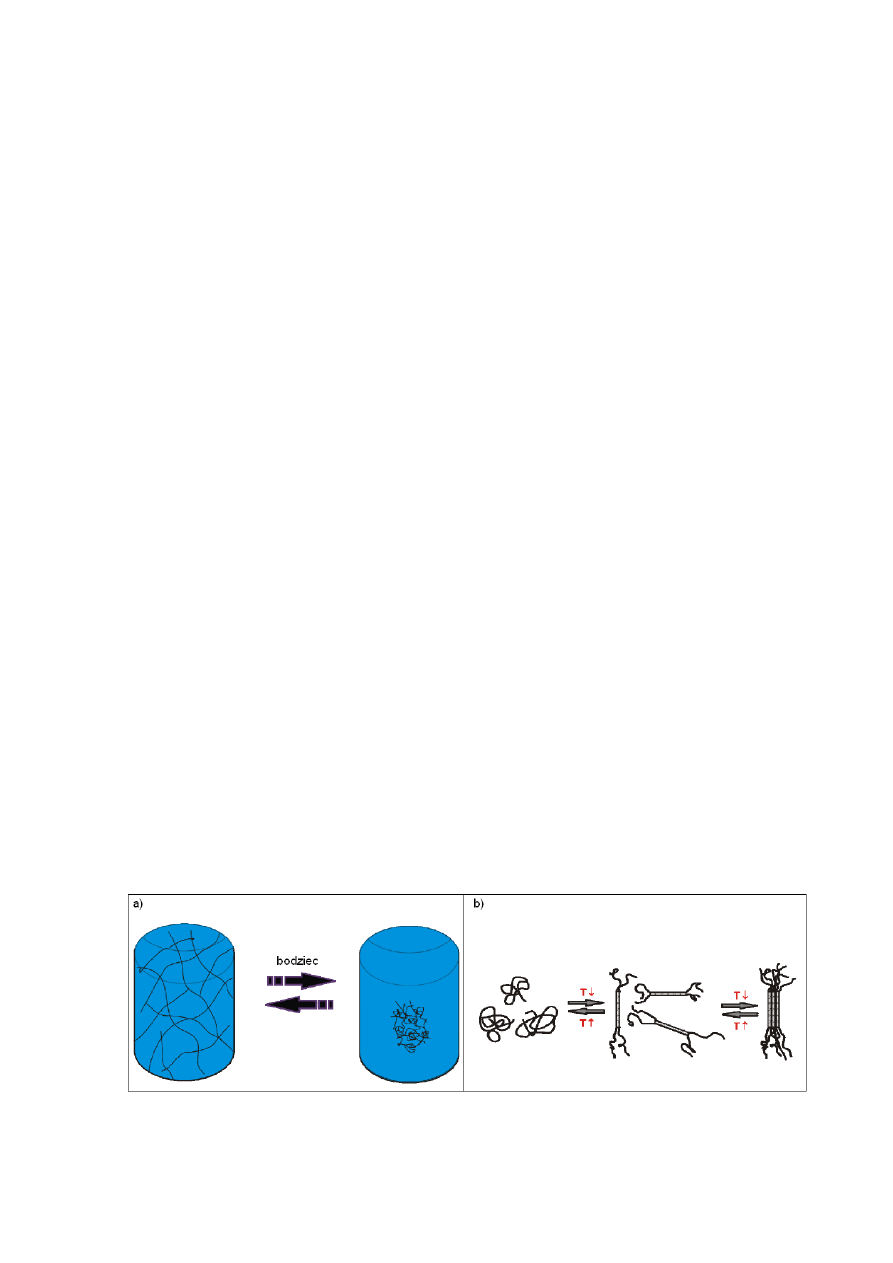
3. Hydrożele czułe na bodźce (Stimuli responsive hydrogels)
Jedną z najciekawszych grup hydrożeli są hydrożele „czułe na bodźce” ( z ang.
stimuli responsive hydrogels). Atrakcyjność tych żeli polega w głównej mierze na
możliwości wywołania szybkiej zmiany ich właściwości w całej swej objętości pod
wpływem nawet małej modyfikacji warunków otoczenia (bodźca). Dostarczony bodziec
może mieć zarówno charakter fizyczny (temperatura, światło, pole mechaniczne,
elektryczne lub magnetyczne), jak i chemiczny (zmiana warunków pH, obecność ściśle
określonych jonów lub innych cząsteczek chemicznych). Taki hydrożel posiada, więc
swojego rodzaju właściwości „czujnika”, po którego „przełączeniu” (obecność bodźca)
wykazuje objętościowe przejście fazowe (OPF) lub też przejście typu żel – zol (
patrz rys 5
).
Rys. 5 – Schemat odwracalnego przejścia fazowego w polimerach czułych na bodźce; a)
objętościowe przejście fazowe w chemicznie usieciowanym hydrożelu, b) przejście typu
sol-żel polisacharydu w wodzie pod wpływem działania temperatury.
4

Najczęściej wytwarzane i stosowane są hydrożele wykazujące OPF w odpowiedzi
na zmianę temperatury. Wynika to z faktu, iż zmiany temperatury wielokrotnie towarzyszą
rozmaitym zjawiskom przebiegającym w przyrodzie, jak również temperatura jest
czynnikiem stosunkowo prostym do kontroli (w pewnych granicach) w warunkach
laboratoryjnych i przemysłowych. W większości hydrożeli wykazujących OPF pod
wpływem temperatury, wykorzystane jest zjawisko utraty mieszalności polimeru powyżej
pewnej temperatury zwanej krytyczną temperaturą rozpuszczalności. Położenie krytycznej
temperatury rozpuszczalności wynika z nietrwałej równowagi pomiędzy oddziaływaniami
hydrofilowymi, a hydrofobowymi polimeru z wodą. Dlatego polimery wykorzystywane do
otrzymywania hydrożeli termoczułych zawierają ugrupowania chemiczne (lub w
przypadku kopolimerów - bloki) zarówno hydrofilowe jak i hydrofobowe. Wzrost
temperatury powoduje osłabienie wiązań wodorowych polimer-woda i dodatkowo promuje
oddziaływania hydrofobowe polimer-polimer. W rezultacie prowadzi to do zmiany
struktury łańcucha do postaci kłębka, separacji faz, a w przypadku trójwymiarowej sieci
polimerowej w hydrożelu objawia się to objętościowym przejściem fazowym
Oczekiwania wobec przyszłych zastosowań hydrożeli czułych na bodźce są
ogromne. Najwięcej uwagi poświęca się obecnie hydrożelom mającym służyć, jako
nośniki do kontrolowanego uwalniania leków. W wypadku leków stosowanych doustnie
wymogi dotyczące biokompatybilności nośnika nie są szczególnie restrykcyjne (jest on
praktycznie w całości wydalany przez organizm). Znakomitym przykładem zastosowania
termoczułego hydrożelu, jako „kierowanego nośnika leku” (ang. targeted drug carrier –
cząsteczka leku zostaje uwolniona w specyficznym organie lub tkance) może być
wykorzystanie takich układów w chorobach charakteryzujących się lokalną hipertermią
patologicznej tkanki. W takim przypadku cząsteczka leku zostaje umieszczona w żelu,
który wykazuje przejście OPF w zakresie temperatur 36,6 - 42°C. Po dotarciu do tkanki o
podwyższonej temperaturze konformacja żelu zmienia się i uwalnia on lek do chorej
tkanki. W interesujący sposób hydrożele z omawianej grupy zostały ponadto użyte w
mikrosoczewkach o ogniskowej zmieniającej się pod wpływem zmiany temperatury (lub
też pH). W układzie takim soczewkę stanowi granica międzyfazowa woda - olej, natomiast
z hydrożelu wykonana jest obręcz wokół soczewki spełniająca funkcje analogiczną do
mięśnia rzęskowego w oku. Na skutek bodźca (zmiany temperatury) hydrożel pęcznieje
lub kurczy się zmieniając napięcie powierzchniowe woda-olej i tym samym zmianie ulega
ogniskowa soczewki – patrz rys 6.
Rys 6. Hydrożelowa soczewka o zmiennej ogniskowej (zaczerpnięto Dong, L.,
Agarwal, A. K., Beebe, D. J., Jiang, H. , Adaptive liquid microlenses activated by stimuli-
responsive hydrogels. Nature, 2006(442): p. 551-554). Czarny pasek odpowiada
rozmiarowi równemu 1 mm.
5

Oprócz zastosowań farmaceutycznych termoczułe hydrożele mogą być również
używane do usuwania organicznych zanieczyszczeń ze środowiska wodnego. Zostaje tu
wykorzystana zmiana charakteru polimeru z hydrofilowego na hydrofobowy powyżej
krytycznej temperatury rozpuszczania – po jej przekroczeniu polimer desorbuje wodę
zatrzymując składniki hydrofobowe.
4. Zastosowanie hydrożeli
Oprócz wymienionych powyżej aplikacji, hydrożele znalazły szerokie zastosowanie
w medycynie i przemyśle farmaceutycznym (opatrunki hydrożelowe, inżynieria tkankowa,
implanty i inne), przemyśle spożywczym, przemyśle chemicznym i kosmetycznym
(produkcja mydeł, płynów do kąpieli, szamponów, kremów, i innych), ogrodnictwie i
rolnictwie (nośnik nawozów o opóźnionym działaniu, podłoża o zwiększonej pojemności
wodnej, czynnik immobilizujące składniki nawozowe, pestycydy lub herbicydy stosowane
w produkcji roślinnej), technologiach ochrony środowiska (usuwanie organicznych
zanieczyszczeń ze środowiska wodnego).
Część doświadczalna:
Wykonanie ćwiczenia:
1. Sprawdź czy waga jest wypoziomowana, jeśli nie to zwróć się do prowadzącego o
pomoc.
2. Włącz wagę czerwonym przyciskiem waga rozpoczyna autokalibrację, w czasie jej
trwania nie dotykaj wagi.
3. Odczekaj, aż na wyświetlaczu pojawią się cyfry 0,0000. Jeśli pojawią się inne cyfry
naciśnij przycisk
→O/T←. Jeśli ponownie na wyświetlaczu pojawi się wynik różny
od 0,0000 poproś o pomoc prowadzącego ćwiczenie.
4. Zważ oba przygotowane szkiełka, bądź szalki Petry’ego. Wynik zanotuj.
5. Pozostaw jedno ze szkiełek na szalce wagi i naciśnij przycisk
→O/T←. Odczekaj
chwilę.
6. Zdejmij szkiełko z wagi i umieść na nim wyjęty z wody kawałek hydrożelu. Zważ
próbkę, przyjmij czas pomiaru jako zerowy. Wyniki notuj w tabeli.
7. Wykonuj pomiary masy próbki początkowo co 5 minut (przez pierwszą godzinę), a
następnie co 10-15 minut.
8. Po zakończeniu pracowni oddaj próbkę prowadzącemu zajęcia. Nie wyrzucaj jej.
Będzie ona niezbędna do wyznaczenia stałej masy żelu w kolejnym tygodniu.
9. Na drugim szkiełku umieść inny kawałek żelu.
10. Wyznacz jego masę.
11. Umieść szkiełko z żelem na stoliku grzejnym w temperaturze 45 – 50
o
C.
12. Obserwuj zmiany przez 15 minut, a następie ponownie zważ próbkę.
13. Powtórz pomiar masy w odstępach 15 minut jeszcze 4-5-krotnie.
14. Po zakończeniu pracowni oddaj próbkę prowadzącemu zajęcia. Nie wyrzucaj jej.
Będzie ona niezbędna do wyznaczenia stałej masy żelu w kolejnym tygodniu.
15. Po zakończeniu ćwiczenia wyłącz wagę czerwonym przyciskiem. NIE ODŁĄCZAJ
WAGI OD ZASILANIA.
Sporządzenie sprawozdania:
1. Sprawozdanie powinno zawierać: wstęp teoretyczny (nie więcej niż 1 strona tekstu),
podpisane przez prowadzącego wyniki pomiarów zestawione w tabelach, wykresy
wykonane zgodnie z punktami 17 i 18, jasno sformułowane wnioski.
2. Na podstawie uzyskanych wyników dla próbki suszonej w temperaturze pokojowej
sporządź wykres m/m
0
= f(t), gdzie m oznacza masę żelu, m
0
– masę suchej
6

pozostałości, t – czas. Na tym samym wykresie dołóż punkty dla próbki suszonej w
temperaturze wyższej niż temperatura OPF (45-50
o
C).
3. Sporządź wykres log(m/m
0
) = f(log(t)).
4. Wyznacz równowagowy stopień uwodnienia żelu.
5. Sformułuj wnioski.
7
Document Outline
Wyszukiwarka
Podobne podstrony:
3 ćwiczenia BADANIE asfaltów
Ćwiczenie7
Cwiczenia 2
Ćwiczenia V
metody redukcji odpadów miejskich ćwiczenia
Ćwiczenia1 Elektroforeza
cwiczenia 9 kryzys
Ćwiczenia 1, cz 1
Ćwiczenie 8
9 ćwiczenie 2014
Cwiczenie 1
Ćwiczenie 2 Polska w europejskim systemie bezpieczeństwa
11 CWICZENIE 1 SEMESTR LETNIid 12747 ppt
więcej podobnych podstron