Biologia Molekularna – ćwiczenia
Biotechnologia – III rok

Prowadzący:
dr Magdalena Sowa-Kućma
Kontakt:
magdasowa@poczta.onet.pl

Regulamin
I. Postanowienia ogólne
1. Studenci zobowiązani są do przestrzegania
przepisów BHP.
a) Zabrania się brania do ust wszelkiego rodzaju roztworów. Do
pipetowania należy posługiwać się przeznaczonymi do tego
celu pipetami automatycznymi lub innego rodzaju.
b) Podczas pracy z substancjami szczególnie toksycznymi i
kancerogennymi należy używać rękawiczek.
c) Przy wykonywaniu wszelkich prac i doświadczeń należy
zachować szczególną ostrożność.
d) Doświadczenia należy wykonywać z takimi ilościami i
stężeniami substancji, jakie są podane w instrukcji.
e) Odpadów stałych (papierów, zapałek, a zwłaszcza żeli
agarozowych i poliakrylamidowych) nie wrzucać do zlewu.
f) Wszystkie substancje w pracowni traktować jako szkodliwe.
g) Każdy wypadek (oparzenia, skaleczenia lub połknięcia
roztworu, itp.) należy natychmiast zgłosić prowadzącemu
ćwiczenia.

2. W pracowni zabronione jest:
a. wnoszenie wierzchnich okryć
b. umieszczanie toreb i plecaków na stołach laboratoryjnych
c. palenie tytoniu
d. spożywanie posiłków
e. prowadzenie głośnych rozmów
3. Miejscem ćwiczeń jest sala 6/5 w budynku URz przy ul.
Sokołowskiej.
4. W pracowni należy zawsze przebywać w fartuchu ochronnym.
5. Zestawy laboratoryjne zasilane energią elektryczną włącza
prowadzący zajęcia.
6. Za uszkodzenia przyrządów powstałe z winy studenta
(używanie niezgodne z przeznaczeniem lub instrukcją) ponosi on
pełną odpowiedzialność materialną (wszelkie usterki i
uszkodzenia należy zgłosić prowadzącym przed przystąpieniem
do wykonania doświadczenia).
7. Ćwiczenia odbywają się bez przerw, konieczność opuszczenia
pracowni należy zgłosić prowadzącym.

II. Organizacja zajęć laboratoryjnych
1
. Student przygotowuje się do ćwiczeń z zakresu zagadnień
teoretycznych i metod doświadczalnych
2. Student jest zobowiązany do zapoznania się z instrukcją wykonania
ćwiczenia przed przystąpieniem do jego wykonania.
3. O zakończeniu doświadczenia należy poinformować prowadzącego.
4. Użyty sprzęt szklany należy dokładnie umyć ciepłą wodą a następnie
opłukać wodą destylowaną
5. Po zakończeniu ćwiczeń należy uporządkować swoje miejsce pracy.
III. Zaliczenie ćwiczeń
1
. Warunkiem zaliczenia ćwiczenia jest pozytywna ocena sprawdzenia
wiadomości teoretycznych.
2. W przypadku uzyskania 1 lub więcej ocen niedostatecznych, student
zobowiązany jest zaliczyć kolokwium końcowe/całościowe.
3. Ilość nieobecności nie może przekraczać 20% ogółu zajęć (max. 2 razy).
4. O formie zaliczenia opuszczonego ćwiczenia decyduje prowadzący.

Elektroforeza
–
technika separacji
makrocząsteczek
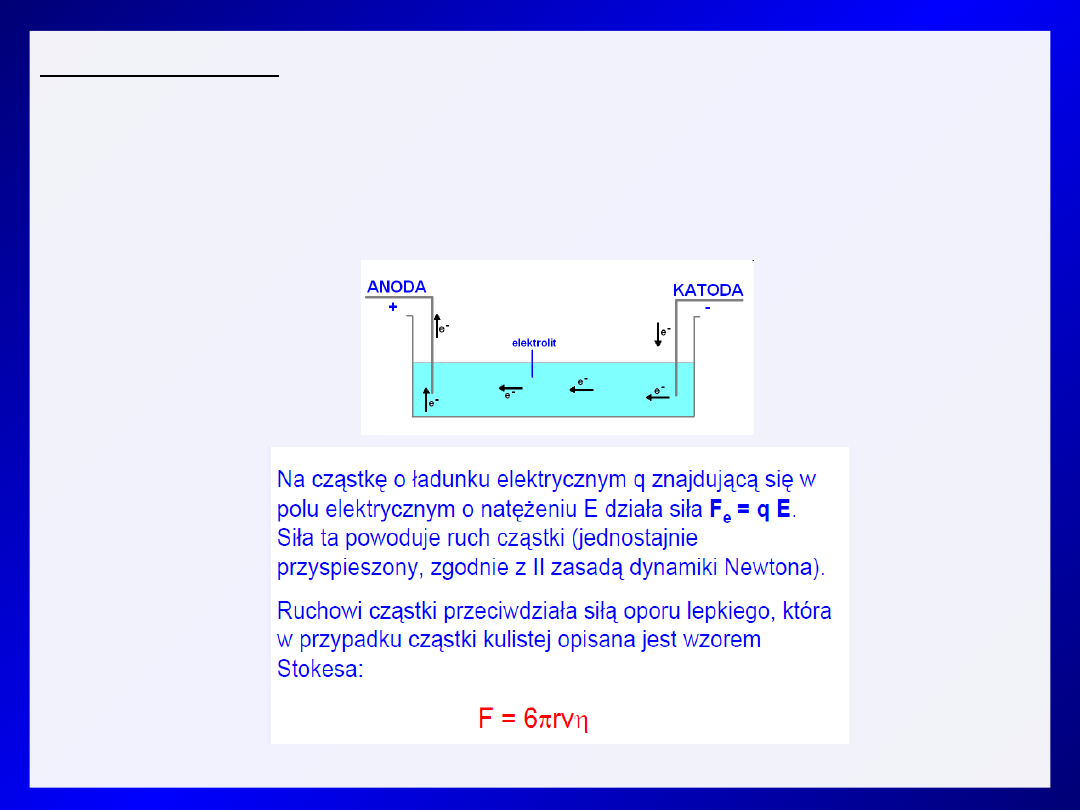
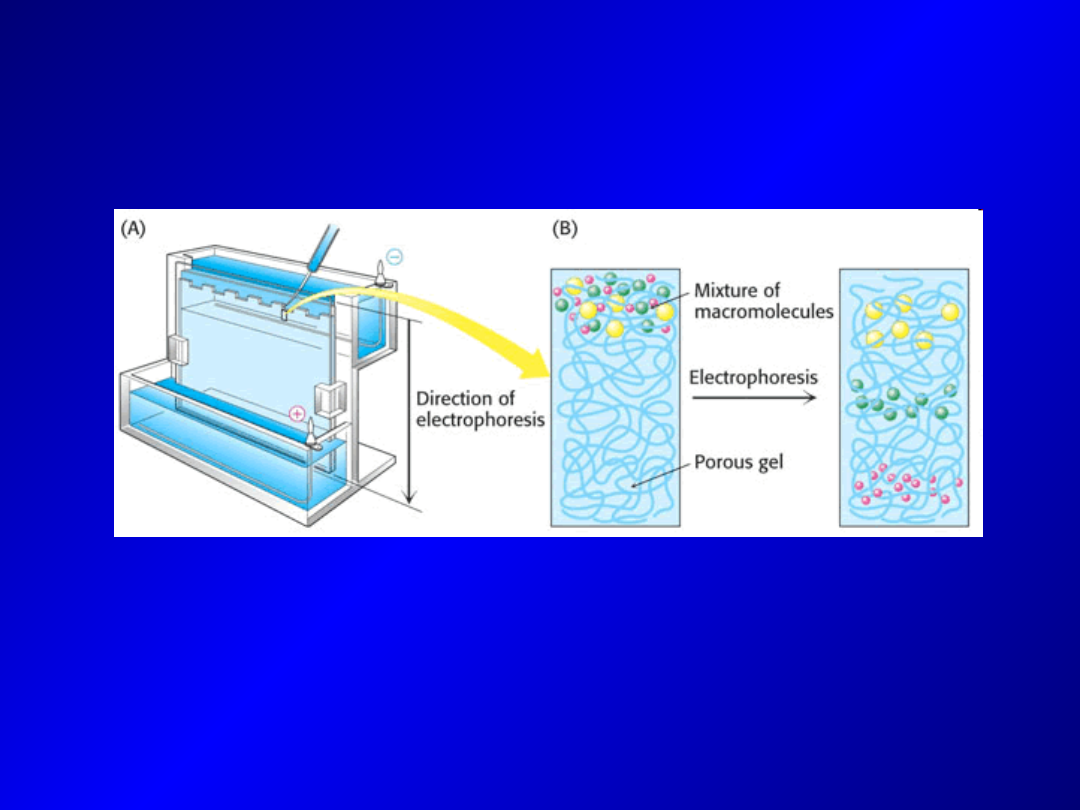
Elektroforeza (electrophoresis)
- technika analityczna (jakościowa i ilościowa), rzadziej preparatywna.
Jej istotą jest ruch makrocząsteczek posiadających ładunek w polu
elektrycznym i proces rozdzielania tych cząsteczek na skutek różnicy w
szybkości ich wędrowania.
- technika szybkiej separacji różnych cząsteczek przy użyciu prostych
urządzeń i relatywnie niskim nakładzie kosztów
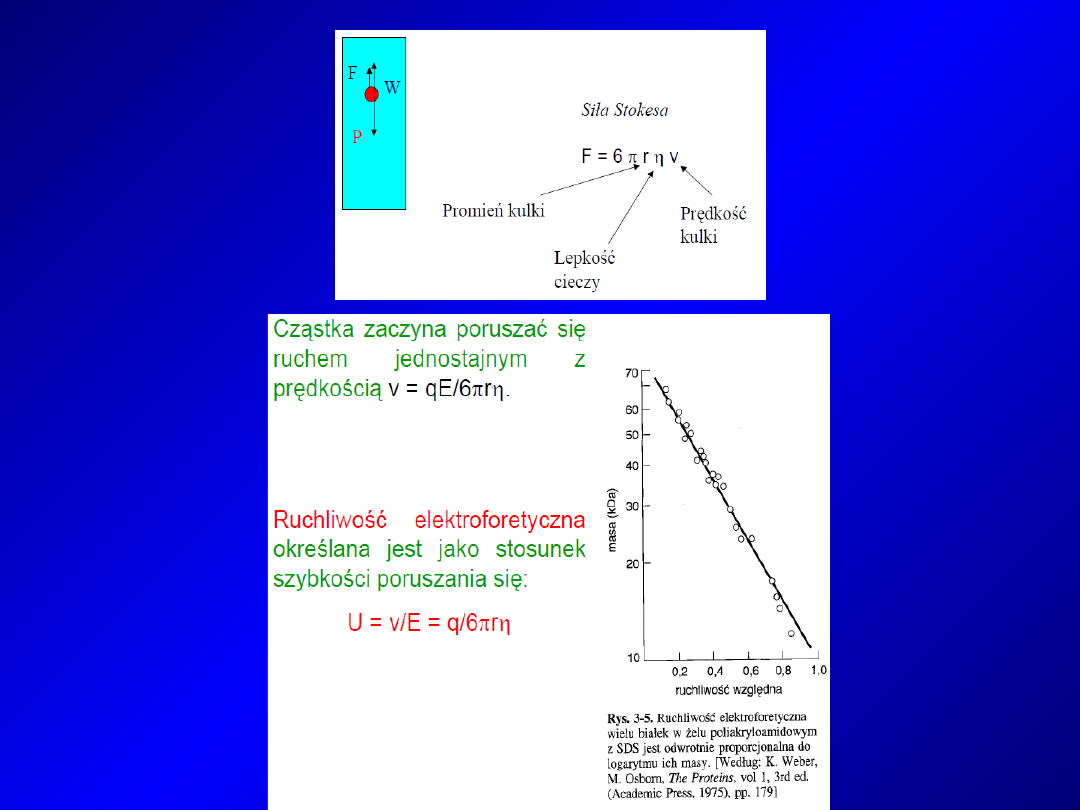
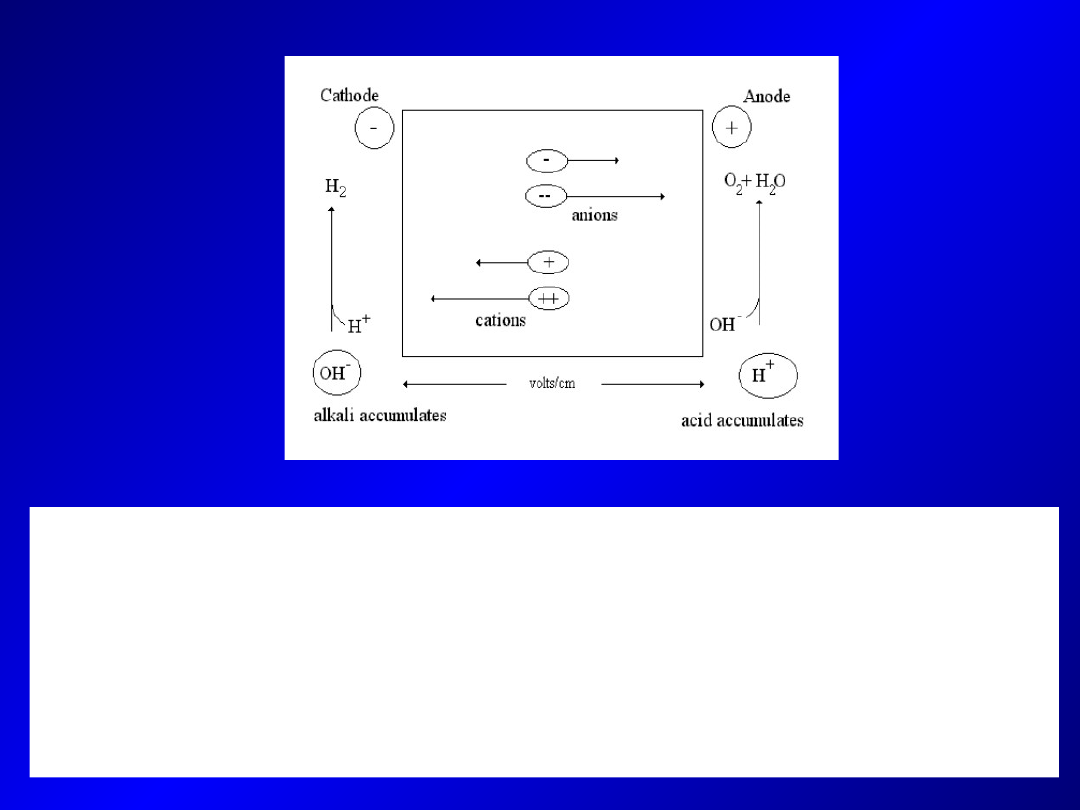
Szybkość przemieszczania się cząsteczek w polu elektrycznym
zależy od następujących czynników:
-
Właściwości cząsteczki:
wielkości ładunku, wielkości i
kształtu cząsteczki
-
Właściwości buforu:
pH, siły jonowej i składu jonowego
-
Innych czynników:
warunków prądowych, temperatury,
dyfuzji

Główne obszary
zastosowań elektroforezy
Biochemia białek
i kw. nukleinowych
Biologia molekularna
Medycyna sądowa
Farmakologia
Weterynaria
Diagnostyka medyczna
Kontrola
jakości żywności

Rodzaje elektroforezy:
- Makroelektroforeza –
ponad 0,1 g substancji
- Półmikroelektroforeza -
do ok. 10 mg substancji
- Mikroelektroforeza -
ok. 1 mg substancji
- Pozioma
- Pionowa
- Swobodna
– prowadzona bezpośrednio w objętości roztworu
- W nośnikach
Rodzaje nośników:
- Bibuła
- Azotan celulozy
- Agaroza
- Poliakrylamid

Żele agarozowe:
- Przygotowywane z agarozy – wielocukru
- Wielkość porów zależna od stężenia agarozy – im wyższe
stężenie, tym bogatsze usieciowanie i drobniejsze pory
- Najczęściej żele 0,4 – 4,0 %
- Stosuje się w aparatach do elektroforezy poziomej
- Zalety:
*łatwe i szybkie przygotowanie
*tanie
*możliwość separacji dużych
makrocząsteczek
- Wady:
*Słaba wytrzymałość mechaniczna
*trudność ich utrwalenia po rozdziale (wyschnięte żele rozsypują się)

Elektroforeza białek w żelach poliakrylamidowych
(
PAGE
– ang.
polyacrylamide gel electrophoresis)
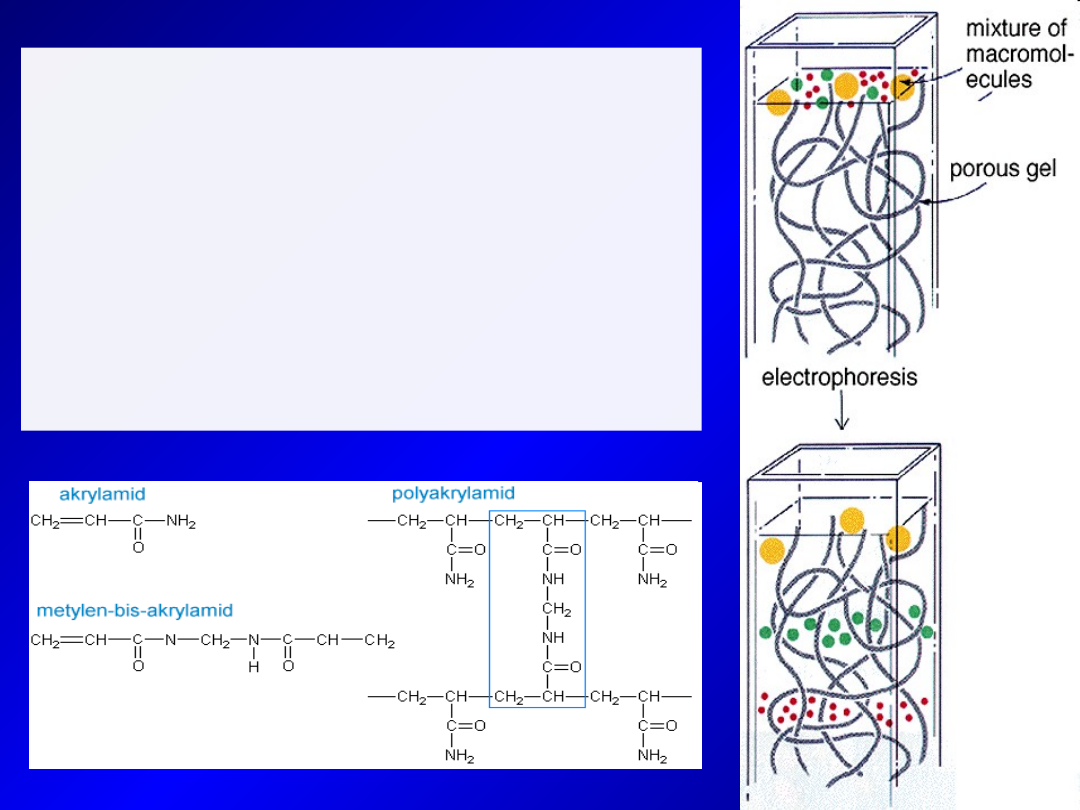
Żele poliakrylamidowe:
- Przygotowywane z roztworu monomerów
akrylamidu i substancji sieciujących (ang.
cross-linkers)
- UWAGA:
akrylamid w postaci monomerycznej –
bardzo silna neurotoksyna
- Substancja sieciująca – najczęściej N,N’-
metylenebisakrylamid (bis-akrylamid)
- Stopień usieciowania zależny od ilości
dodanego bisakrylamidu
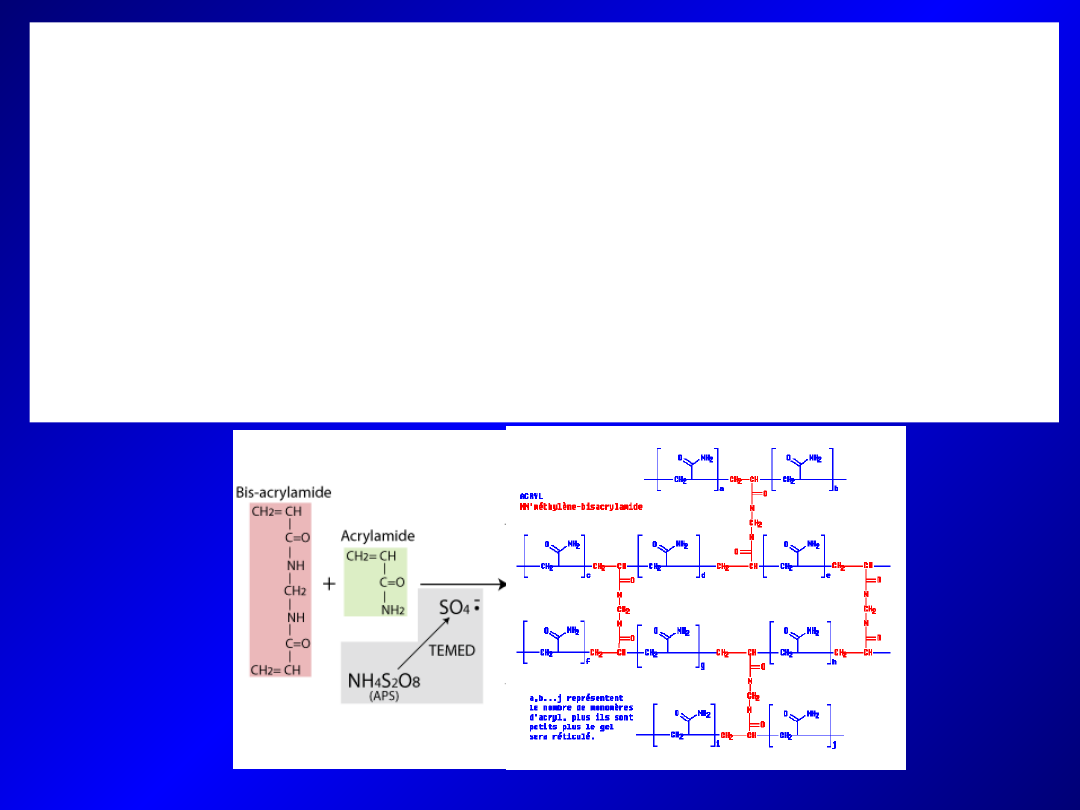
- Polimeryzacja akrylamidu i bisakrylamidu – mechanizm
wolnorodnikowy
- Źródło wolnych rodników – APS (nadtlenosiarczan), ulegający
hemolizie z wytworzeniem wolnych rodników
- N,N,N,N’-tetrametylenodiamina (TEMED) – przyśpiesza rozpad APS
- Odpowiednie dodanie ilości APS i TEMED warunkuje prawidłową
polimeryzację (zbyt duże stężenie – krótkie łańcuchy polimerów –
zmętnienie i obniżona elastyczność żelu)
- Zbyt duże stężenie TEMED (powyżej 0,2% v:v) – zaburzenia w rozdziale
elektroforetycznym
- Istotne pH (powyżej 6) mieszaniny, by zadziałał TEMED
- Optymalny czas polimeryzacji żelu – 2-3h w temp. 4
o
C

Żele poliakrylamidowe można przygotować w dwóch
postaciach:
- Żele o stałym stężeniu poliakrylamidu w całej objętości – do
rozdziału białek o masie zawierającej się w określonym przedziale, np.
15% - białka o masie mniejszej niż 20 kDa, 12% - 20 – 30 kDa, 10% - 30
– 40 kDa, 8% - powyżej 50 kDa (w technice SDS-PAGE). Białka o masie
poniżej tych przedziałów mogą migrować jako jeden, gruby prążek wraz
z czołem elektroforezy. Białka o wyższych masach – jako słabo
rozdzielone prążki lub wogóle nie wnikną do żelu.
- Żele o rosnącym liniowo stężeniu poliakrylamidu (tzw.
żele
gradientowe
) – o stężeniu rosnącym liniowo wraz z kierunkiem migracji
białek. Stosowane do rozdziału białek o bardzo zróżnicowanych masach.
Rozdzielczość niższa niż żeli o odpowiednio dobranym stężeniu.

Elektroforezę w żelach poliakrylamidowych można
prowadzić w dwóch systemach:
- ciągłym – do przygotowania próbki, żelu i przeprowadzenia
elektroforezy stosuje się bufor o identycznym pH
Białka z próbki nie ulegają zatężeniu – konieczne nanoszenie na żel
próbek o niewielkiej objętości (jakość rozdziału zależy od „wysokości”
naniesionej próbki)
- Nieciągłym – stosuje się
dwa rodzaje żeli: zagęszczający i
rozdzielający
. Podczas elektroforezy próbka najpierw przechodzi przez
żel zagęszczający a później żel rozdzielający. W żelu zagęszczającym
białka ulegają „ściśnięciu” do bardzo wąskiego paska (~0,1 mm) –
wnikają w żel w tym samym czasie, dzięki czemu uzyskujemy bardzo
wyraźne i ostre prążki.

Odpowiednie dobranie warunków elektroforezy gwarancją
dobrego rozdziału
- Wzrost oporu elektrycznego w czasie elektroforezy – przegrzewanie żelu
– zaburzenia w rozdziale (tzw. uśmiechanie się żelu)
- Elektroforezę można prowadzić przy stałej wartości jednego z 3
parametrów:
natężenia, napięcia, mocy
Stałe natężenie – tempo migracji stałe, z czasem zwiększa się ilość
wydzielanego ciepła – ogrzewanie się żelu
Stałe napięcie – tempo migracji spada z czasem prowadzenia rozdziału,
zmniejsza się ilość wydzielanego ciepła – ogrzewanie żelu minimalne
Stała moc – tempo migracji spada z czasem, ilość wydzielanego ciepła
stała w czasie – grzanie żelu w mniejszym stopniu niż przy stałym
natężeniu
Najczęściej stosowana elektroforeza przy stałym natężeniu – krótszy czas
rozdziału. Wartość przyłożonego natężenia dostosowana do grubości żelu.

Elektroforeza w warunkach natywnych
- Elektroforeza w warunkach niedenaturujących w żelach
poliakrylamidowych
(Native PAGE)
- bufor do elektroforezy i bufor, w którym przygotowano białko
pozbawione substancji denaturujących (np. SDS, mocznik,
chlorowodorek guanidyny)
- pozwala analizować kompleksy białkowe, które w warunkach
denaturujących uległyby rozpadowi (zachowana aktywność
białek)
- tempo migracji białek zależy od:
- wielkości białka
- struktury przestrzennej
- sumarycznego ładunku elektrycznego,
-obecności związanych kofaktorów
- modyfikacji potranslacyjnych
- przewidywanie tempa migracji i analiza obrazu po elektroforezie
mogą być problematyczne
- przeprowadza się w układzie ciągłego i nieciągłego żelu

Najpowszechniej używane techniki natywnej
elektroforezy:
Blue Native PAGE (BN-PAGE) i Clear Native PAGE (CN-PAGE)
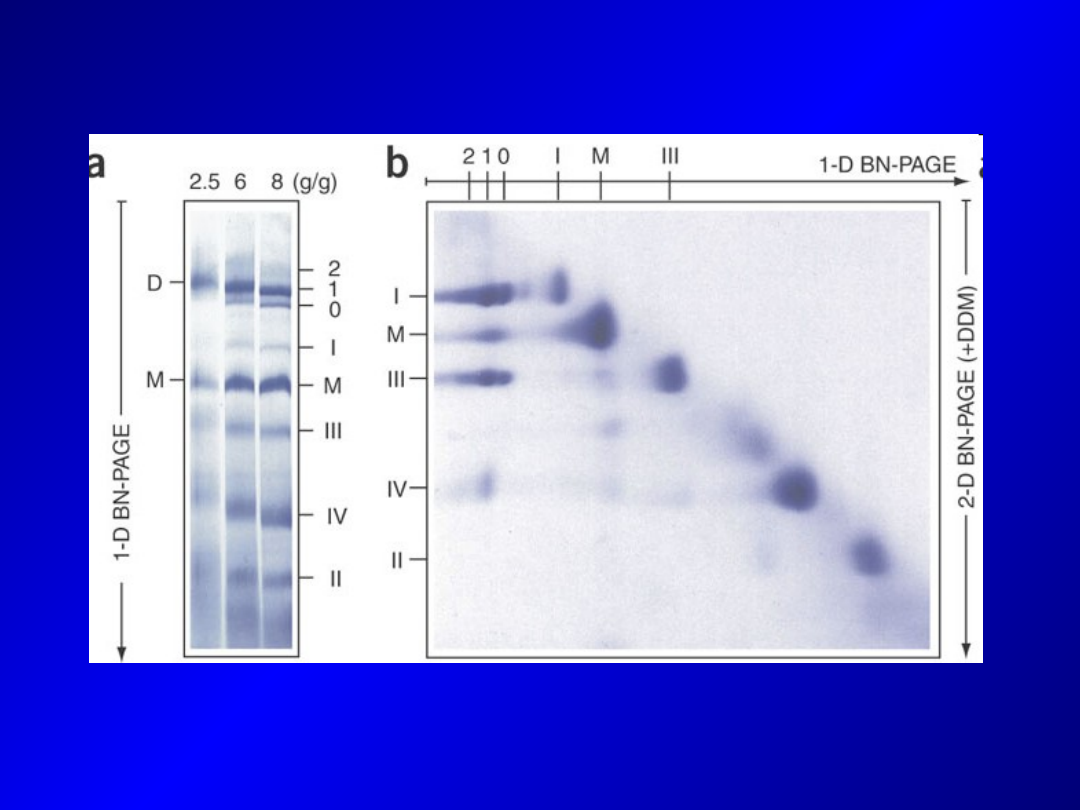
Blue Native PAGE (BN-PAGE)
- najstarsza technika natywnej elektroforezy białek
- wykorzystuje barwnik Coomassie Blue, który nadaje białkom
wypadkowy ładunek ujemny i uwidacznia ich migrację w żelu
- stosowana do analizy kompleksów białkowych o zachowanej
aktywności enzymatycznej
- tempo migracji zależy głównie od masy białek i ich konformacji
- po rozdziale możemy wyciąć prążek zawierający badany
kompleks, rozpuścić w buforze zawierającym SDS a uwolnione
białka rozdzielić techniką SDS-PAGE.
-
Wady:
- Coomassie Blue może w niektórych przypadkach działać jak
detergent – powodować dysocjację kompleksów białkowych i
hamować aktywność enzymatyczną
- Coomassie interferuje z niektórymi technikami detekcji
białek bazującymi na chmiluminescencji i fluorescencji

Najpowszechniej używane techniki natywnej
elektroforezy:
Blue Native PAGE (BN-PAGE)
i
Clear Native PAGE (CN-PAGE)
Clear Native PAGE (CN-PAGE)
- Nie wykorzystuje barwnika do nadawania białkom ładunku
elektrycznego – ograniczenie do rozdziału białek o pI poniżej pH
buforu (z reguły białka o pI<7)
-
pI (punkt izoelektryczny)
– wartość pH, przy której populacja
cząsteczek posiadających grupy funkcyjne mogące przyjmować
jednocześnie dodatni i ujemny ładunek elektryczny (np.
aminokwasy) zawiera średnio tyle samo ładunków dodatnich co
ujemnych, na skutek czego całkowity ładunek całej populacji
wynosi zero. W pI cząsteczki maja najmniejszą rozpuszczalność i
najmniejszą lepkość.
- tempo migracji silnie zależy od natywnego ładunku
elektrycznego
- brak detergentów – tendencja białek do agregacji – mniejsza
zdolność rozdzielcza
- w mniejszym stopniu niż BN-PAGE powoduje zaburzenia w
aktywności enzymatycznej analizowanych białek
- nie interferuje z dalszymi procedurami bazującymi na
chemiluminescencji i fluorescencji
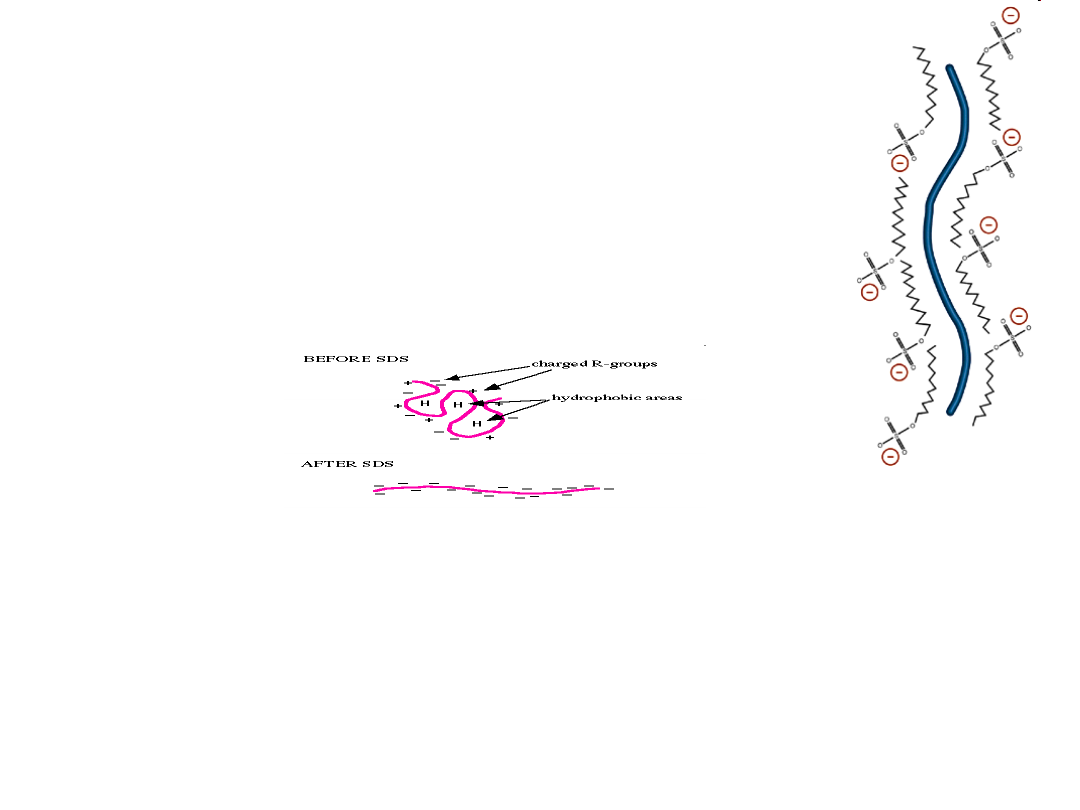
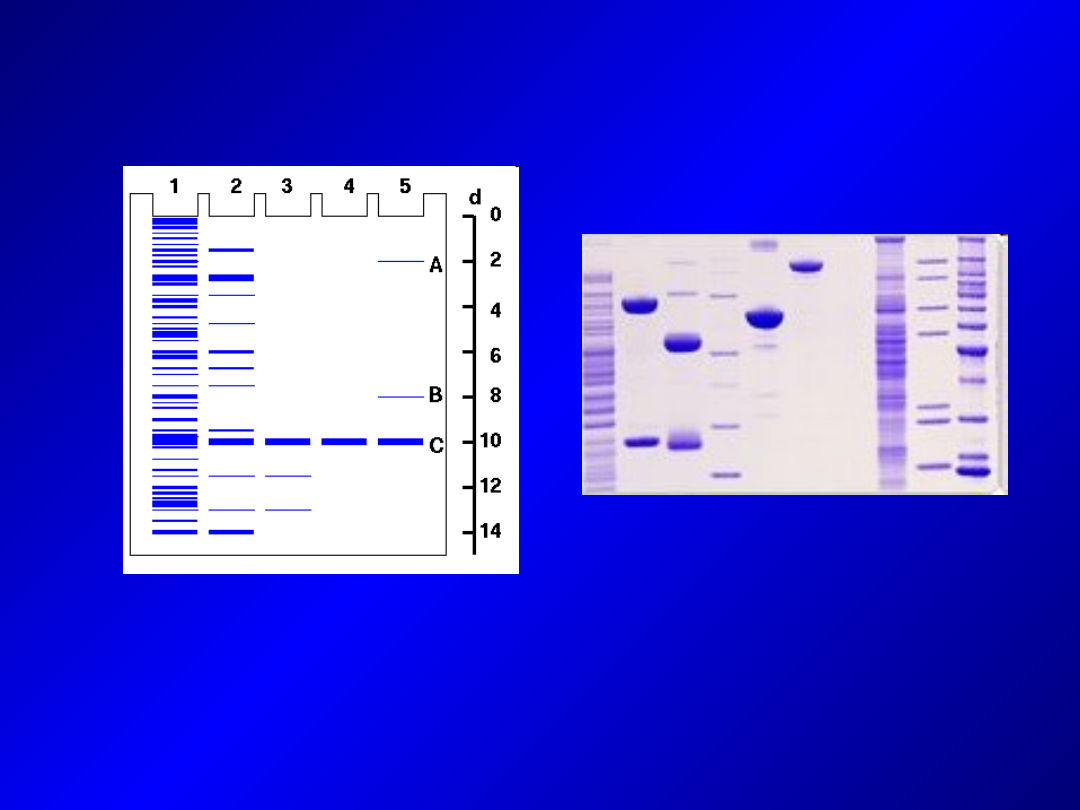
SDS-PAGE
- Najpowszechniej stosowana technika elektroforetycznego
rozdziału białek w żelach poliakrylamidowych w obecności
SDS (tzw. SDS-PAGE)
- SDS (siarczan dodecylu sodu) – silny detergent anionowy
– niszczy struktury białkowe wyższego rzędu – denaturuje
białka do postaci liniowej (struktura pierwszorzędowa) i nadaje
im wypadkowy ładunek ujemny
- jeden anion dodecylosiarczanowy przypada na dwie reszty
aminokwasowe
- środki denaturujące (np. 2-merkatoetanol, DTT) - redukują mostki
disiarczkowe
- tempo migracji białek jest zależne tylko od masy białka i wprost
proporcjonalne do jej logarytmu
- stosowane standardy wielkości białek – mieszanina kilku lub
kilkunastu białek o znanej masie (możliwe szacowanie masy
rozdzielanych białek – błąd szacowania 5-10%)
- rozdział techniką nieciągłego żelu
- bufor do elektroforezy – TRIS-glicyna (tzw. układ Leammli’ego); pH
żelu zagęszczającego 6,6; żelu rozdzielającego 8,8
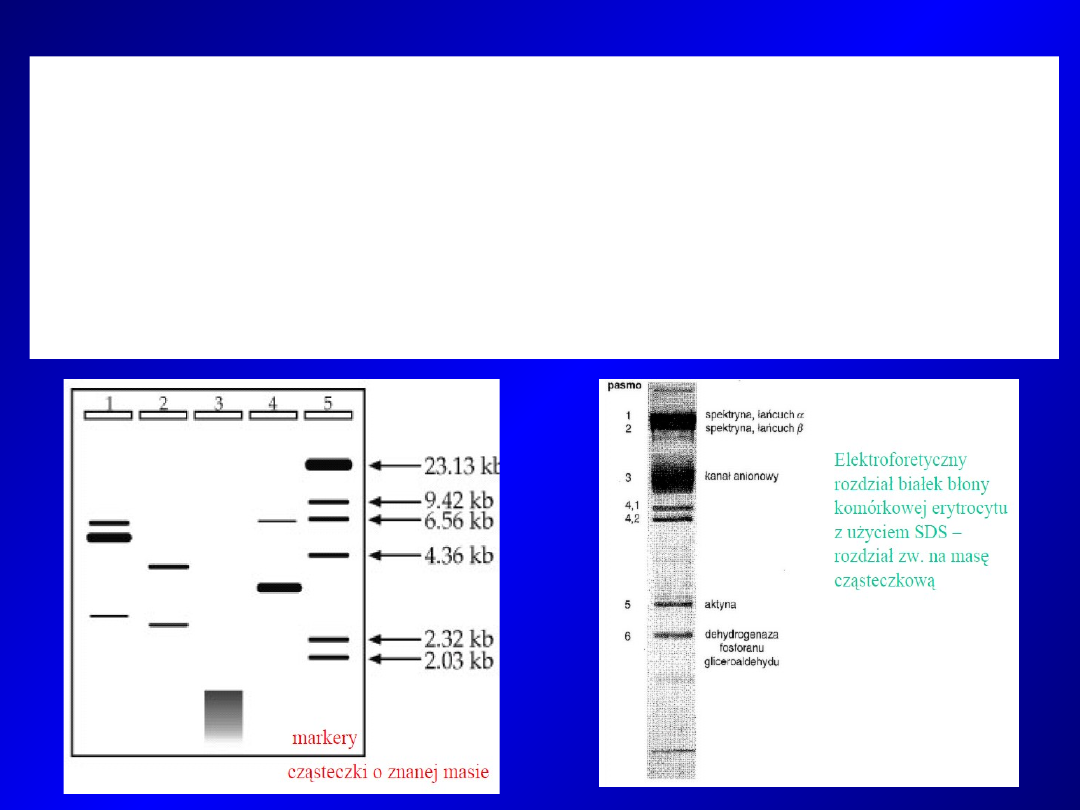
Obecność SDS przynosi szereg korzyści:
- zdecydowana większość białek jest rozpuszczalna w elektrolitach
zawierających SDS, szczególnie po redukcji mostków disiarczkowych
- separacja białek odbywa się zgodnie z ich masami cząsteczkowymi
- barwienia kompleksów białko-SDS jest znacznie wydajniejsze niż
samego białka
- obecność SDS skutecznie eliminuje enzymatyczną degradację białek w
trakcie separacji.

Żele mocznikowe
- Elektroforeza białek w żelach poliakrylamidowych w obecności
mocznika (
Urea-PAGE
) – technika denaturująca białka
- mocznik niszczy struktury białkowe wyższego rzędu, nie wpływa na
sumaryczny ładunek elektryczny białka – tempo migracji zależne od
masy i ładunku
- stosowana np. do rozdziału białek błonowych, które nie ulegają
rozpuszczeniu w obecności SDS
- modyfikacja metody –
AU-PAGE
(ang.Acidic Urea PAGE) –
elektroforeza białek w żelu poliakryamidowym w obecności mocznika
i kwasu octowego
- rozdział białek o właściwościach zasadowych (gł. histony)
- bufory do elektroforezy o niskim pH = 3 – białka występują w
formie protonowanej a wielkość wypadkowego dodatniego ładunku
elektrycznego zależy od ilości reszt aminokwasów zasadowych (gł.
arginin i lizyn)
- białka w postaci kationów (+) – rozdział w kierunku katody (-)
- w technice AU-PAGE tempo migracji zależy zarówno od ładunku jak
i masy białka
- czynnikami inicjującymi polimeryzację żeli mogą być układy
APS/TEMED (mało wydajny w niskim pH) lub
ryboflawina/TEMED
–
polimeryzacja indukowana przez promienie UV lub silne źródło
światła

Ogniskowanie izoelektryczne (IEF, ang.
Isoelectric
focusing
)
- Frakcjonowanie różnych cząsteczek na podstawie różnic w ich
ładunku elektrycznym/ zależnie od ich punktów izoelektrycznych
(pI)
- wykorzystuje rozdział w żelu poliakrylamidowym, w którym
umieszczono gradient pH między katodą a anodą, wywołany
elektrolizą amfoterycznych , syntetycznych związków buforowych
– amfolitów.
- Metoda ta wykorzystuje fakt, że ładunek cząsteczki zmienia się
wraz ze zmianą otaczającego pH. Białko znajdujące się w pH
niższym niż właściwy mu punkt izoelektryczny, przyjmuje ładunek
dodatni i wędruje w kierunku katody. Podczas tej migracji ładunek
maleje, do momentu gdy cząsteczka znajdzie się w regionie o pH
właściwym dla jej punktu izoelektrycznego. Wtedy jej ruch ustaje
(cząsteczka jest obojętna). W rezultacie poszczególne rodzaje
białek zostają skupione w postaci wyraźnych pasków w miejscach
pH odpowiadającego ich punktowi izoelektrycznemu.
- Amfolity – związki o niewielkiej masie cząsteczkowej (200-500), o
znacznej pojemności buforowej, dobrej rozpuszczalności w wodzie
i małej absorbcji w paśmie 260-280 nm (np. syntetyczne izomery i
homologi kw. poliaminopolikarboksylowych)
- elektroforeza białek za pomocą IEF zwykle w obecności dużych
stężeń mocznika i detergentów niejonowych, które umożliwiają
analizę białek trudnorozpuszczalnych (elektroforeza w warunkach
denaturujących)
- obecnie IEF przeprowadza się w komercyjnie dostępnych
immobilizowanych gradientach pH. Paski żelu dostarczane są w
formie zliofilizowanej (suche), które poddawane są rehydratacji
buforem zawierającym rozdzielane białka, amfolity, mocznik i
detergenty.
- IEF z zastosowaniem gotowych gradientów pH prowadzi się
zwykle przez 10 -36 godzin przy stałym napięciu 3000 – 8000 V.
Natężenie prądu jest bardzo niskie (nie przekracza 100 μA na
jeden pasek z gradientem)
-Technika charakteryzuje się wysoką rozdzielczością, jako, że
udaje się rozdzielić na odrębne paski białka różniące się zaledwie
o jeden ładunek. Ogniskowanie izoelektryczne występuje
prawdopodobnie w żywych komórkach. Fosforylacja i
defosforylacja cząsteczek powoduje zmiany ich punktu
izoelektrycznego i ruch w gradiencie pH, co staje się
prawdopodobnie siłą napędową transportu w komórce.

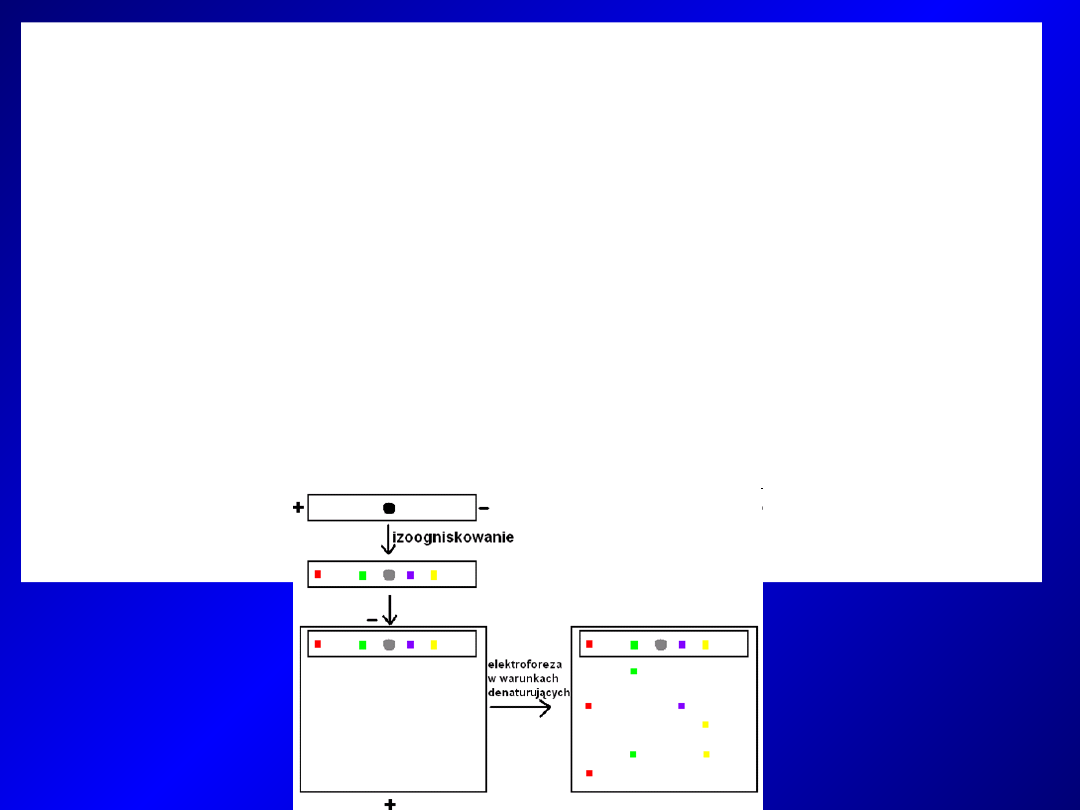
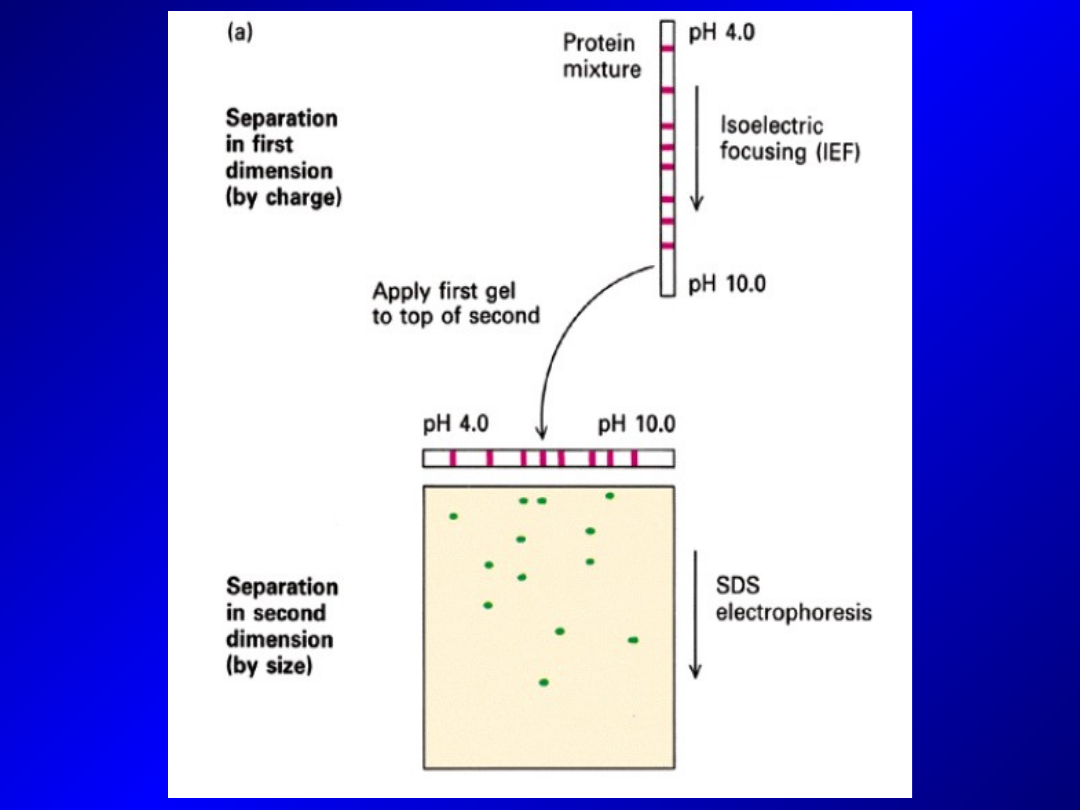
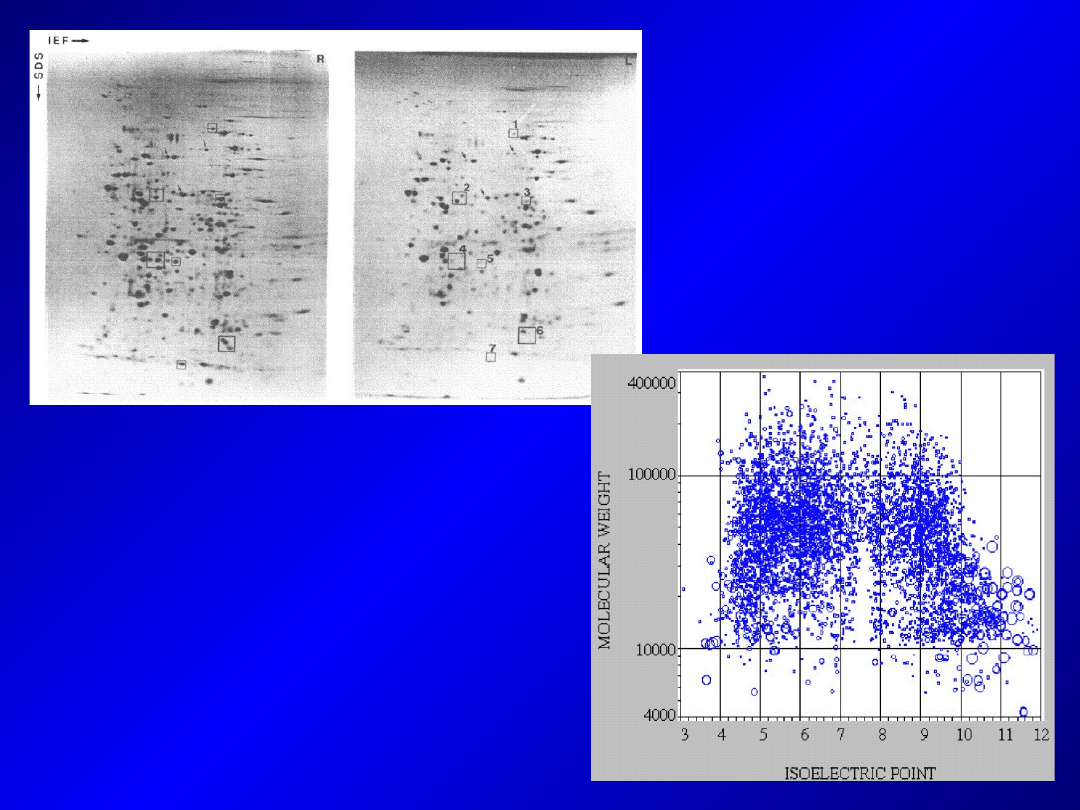
Elektroforeza dwuwymiarowa
(2-DE/2-D,
ang.Two-dimensional gel electrophoresis
)
- Pozwala na zwiększenie liczby białek skutecznie rozdzielanych i
uwidacznianych na żelu
- łączy dwie różne techniki rozdziału elektroforetycznego – białka
są rozdzielane najpierw przy pomocy jednej metody (pierwszy
kierunek). Następnie paski żelu z rozdzielonymi białkami są
łączone z drugim/innym żelem i na nim rozdzielane (drugi
kierunek)
- najczęściej stosowany rozdział białek pod względem pI
(
ogniskowanie izoelektryczne
) i rozdział w systemie
SDS-PAGE
- Wykorzystywane też do badania kompleksów białkowych –
rozdział
Blue/Clear Native PAGE
(rozdział całych kompleksów w
postaci niezdenaturowanej) i
SDS-PAGE
(rozdział w warunkach
denaturujących, kompleksy rozpadają się). Kompleksy białkowe
uwidocznione jako seria plamek. Białka proste jako pojedyncze
plamki.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
SPRAWOZDANIE ĆWICZENIE 6 elektronika na 8 05
Cwiczenie5 elektroliza
Cw Materialy do cwiczen z elektrot
zad5, Politechnika Poznańska, Mechatronika, Semestr 03, Elektrotechnika - ćwiczenia, Elektrotechnika
Zadania - ćwiczenia, Elektrostatyka, Zad
Nr ćwiczenia, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 10 Badanie
Konspekt do cwiczenia 2, Elektronika i Telekomunikacja, z PENDRIVE, Politechnika - EiT, 2011 2012 -
Instrukcja ćwiczenie 1 elektroliza ver2
Instrukcja do ćwiczenia, elektronika
26-mierniki cyfrowe, Ćwiczenia z elektrotechniki
24-elementy optoelektroniczne, Ćwiczenia z elektrotechniki
Instrukcja do ćwiczenia(6), elektronika
Instrukcja do ćwiczenia(5), elektronika
Instrukcja do ćwiczenia(4), elektronika
zad2, Politechnika Poznańska, Mechatronika, Semestr 03, Elektrotechnika - ćwiczenia, Elektrotechnika
zad4, Politechnika Poznańska, Mechatronika, Semestr 03, Elektrotechnika - ćwiczenia, Elektrotechnika
Źródła napięciowe i prądowe, Energetyka I stopień PŚk, sem1 Elektrotechnika, ćwiczenia elektrotechni
więcej podobnych podstron