Alergia Astma Immunologia, 1996, 1, 35-40
35
Cytokiny stosowane jako leki
TADEUSZ ROBAK
Klinika Hematologii AM, Szpital im. M. Kopernika 93-513 £ód ul. Pabianicka 62
Cytokinami okrela siê hormonopodobne peptydy
i drobnocz¹steczkowe bia³ka warunkuj¹ce wzajemne
oddzia³ywanie komórek. Najwa¿niejsz¹ ich funkcj¹ jest
regulacja wzrostu i ró¿nicowania ró¿nych komórek w ustroju.
Wytwarzaj¹ je g³ównie komórki uk³adu odpornociowego,
zw³aszcza aktywowane limfocyty i makrofagi.
Wiêkszoæ cytokin mo¿na obecnie uzyskaæ w du¿ych
ilociach za pomoc¹ rekombinacji odpowiednich genów.
Umieszczenie tych genów w bakteriach (Escherichia coli),
dro¿d¿ach lub komórkach jajników chomika umo¿liwia
produkcjê w dowolnych ilociach po¿¹danych cytokin
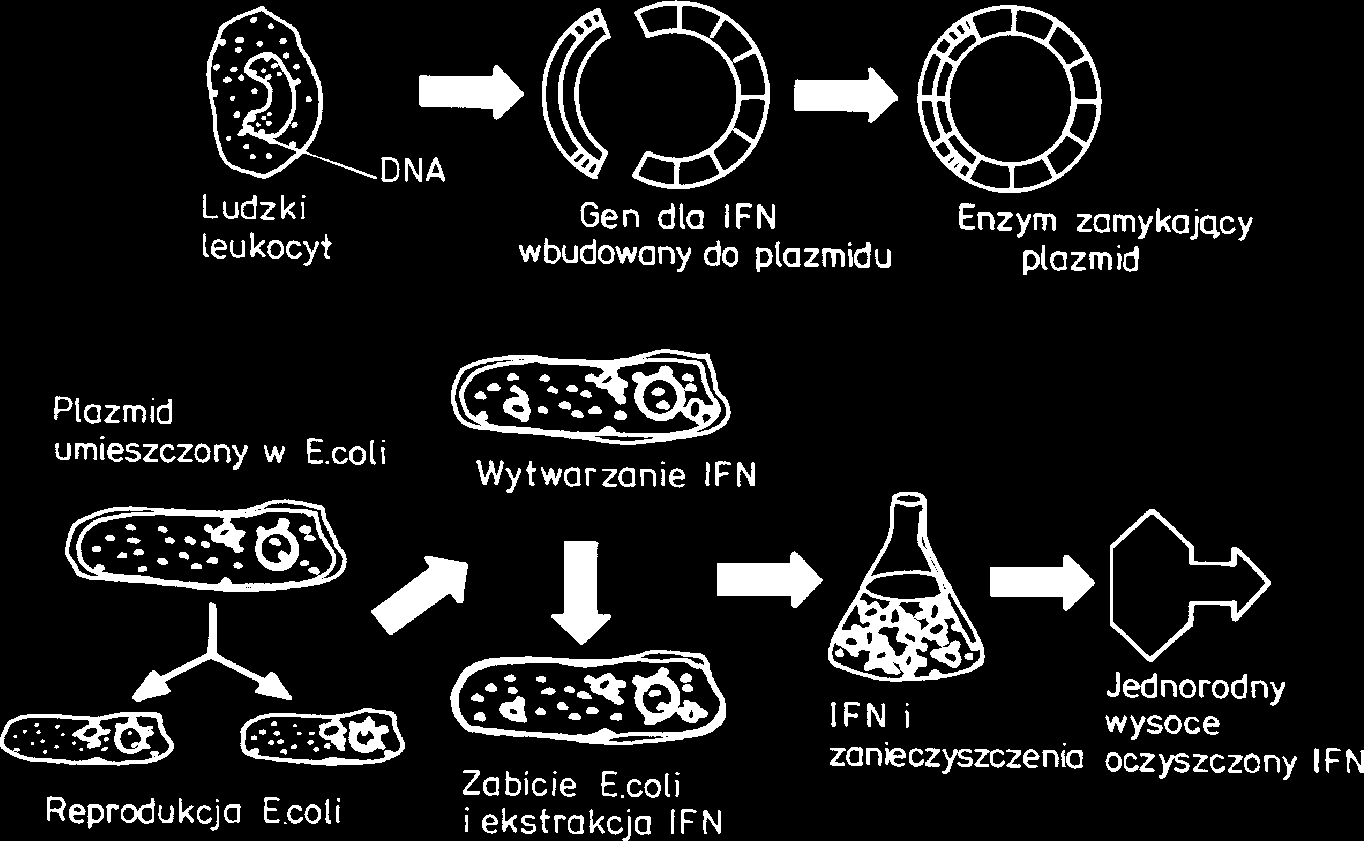
(Ryc. 1). Uznan¹ wartoæ jako leki maj¹ obecnie
interferony, niektóre krwiotwórcze czynniki wzrostu Ryc. 1. Metoda wytwarzania rekombinowanego IFN-α [1]
i interleukina-2 (IL-2) (tab. I).
Inne cytokiny, jak czynnik martwicy nowotworów-α Interferon-α (IFN-α)
(TNF-α), trombopoetyna (TPO), interleukina-3 (IL-3)
i interleukina-11 (IL-11) s¹ poddawane intensywnym
Rekombinowane IFN-α s¹ jednorodnymi bia³kami,
badaniom klinicznym i byæ mo¿e ju¿ wkrótce znajd¹ a ich stopieñ czystoci wynosi oko³o 95%. W 1 mg bia³ka szersze zastosowanie w terapii. Obecnie g³ównymi znajduje siê 250 mln j.m. Zawieraj¹ one 166
wskazaniami do leczenia cytokinami s¹ niektóre choroby aminokwasów i ró¿ni¹ siê pomiêdzy sob¹ rodzajem nowotworowe i infekcyjne oraz ró¿ne stany niewydolnoci aminokwasu w pozycji 24. W Roferonie A jest to lizyna, hematopoezy.
a w Intronie−A arginina. Naturalny ludzki IFN-α
(Wellferon) jest otrzymywany z ludzkich komórek
limfoblastoidalnych, stymulowanych wirusem Sendai
Tabela I. Cytokiny zarejestrowane jako leki [2]
i stanowi mieszaninê ró¿nych podtypów IFN-α. Wszystkie
Cytokiny
Preparaty dostêpne komercyjnie
preparaty IFN-α maj¹ podobne wskazania i s¹ stosowane
w leczeniu niektórych nowotworów i przewlek³ego
Interferon-α (IFN-α)
Intron A (Schering Plough)
Roferon A (Hoffmann La Roche)
wirusowego zapalenia w¹troby (tab. II) [2,3,4].
Wellferon (Glaxo Wellcome)
Wp³yw IFN-α na komórki nowotworowe jest zarówno
Interferon-β (IFN-β)
Betaseron (Berlex Laboratories Inc.)
bezporedni jak i poredni. Lek ten hamuje aktywnoæ
Interferon-γ (IFN-γ)
Imukin (Boehringer Ingelheim)
syntetazy 2-5 oligoadenylowej i moduluje onkogeny
Interleukina-2 (IL-2)
Proleukin (Chiron)
Erytropoetyna alfa
Eprex (Cilag Jansen)
komórkowe, zw³aszcza c-myc, c-fos i c-H ras,
(EPO-α)
Epogen (Amgen)
a w konsekwencji wyd³u¿a cykl podzia³owy. Ponadto
Procrit (Ortho Biotech)
wywo³uje deplecjê metabolitów niezbêdnych dla
Erytropoetyna beta
Recormon (Boehringer Mannheim)
podzia³ów komórkowych i hamuje aktywacjê
(EPO-β)
dekarboksylazy ornitynowej. Poredni wp³yw IFN na
Czynnik stymuluj¹cy
Neupogen (Hoffmann La Roche)
kolonie granulocytarne Granocyte (Rhone Poulenc)
komórki nowotorowe jest nastêpstwem jego dzia³ania
(G-CSF)
immunomoduluj¹cego.
Czynnik stymuluj¹cy
Leucomax (Schering Polough/Sandoz)
Pierwszym ustalonym wskazaniem onkologicznym do
kolonie granulocytarno-
stosowania IFN-α by³a bia³aczka w³ochatokomórkowa.
-makrofagowe
(GM-CSF)
Wieloorodkowe badania wskazuj¹, ¿e cytokina ta, mimo
i¿ umo¿liwia uzyskanie odpowiedzi u 80-90% chorych,
36
Robak T. Cytokiny stosowane jako leki
Tabela II. Ustalone i nie potwierdzone wskazania do stosowania IFN-α
Wskazania potwierdzone w randomizowanych
Wskazania nie potwierdzone
badaniach klinicznych
1. Przewlek³a bia³aczka szpikowa
1. Nadp³ytkowoæ samoistna
2. Bia³aczka w³ochatokomórkowa
2. Czerwienica prawdziwa
3. Szpiczak mnogi
3. Samoistna mielofibroza w fazie proliferacyjnej
4. Ch³oniaki nieziarnicze o ma³ym
4. T-komórkowa bia³aczka/ch³oniak doros³ych
stopniu z³oliwoci
5. T-komórkowe ch³oniaki skórne
5. K³ykciny koñczyste
6. Samoistna mieszana krioglobulinemia typu II
6. Brodawczaki krtani
7. Uk³adowa mastocytoza
7. Przewlek³e zapalenie w¹troby typu B
8. Zespó³ hipereozynofilowy
8. Przewlek³e zapalenie w¹troby typu C
9. Rak nerki
10. Czerniak z³oliwy
11. Rak jelita grubego
12. Rak jajnika
13. Neuroendokrynne nowotwory z³oliwe przewodu pokarmowego
to tylko u 5% prowadzi do ca³kowitej remisji. w fazie przewlek³ej IFN-α ¿yj¹ d³u¿ej ni¿ chorzy leczeni U pozosta³ych 70-80% jest to remisja czêciowa, busulfanem.
z normalizacj¹ liczby krwinek czerwonych, neutrofilów Pewne kontrowersje budzi natomiast wiêksza skutecznoæ i p³ytek oraz zmniejszeniem liczby komórek w³ochatych IFN-α od hydroksymocznika. Lek stosuje siê w dawce we krwi. Obecnie lekiem z wyboru w tej bia³aczce jest 3-10 mln j./dobê, a¿ do uzyskania remisji hematologicznej, 2-chlorodeoksydenozyna (2-CdA), która umo¿liwia a nastêpnie co drugi dzieñ w dawce pozwalaj¹cej utrzymaæ uzyskanie ca³kowitej remisji i prawdopodobnie wyle- liczbê krwinek bia³ych na poziomie 2-4x109/l. Jeli po czenie ju¿ po 5-7-dniowym cyklu leczenia.
6 miesi¹cach stosowania IFN-α uzyska siê remisjê
G³ównym wskazaniem onkohematologicznym do hematologiczn¹, a zw³aszcza cytogenetyczn¹, leczenie stosowania IFN-α jest obecnie przewlek³a bia³aczka nale¿y kontynuowaæ przez 12-18 miesiêcy, a nawet d³u¿ej.
szpikowa (PBS), charakteryzuj¹ca siê obecnoci¹
IFN-α wykazuje aktywnoæ terapeutyczn¹ w samo-
chromosomu Philadelphia (Ph1). Zarówno preparat istnej mielofibrozie, czerwienicy prawdziwej i nadp³yt-naturalny jak i postacie rekombinowane umo¿liwiaj¹ kowoci samoistnej. Jednak¿e celowoæ jego stosowania uzyskanie w fazie przewlek³ej choroby remisji w tych chorobach nie zosta³a dotychczas potwierdzona w hematologicznej u 70-80% leczonych i czêciowej lub randomizowanych badaniach klinicznych. W szpiczaku ca³kowitej remisji cytogenetycznej, polegaj¹cej na mnogim leczenie IFN-α jest celowe po wczeniejszej eliminacji klonu Ph1- dodatniego u 20-30% chorych [5,6]. redukcji masy guza lekami cytostatycznymi. Przemawiaj¹
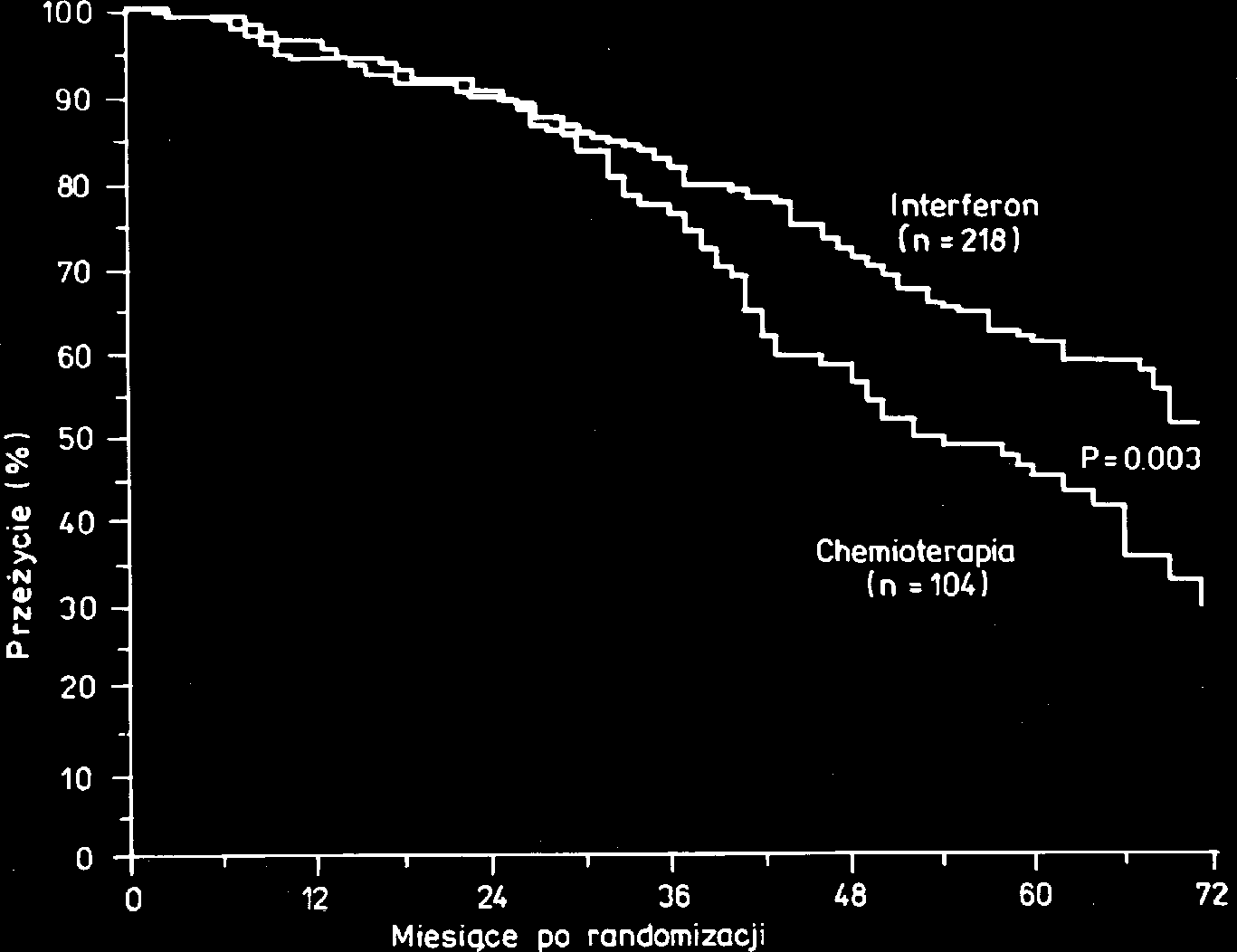
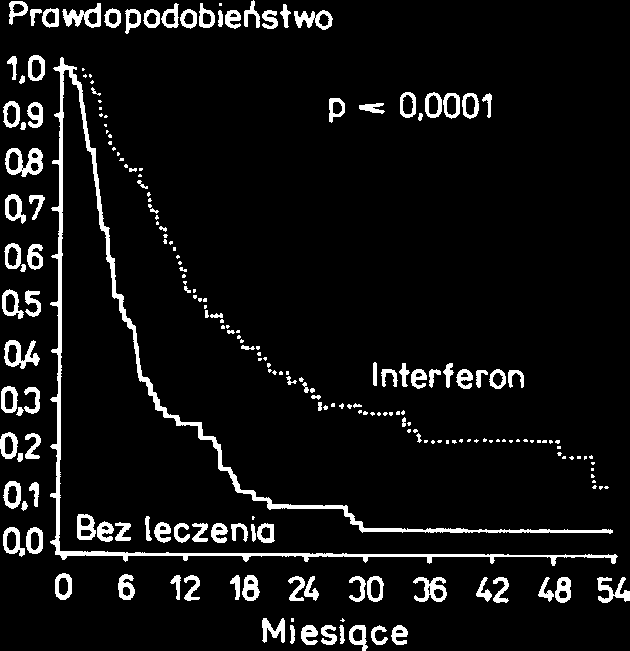
Wyniki przeprowadzonych ostatnio randomizowanych za tym wyniki randomizowanych badañ, które wykaza³y badañ klinicznych wskazuj¹, ¿e IFN-α umo¿liwia d³u¿sze d³u¿szy czas trwania remisji i d³u¿szy czas prze¿ycia prze¿ycie chorych ni¿ konwencjonalna chemioterapia chorych, u których po konwencjonalnej chemioterapii (Ryc. 2). Badania te dowodz¹, ¿e chorzy na PBS leczeni stosowano IFN-α ni¿ u chorych nie leczonych podtrzymuj¹co (ryc. 3) [7,8].
IFN-α ma aktywnoæ terapeutyczn¹ w ch³o-niakach
nieziarniczych o ma³ym stopniu z³oliwoci
i T-komórkowych ch³oniakach skórnych u 30-50%
chorych, jeli jest stosowany w monoterapii. Bardziej
celowe jest jednak jego kojarzenie z cytostatykami.
Zachêcaj¹ce s¹ równie¿ próby stosowania tej cytokiny
w samoistnej mieszanej krioglobulinemii typu II,
zaliczanej do nowotworów uk³adu ch³onnego o ma³ym
stopniu z³oliwoci. Ca³kowit¹ remisjê obserwowano u
po³owy chorych, a u pozosta³ych znaczn¹ poprawê [9].
Sporód nowotworów niehematologicznych IFN-α ma
wiêksz¹ aktywnoæ terapeutyczn¹ w raku nerki i czerniaku
z³oliwym [1]. Odpowied na leczenie obserwowano
u 15-40% chorych, g³ównie w mniej zaawansowanych
Ryc. 2. Prze¿ycie chorych na przewlek³¹ bia³aczkê szpikow¹ postaciach choroby i po zastosowaniu wiêkszych dawek leczonych IFN-α lub otrzymuj¹cych konwencjonaln¹ preparatu (10-100 mln j./dobê).
chemioterapiê [7]
Robak T. Cytokiny stosowane jako leki
37
cebo. Podobne wyniki uzyskiwano po podskórnym
stosowaniu leku. Objawy niepo¿¹dane s¹ podobne jak
u chorych leczonych IFN-α.
Interferon-γ (IFN-γ)
IFN-γ wywiera dzia³anie immunomoduluj¹ce,
przeciwwirusowe, przeciwnowotworowe i antypro-
liferacyjne [1]. Ustalonym wskazaniem do jego stosowania
jest przewlek³a choroba ziarniniakowa. Choroba ta jest
uwarunkowana genetycznie i ma zwi¹zek z upoledzon¹
zdolnoci¹ fagocytów do zabijania bakterii. IFN-γ
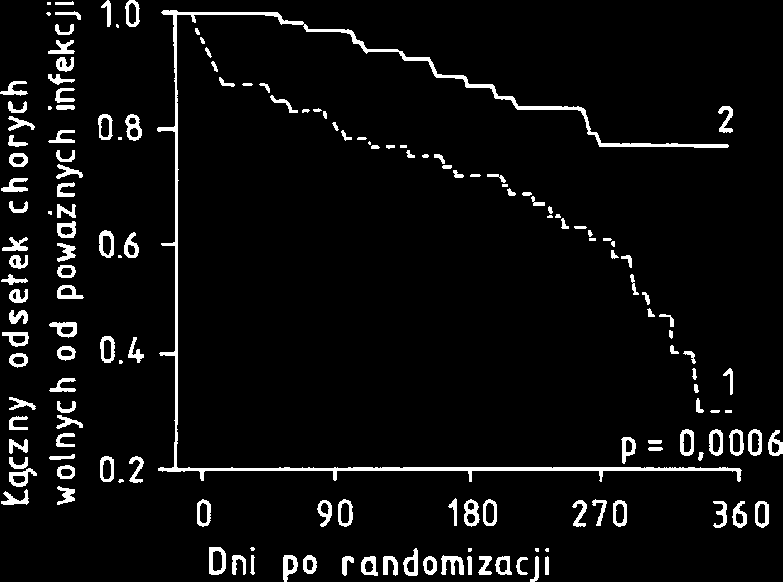
zwiêksza wytwarzanie O -2 w granulocytach i zapobiega
Ryc. 3. Czas trwania remisji (fazy plateau) u chorych leczo- wystêpowaniu ciê¿kich infekcji. W wieloorodkowych, nych IFN-α po wczeniejszym stosowaniu chemioterapii [7] kontrolowanych badaniach klinicznych wykazano, ¿e stosowanie tej cytokiny w dawce 50 µg/m2 3 razy
w tygodniu znacznie zmniejsza czêstoæ wystêpowania
IFN-α znalaz³ szerokie zastosowanie w leczeniu ciê¿kich zaka¿eñ w porównaniu z grup¹ otrzymuj¹c¹ pla-przewlek³ego zapalenia w¹troby (PZW) typu B i C [3]. cebo (rys. 4) [12]. W chorobie tej IFN-γ jest skutecznym W wieloorodkowych badaniach klinicznych wykazano, i bezpiecznym lekiem, nawet jeli jest stosowany przez
¿e stosowanie u chorych na PZW typu B IFN-α (Intron A) okres 3 lat [13].
podawanego w dawce 1 lub 5 mln j./dobê przez 4 miesi¹ce
prowadzi do ca³kowitej remisji odpowiednio u 25% i 46%
leczonych [10]. Lek jest bardziej skuteczny u chorych
doros³ych p³ci ¿eñskiej, u których przed leczeniem
stwierdza siê du¿¹ aktywnoæ aminotranferazy alaninowej
i ma³e stê¿enie DNA-HBV w surowicy oraz brak objawów
niewydolnoci w¹troby. Gorsz¹ odpowied obserwuje siê
natomiast w przypadku wspó³istnienia zaka¿enia wirusem
HIV i wirusem zapalenia w¹troby typu delta (HDV) oraz
u homoseksualistów. Skutecznoæ IFN-α w PZW-C jest
podobna jak w PZW-B jeli w ocenie uwzglêdnia siê
odsetek remisji. Czas ich trwania jest jednak stosunkowo
krótki i po 24 tygodniach od zakoñczenia leczenia u po³owy
leczonych wystêpuje nawrót choroby [10]. W obydwu
typach PZW bardziej skuteczne s¹ wiêksze dawki leku. Ryc. 4. Skutecznoæ IFN-γ w zapobieganiu powa¿nym Trwa³¹ reakcjê obserwuje siê wówczas u 20-30% chorych. infekcjom u chorych na przewlek³¹ chorobê ziarniniakow¹, Najczêstszym objawem niepo¿¹danym u chorych 1 - chorzy otrzymuj¹cy placebo; 2 - chorzy leczeni IFN-γ
leczonych IFN-α jest zespó³ grypopodobny, z³e samo-
poczucie, brak apetytu, nudnoci, wymioty i biegunki.
W badaniach na mniejszych grupach chorych
Wiêksze dawki leku dzia³aj¹ toksycznie na orodkowy obserwowano skutecznoæ IFN-α u chorych uk³ad nerwowy, wywo³uj¹c zawroty g³owy, zaburzenia z mononukleoz¹ zakan¹ i w przewlek³ym zaka¿eniu orientacji, depresjê i tendencje samobójcze.
wirusem Epsteina-Barr, w lepromatycznej postaci tr¹du
i w leishmaniozie [1].
Interferon-β (IFN-β)
W chorobach nowotworowych IFN-γ jest na ogó³
mniej skuteczny ni¿ IFN-γ. Dotychczas wykazano jego
IFN-β ma podobn¹ aktywnoæ biologiczn¹ do IFN-α. kliniczn¹ aktywnoæ w raku nerki i jajników. Uzyskano Obydwie cytokiny dzia³aj¹ na komórki docelowe za równie¿ obiecuj¹ce wyniki w chorobach o pod³o¿u porednictwem tych samych receptorów [1]. G³ównym immunologicznym, zw³aszcza w reumatoidalnym wskazaniem do stosowania IFN-β jest obecnie zapaleniu stawów i atopowym zapaleniu skóry [1,14].
stwardnienie rozsiane (SM) [11]. W wieloorodkowych
randomizowanych badaniach wykazano, ¿e zaostrzenia Interleukina-2 (IL-2)
choroby wystêpuj¹ dwukrotnie rzadszej u chorych
otrzymuj¹cych IFN-β dokana³owo, dziesiêciokrotnie
IL-2 jest czynnikiem wzrostowym limfocytów T.
w okresie 6 miesiêcy ni¿ u chorych otrzymuj¹cych pla- Rekombinowana cytokina mo¿e byæ stosowana w leczeniu
Robak T. Cytokiny stosowane jako leki
nowotworów, zw³aszcza raka nerki, czerniaka i niektórych podawano najczêciej w dawce 150 µg/m2 przez 5 dni, nowotworów uk³adu krwiotwórczego [15]. Pocz¹tkowo a cykle powtarzano co 2 tygodnie [19]. Czêciow¹ remisjê podejmowano próby jej wykorzystania w tzw. adoptywnej obserwowano tylko u pojedyñczych chorych z rakiem jelita immunoterapii, w której podawano chorym inkubowane grubego i rakiem nerki.
z IL-2 autologicznie limfocyty z krwi obwodowej (komórki
Wiêksz¹ skutecznoæ i mniejsz¹ toksycznoæ mo¿na
LAK) lub guza nowotworowego (komórki TIL). Okaza³o uzyskaæ po podaniu preparatu doguzowo lub siê jednak, ¿e znacznie prostsze i nie mniej skuteczne jest dootrzewnowo [19]. Po stosowaniu miejscowym leczenie sam¹ IL-2, podawan¹ do¿ylnie, domiêniowo lub obserwowano ca³kowit¹ remisjê u chorych z glejakiem podskórnie. W przerzutowym raku nerki IL-2 umo¿liwia mózgu i przerzutowym czerniakiem. Znaczna toksycznoæ uzyskanie wiêkszego odsetka remisji i d³u¿szego ich trwania TNF-α objawiaj¹ca siê g³ównie gor¹czk¹, dreszczami, ni¿ IFN-α [16]. Odsetek remisji wynosi oko³o 20%, a czas bólami miêniowymi i objawami brzusznymi sprawia, ¿e ich trwania od 6 do ponad 62 miesiêcy.
TNF-α nie zosta³ dotychczas zarejestrowany jako lek.
W czerniaku z³oliwym monoterapia IL-2 prowadzi
do uzyskania oko³o 15% odpowiedzi lecz tylko u oko³o Czynniki stymuluj¹ce kolonie (G-CSF i GM-CSF) 3% chorych jest to remisja ca³kowita. Wyniki wstêpnych
badañ wskazuj¹, ¿e bardziej celowe jest kojarzenie IL-2
Opracowanie metod hodowli komórek krwio-
z cytostatykami, zw³aszcza z karmustyn¹, dakarbazyn¹ twórczych in vitro przyczyni³o siê do identyfikacji cytokin, i cisplatyn¹. Optymalny dobór leków i ich dawek nie zosta³ które stymuluj¹ hematopoezê. Czynnik stymuluj¹cy dotychczas ustalony [15].
kolonie granulocytarne (G-CSF) i granulocytarno-
Obiecuj¹ce wyniki obserwowano u chorych na ostre makrofagowe (GM-CSF) maj¹ obecnie uznan¹ wartoæ bia³aczki, zw³aszcza ostr¹ bia³aczkê szpikow¹ (OBS). w stymulacji granulopoezy [21]. G-CSF pobudza W OBS stwierdzono ca³kowit¹ remisjê po zastosowaniu proliferacjê i zró¿nicowanie ukierunkowanych komórek IL-2 w dawce 900 mg/m2/dobê lub 18x106 j./m2/dobê szeregu granulocytarno-makrofagowego (CFU-GM).
przez 5 dni a¿ u 8 sporód 14 chorych opornych na konwen- GM-CSF wywiera ponadto pobudzaj¹cy wp³yw na cjonaln¹ chemioterapiê lub w nawrocie choroby [17]. Czas wielopotencjalne komórki macierzyste (CFU-GEMM) trwania remisji wynosi³ od 14 do 68 miesiêcy (rednio i prekursory erytrocytów (BFU-E) oraz megakariocytów 32 miesi¹ce). Wstêpne badania wskazuj¹, ¿e IL-2 mo¿e (CFU-MK). Obydwa czynniki wp³ywaj¹ na dojrza³e mieæ znaczenie w eliminowaniu bia³aczki resztkowej po granulocyty i monocyty/makrofagi, warunkuj¹c ich przeszczepieniu autologicznego szpiku. U chorych prawid³owe funkcjonowanie, w tym fagocytozê otrzymuj¹cych cytokinê odsetek nowotworów po mikroorganizmów i ich niszczenie. Uznane i potencjalne 18-miesiêcznym okresie obserwacji wynosi³ 29%, wskazania do stosowania krwiotwórczych czynników a u chorych nie otrzymuj¹cych tego leku 64% [15].
wzrostu zestawiono w tabeli III.
Tolerancja IL-2 zale¿y od dawki i drogi podania.
Najczêciej obserwuje siê objawy grypopodobne i zespó³ Tabela III. Kliniczne zastosowanie G-CSF i GM-CSF
zwiêkszonej przepuszczalnoci naczyñ (capillary leak syn-
drome), charakteryzuj¹cy siê hipotoni¹, uogólnionymi 1. Stymulacja granulopoezy we wrodzonych i nabytych obrzêkami, zwiêkszeniem masy cia³a, dusznoci¹, oliguri¹
neutropeniach
i zwiêkszeniem stê¿enia kreatyniny w surowicy.
2. Leczenie niedokrwistoci aplastycznej i zespo³ów
mielodysplastycznych
Czynnik martwicy nowotworów-α (TNF-α)
3. £agodzenie neutropenii wywo³anej chemioterapi¹ lub
radioterapi¹
TNF-α jest cytokin¹ o w³aciwociach przeciw- 4. Stymulacja mielopoezy po przeszczepieniu szpiku 5. Zwiêkszenie liczby komórek hematopoetycznych we krwi
nowotworowych i immunomoduluj¹cych. Badania
przed ich pobraniem do autoprzeszczepu.
dowiadczalne i obserwacje kliniczne wskazuj¹, ¿e
cytokina ta wywiera wp³yw cytotoksyczny na wiele linii
nowotworowych in vitro, a tak¿e na komórki uzyskane
G-CSF zwiêksza liczbê zaka¿eñ i zapotrzebowanie
bezporednio od chorych [18]. Przypuszcza siê jednak, ¿e na antybiotyki u dzieci z zespo³em Kostmanna [21].
g³ówny mechanizm przeciwnowotworowego dzia³ania tej W chorobie tej GM-CSF jest nieskuteczny. Obydwa cytokiny in vivo polega na wywo³aniu martwicy czynniki s¹ natomiast przydatne w leczeniu samoistnej krwotocznej guzów, wzrastaj¹cych w postaci litej.
i cyklicznej neutropenii oraz agranulocytozy polekowej,
Aktywnoæ przeciwnowotorow¹ TNF-α badano jeli choroby te s¹ powik³ane ciê¿kimi zaka¿eniami.
zarówno na zwierzêtach jak i u ludzi. Badania te wykaza³y
W niedokrwistoci aplastycznej krwiotwórcze
stosunkowo ma³¹ skutecznoæ i znaczn¹ toksycznoæ czynniki wzrostu zwiêkszaj¹ wytwarzanie dojrza³ych TNF-α jeli by³ on stosowany do¿ylnie. Preparat komórek krwi i zmniejszaj¹ ryzyko zgonu, zw³aszcza
Robak T. Cytokiny stosowane jako leki
39
we wczesnej fazie choroby. G-CSF, GM-CSF i IL-2 Tabela IV. Ustalone i potencjalne wskazania do stosowania zwiêkszaj¹, najczêciej przejciowo, liczbê neutrofilów, EPO [30]
a u niektórych chorych liczbê krwinek czerwonych
i p³ytek [1]. Nie wp³ywaj¹ natomiast na uzyskanie I. Wskazania ustalone
trwa³ych remisji i dlatego nie mog¹ zast¹piæ przeszczepu
1. Niedokrwistoæ w przewlek³ej niewydolnoci nerek
szpiku lub leczenia immunosupresyjnego (surowica II. Wskazania potencjalne
antylimfocytarna, cyklosporyna) [22].
1. Niedokrwistoæ wczeniaków
W zespo³ach mielodysplastycznych (MDS), G-CSF
2. Niedokrwistoci towarzysz¹ce chorobom przewlek³ym (ACD)
i GM-CSF zwiêkszaj¹ liczbê granulocytów we krwi
a) infekcje (AIDS)
i powoduj¹ poprawê ich funkcji, a w konsekwencji
b) przewlek³e stany zapalne (reumatoidalne zapalenie
zmniejszaj¹ czêstoæ zaka¿eñ. Podobnie jak w nie-
stawów)
dokrwistoci aplastycznej leki te nie powoduj¹ jednak
c) nowotwory
trwa³ej poprawy. Nie mo¿na ponadto wykluczyæ, czy
3. Zespo³y mielodysplastyczne i niedokrwistoæ aplastyczna
u niektórych chorych, zw³aszcza z wiêksz¹ liczb¹
4. Niedokrwistoæ po chemioterapii i po przeszczepieniu szpiku
blastów we krwi i w szpiku, leki te nie przyspieszaj¹
5. Autotransfuzje i przygotowanie do operacji chirurgicznych
pe³nej transformacji bia³aczkowej [23].
6. Hemoglobinopatie (niedokrwistoæ sierpowata).
Najczêstszym wskazaniem do stosowania krwio-
twórczych czynników wzrostu jest aplazja szpiku w dawce 50-150 j/kg podskórnie, 2 razy w tygodniu, z neutropeni¹, wywo³ana przez leki cytostatyczne lub zapotrzebowanie na przetaczanie krwi zmniejsza siê promienie jonizuj¹ce [24,25,26]. Czynniki te zwiêkszaj¹ dwukrotnie. Wykazano jednak, ¿e bardziej skuteczne s¹
tolerancjê leków przeciwnowotworowych, umo¿liwiaj¹ wiêksze dawki leku (500 j/kg/tydzieñ) [32].
zwiêkszenie ich dawek oraz skrócenie czasu miêdzy
Niedokrwistoæ chorób przewlek³ych (ACD)
kolejnymi cyklami chemioterapii. Skracaj¹ one równie¿ wystêpuje czêsto w przebiegu przewlek³ych zaka¿eñ, czas trwania neutropenii, zmniejszaj¹ liczbê dni stanów zapalnych i nowotworów. Wykazano, ¿e EPO
z gor¹czk¹ i skracaj¹ czas hospitalizacji chorych mo¿e byæ skuteczna w leczeniu ACD u chorych poddanych intensywnej chemioterapii.
z reumatoidalnym zapaleniem stawów, kolagenozami,
G-CSF i GM-CSF maj¹ du¿e znaczenie w postê- AIDS i nowotworami, zw³aszcza leczonymi
powaniu po przeszczepieniu szpiku kostnego [27,28]. cytostatykami [29].
U chorych tych skracaj¹ one czas trwania zagra¿aj¹cej
Sporód chorób uk³adu krwiotwórczego najwiêksz¹
¿yciu neutropenii i zmniejszaj¹ zapotrzebowanie na anty- skutecznoæ EPO obserwowano u chorych biotykoterapiê. Czynniki te zwiêkszaj¹ ponadto liczbê z niedokrwistoci¹ w przebiegu szpiczaka mnogiego komórek krwiotwórczych we krwi i s¹ stosowane przed i ch³oniaków nieziarniczych. Lek jest natomiast mniej ich pobieraniem do przeszczepów autologicznych [1].
skuteczny w MDS, niedokrwistoci aplastycznej i po
przeszczepieniu szpiku, choæ obserwowano zmniejszenie
Erytropoetyna (EPO)
stopnia niedokrwistoci równie¿ u chorych z tymi
zespo³ami [1,30].
Erytropoetyna jest wytwarzana g³ównie w nerkach,
Jeli EPO jest stosowana w konwencjonalnych
a jej wydzielanie reguluje stopieñ utlenowania krwi. dawkach, objawy toksyczne wystêpuj¹ stosunkowo Cytokina ta stymuluje proliferacjê i ró¿nicowanie rzadko. Do najczêstszych objawów niepo¿¹danych nale¿y prekursorów erytrocytów i megakariocytów [29]. zespó³ grypopodobny, rozpoznawany u oko³o 10%
Rekombinowana EPO jest lekiem z wyboru u chorych chorych. U oko³o 30% chorych z niewydolnoci¹ nerek z niedokrwistoci¹ w przebiegu przewlek³ej EPO wywo³uje nadcinienie têtnicze. Mo¿e równie¿
niewydolnoci nerek [30,31]. Wskazania do jej wyst¹piæ zwiêkszenie stê¿enia kreatyniny, mocznika stosowania w ostatnich latach uleg³y jednak znacznemu i potasu w surowicy.
rozszerzeniu (tab. IV) [30].
Obecnie zalecane dawki EPO u dializowanych Cytokiny zwiêkszaj¹ce liczbê p³ytek
chorych z przewlek³¹ niewydolnoci¹ nerek wynosz¹
35-50 j/kg trzy razy w tygodniu. Dawki takie powinny
Stymulacjê megakariocytopoezy i zwiêkszenie
doprowadziæ do powolnego, lecz istotnego zwiêkszenia liczby p³ytek wywo³uj¹ w najwiêkszym stopniu IL-1, wartoci hematokrytu w czasie 4-6 tygodni. Po up³ywie IL-6, IL-11 i trombopoetyna (TPO), lecz dotychczas tego okresu nale¿y tak ustaliæ dawkê, aby wartoæ ¿adna z tych cytokin nie zosta³a zarejestrowana jako lek hematokrytu wynosi³a od 30-34%. U chorych [1,34]. Wydaje siê ma³o prawdopodobne, aby szersze dializowanych EPO stosuje siê najczêciej do¿ylnie, zastosowanie terapeutyczne znalaz³y IL-1 i IL-6, ze natomiast u pozosta³ych chorych podskórnie. U znacznej wzglêdu na znaczn¹ toksycznoæ. Mo¿na natomiast wiêkszoci chorych z niewydolnoci¹ nerek leczenie przypuszczaæ, ¿e ju¿ wkrótce stan¹ siê komercyjnie EPO znosi ca³kowicie potrzebê przetaczania krwi.
dostêpne do leczenia ma³op³ytkowoci IL-11 i TPO.
U przedwczenie urodzonych noworodków mo¿e
IL-11 wp³ywa na szereg stadiów megakario-
rozwin¹æ siê niedokrwistoæ stanowi¹ca wskazanie do cytopoezy, ³¹cznie z wytwarzaniem i dojrzewaniem przetaczania krwi. U niemowl¹t otrzymuj¹cych EPO megakariocytów. Jej skutecznoæ w zwiêkszeniu liczby
Robak T. Cytokiny stosowane jako leki
p³ytek potwierdzono w badaniach klinicznych u chorych fragmentacj¹ i wytwarzaniem p³ytek [35]. Badania z ma³op³ytkowoci¹ wywo³an¹ chemioterapi¹ [34]. prowadzone zarówno na myszach jak i na ma³pach Cytokina ta wp³ywa ponadto korzystnie na gojenie siê wykaza³y, ¿e przyspiesza ona regeneracjê trombopoezy owrzodzeñ w przewodzie pokarmowym i odbudowê u zwierz¹t poddanych dzia³aniu promieni jonizuj¹cych struktury kosmków jelitowych, a poprzez to zmniejsza i cytostatyków. W I fazie badañ klinicznych ryzyko endogennych infekcji.
potwierdzono stymuluj¹cy wp³yw TPO na regeneracjê
TPO stymuluje proliferacjê prekursorów mega- megakariocytopoezy u ludzi i dobr¹ tolerancjê tego kariocytów i dojrzewanie megakariocytów, ³¹cznie z ich preparatu.
Pimiennictwo
1. Robak T.: Biologia i farmakologia cytokin. Wydawnictwo
18. Robak T., W³aciwoci biologiczne kachektyny (TFN) i jej
Naukowe PWN. Warszawa-£ód, 1995.
potencjalna rola w terapii. Post.Hig.Med.Dos. 1991, 45: 281-297.
2. Robak T.: Cytokines in the treatment of hematological disor-
19. Hiemer U., Heim M.E.: Tumor necrosis factor for the treatment
ders. Recent progress and perspectives. Arch.Immunol.Ther.
of malignancies. Oncology 1994, 51: 142-153.
Exp. 1996: 1-4.
20. Robak T., Krykowski E.: Kliniczne zastosowanie krwio-
3. Poor R.T.: Interferon-γ in malignant and viral disease. Drugs
twórczych czynników wzrostowych w leczeniu niewydolnoci
1993, 45: 177-211.
szpiku. Pol.Arch.Med.Wewn. 1994, 92: 1-8.
4. Di Biscegille A.M.: Interferon therapy for chronic viral hepati-
21. Frampton J.E., Lee C.R., Faulds D.: Filgrastim A review of its
tis N.Engl.J.Med. 1994, 330: 137-138.
pharmacological properties and therapeutic efficacy in
5. Wetzler M., Kantarjian H., Kurzrock R., Talpaz M.: Interferon-
neutropenia. Drugs 1994, 48: 731-760.
α therapy for chronic myleogenous leukemia. Am.J.Med. 1995,
22. Marsh J.C.W., Socie G., Schrezeumeier H. i wsp.: Hematopoietic
99: 402-411.
growth factors in aplastic anaemia: a cautionary note. Lancet
6. Italian Cooperative Study Group on Chronic Myleoid Leucemia:
1994, 344: 172-173.
Interferon alfa-2a compared with conventional chemotherapy
23. Ganser A., Seipelt G., Eder J. i wsp.: Treatment of
for the treatment of chronic myleoid leukemia. N.Engl.J.Med.
myelodysplastic syndromes with cytokines and cytotoxic drugs.
1994, 330: 820-825.
Semin.Oncol. 1992, 19, (supl. 4): 95-101.
7. Westin J., Rodjer S., Turesson I., Cortezi A., Hjorth M., Zador G.:
24. Robak T., Krykowski E., Warzocha K.: Effect of recombinant
Interferon alfa-2b versus no maintenance therapy during the
human granulocyte-macrophage colony-stimulating factor on
plateau phase in multiple myeloma: a randomized study. Br.J.
chemotherapy induced myelosupperssion. Arch.Immunol.Ther.
Hematol. 1995, 89: 561-568.
Exp. 1992, 40: 331-337.
8. Browman G.P., Bergsagel D., Sicheri D. i wsp.: Randomized
25. Robak T., Krykowski E., Warzocha K.: Treatment of chemo-
trial of interferon maintenance in multiple myeloma: A study of
therapy included or idiopathic bone marrow aplasia with
the National Cancer Institute of Canada Clinical Trials Group.
granulocyte colony-simulating factor (G-CSF). Arch.Immnol.
J.Clin.Oncol. 1995, 13: 2354-2360.
Ther.Exp. 1994, 42: 433-438.
9. Robak T.: Rola interferonów w leczeniu nowotworów uk³adu
26. Boogaerts M., Cavalli F., Cortes-Funes H. i wsp.: Granulocyte
krwiotwórczego. Pol.Tyg.Lek. 1994, 49: 307-310.
growth factors: Achieving a consensus. Ann.Oncol. 1995, 6:
10. Di Biscegille A.M.: Interferon therapy for chronic viral hepati-
237-244.
tis. N.Engl.J.Med. 1994, 330: 137-138.
27. Gisselbrecht C., Prentice H.G., Bacigalupo A. i wsp.: Placebo-
11. Panith H.S.: Interferons in multiple sclerosis. A review of the
controlled phase III trial of lenograstim in bone-marrow trans-
evidence. Drugs 1992, 44: 946-962.
plantation. Lancet 1994, 343: 695-698.
12. The International Chronic Granulomatous Disease Cooperative
28. Robak T.: Biologia i kliniczne zastosowanie GM-CSF. Acta
Study Group. A controlled trial of interferon gamma to prevent
Haematol.Pol. 1994, 25: 99-109.
infection in chronic granulomatous disease. N.Engl.J.Med. 1991,
29. Spivak J.: Recombinant human erythropoietin and the anemia
324: 509-516.
of cancer. Blood 1994, 84: 997-1004.
13. Weening R.S., Leiti G.J., Seger R.A.: Recombinant human inter-
30. Robak T.: Kliniczne zastosowanie erytropoetyny. Acta
feron-gamma in patients with chronic granulomatous disease.
Haematol.Pol. 1994, 25 (supl. 1).
European follow-up study. Eur.J.Red. 1995, 154: 295-298.
31. Erslew A.J.: Erythropoietin. N.Engl.J.Med. 1991, 324:
14. Hamifin J.M., Schneider L.C., Leung D.Y. i wsp.: Recombinant
1339-1344.
interferon gamma therapy for atopic dermatitis. J.Am.Acad.
32. Phibbs R.H., Shannon K.M., Metzer W.C.: Potential for treat-
Dermatol. 1993, 28: 189-197.
ment of anaemia of prematurity with recombinant human
15. Robak T., W³aciwoci biologiczne i zastosowanie lecznicze
erythropoietin: preliminary results. Acta Haematol. 1992, 87
interleukiny-2 (IL-2). Post.Hig.Med.Dos. 1995, 49: 367-393.
(supl. 1): 28-33.
16. Whittington R., Faulds D.: Interleukin-2. A review of its phar-
33. Robak T.: Cytokiny wp³ywaj¹ce na megakariocytopoezê. Acta
macological properties and therapeutic use in patients with can-
Haematol.Pol. 1996, 27 (w druku).
cer. Drugs 1993, 46: 446-514.
34. Kaushansky K.: Thrombopoietin: The primary regulator of plate-
17. Meloni G., Foa R., Vignetti M., Fenu S., Tosti S., Tos A.G.,
let production. Blood 1995, 86: 419-431.
Mandelli F.: Interleukin-2 may induce prolonged remissions in
35. Robak T. Biologia trombopoetyny i jej receptora. Post.Hig.
advanced acute myleogenous leukemia. Blood 1994, 84:
Med.Dow. 1996, 50 (w druku).
2158-2163.
Wyszukiwarka
Podobne podstrony:
Inhibitory enzymów jako leki, materiały medycyna SUM, biochemia, Kolokwium II
Analogi somatostatyny jako leki przeciwnowotworowe, medycyna, giełdy, interna1, interna j, endokryny
Inhibitory enzymAlw jako leki, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, II
Inhibitory enzymów jako leki, materiały medycyna SUM, biochemia, Kolokwium II
Witaminy jako leki
W15 SL W01 Hormony jako leki insulina i doustne leki przeciwcukrzycowe (Paulina)
W16 SL W02 Hormony jako leki hormony kory nadnerczy i hormony płciowe (Iwona)
Leki zawierające efedrynę i pseudoefedrynę jako źródło metkatynonu
Substancje naturalne jako potencjalne leki w chorobie nowotw
leki jako surowce do recept
leki jako surowce do recept
Leki w fizjot 2 akt
88 Leki przeciwreumatyczne część 2
leki ratownik medyczny
Leki wpływające na czynność skurczową macicy
Epidemiologia jako nauka podstawowe założenia
więcej podobnych podstron