Zadania – termodynamika i płyny
1. Do kalorymetru zawierającego lód o masie ml i temperaturze tl=0˚C
została wpuszczona para o temperaturze tp=100˚C. Ile wody będzie w
kalorymetrze, gdy stopi się lód? Dane są ciepło skraplania pary wodnej cs
i ciepło topnienia lodu ct.
2. Etanol o gęstości ρ=791 kg/m3 przepływa jednostajnie przez poziomą
rurę, której pole przekroju poprzecznego zmniejsza się od wartości S1 =
1.2x10-3 m2 do wartości S2=S1/2. Różnica ciśnień w wąskim i szerokim
końcu rury wynosi 4120 Pa. Jaki jest strumień objętościowy etanolu?
Odp. 2.24x10-3 m3/s
3. Proszę przedstawić na wykresach p-V, p-T i V-T przemianę izotermiczną
dla jedniego kilomola gazu o temperaturze T=T1 i T=3T1.
4. W warunkach normalnych gaz zajmuje objętość Vo = 1m3.
Jaką objętość V1 będzie zajmował ten gaz pod ciśnieniem p1=4.9x106
N/m2 = 50 at? W obu stanach temperatura gazu jest taka sama. Ciśnienie
normalne po = 105 N/m2 = 760 mmHg.
Odp. 0.02 m3
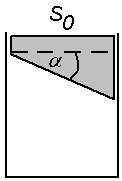
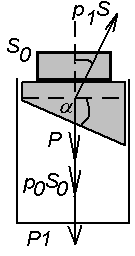
5. W cylindrze pod tłokiem znajduje się powietrze. Tłok ma kształt pokazany
na rysunku:
Ciężar tłoka P = 60 N, powierzchnia przekroju cylindra wynosi S0 = 20 cm2.
Ciśnienie atmosferyczne: po = 105 N/m2 = 760 mmHg.
Jaki ciężar P1 należy położyć na tłok, aby oby objętość powietrza w
cylindrze zmniejszyła się dwukrotnie? Nie uwzględniamy tarcia i
przyjmujemy stałą temperaturę.
Odp. 260 N
6. Objętość pęcherzyka metanu powiększa się 3-krotnie przy wypływaniu z
dna jeziora na powierzchnię. Temperatura wody na dnie wynosi t1 = 7oC,
a na powierzchni t2 = 17oC. Oblicz głębokość jeziora. Założenia: metan
traktujemy jako gaz doskonały, Ciśnienie atmosferyczne po = 105 N/m2.
Gęstość wody ρ = 103 kg/m3.
Odp. ok. 19.9 m
7. 1 mol tlenu w temperaturze T0 = 290 K poddano sprężaniu
adiabatycznemu powodując w ten sposób 10-krotny wzrost ciśnienia.
Proszę obliczyć:
a. Temperaturę Tk gazu po sprężaniu
b. Pracę wykonaną przez gaz
Stała gazowa R = 8.31 J/(mol K)
Odp. a. Tk = 560 K b. -6.7 kJ
8. Jaka jest całkowita zmiana entropii w wyniku zmieszania m1 = 300 g
azotu (µ1=28 g/mol) oraz m2=200g CO2 (µ2=44 g/mol). Temperatury i
ciśnienia gazów przed zmieszaniem były jednakowe. Proces mieszania
zachodzi w układzie izolowanym cieplnie przy stałej objętości. Stała
gazowa R = 8.31 J/(mol K).
9. Manometr gazowy w pomieszczeniu o temperaturze t1 = 17 oC wskazuje
ciśnienie p = 2.4x105 N/m2. Na ulicy wskazanie manometru zmniejsza się
o ∆p = 4x104 N/m2. Jaka jest temperatura na ulicy, jeśli ciśnienie
atmosferyczne jest równe p0 = 105 N/m2?
Odp. t2 = -17oC
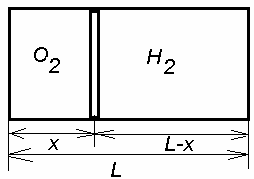
10. Naczynie cylindryczne o długości L = 85 cm jest rozdzielone na dwie
części tłokiem ruchomym. Przy jakim położeniu tłoka ciśnienie w obu
częściach cylindra będzie jednakowe, jeśli jedna część jest wypełniona
tlenem, a druga taką samą masą wodoru? Temperatura w obu częściach
jest taka sama. Masa cząsteczkowa tlenu wynosi µO2 = 3.2g/mol; µH2 =
2g/mol.
Odp. x = 5 cm
11. Pompa próżniowa uzyskuje ciśnienia rzędu p = 1.3x10-10 N/m2 = 10-12
mmHg. Ile cząstek no znajduje się w 1 cm3 przy danym ciśnieniu i w
temperaturze t = 27oC?
Odp. 3x104
12. Naczynie o kształcie sześcianu zawiera N = 10-6 kmol gazu doskonałego.
Znaleźć ciśnienie gazu, jeśli masa cząsteczki jest równa m0 = 3x10-23 g, a
średnia prędkość ruchu termicznego wynosi v = 500 m/s. Zderzenia ze
ściankami są zderzeniami doskonale sprężystymi.
Odp. 1.5 N/m2
Wyszukiwarka
Podobne podstrony:
CHiF zadania 04 2013
rozdzial 08 zadanie 04
rozdzial 07 zadanie 04
chemizm zadania 04
rozdzial 10 zadanie 04
CHiF zadania 04 2013
Zadanie 04 Monte-Carlo, Niezawodność konstr, niezawodność, 2 projekt
2011 EM BF zadania 04
Zadanie& 04 13
zadania 04 02
Zadanie 04 Lista 08 m
rozdzial 06 zadanie 04
chemizm zadania 04
2011 EM BF zadania 04
Zadania c 04
rozdzial 13 zadanie 04
rozdzial 07 zadanie 04
więcej podobnych podstron