
Węglowodory
aromatyczne
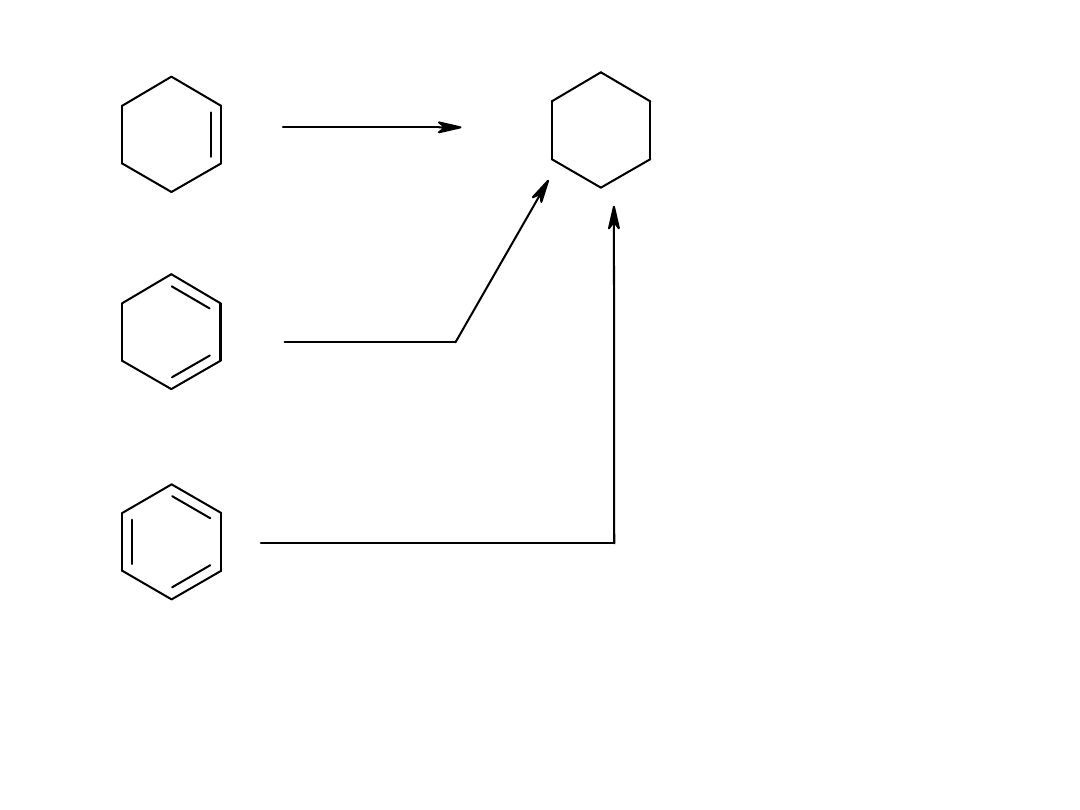
H
2
/Pt
H
2
/Pt
H
2
/Pt
H
hydrog
=-118,6kJ /mol
H
hydrog
=-230kJ /mol
H
hydrog
=-206kJ /mol
2x-118kJ/mol=-237kJ/mol
3x-118kJ/mol=-356J/mol
Energia aromatyzacji 150kJ/mol
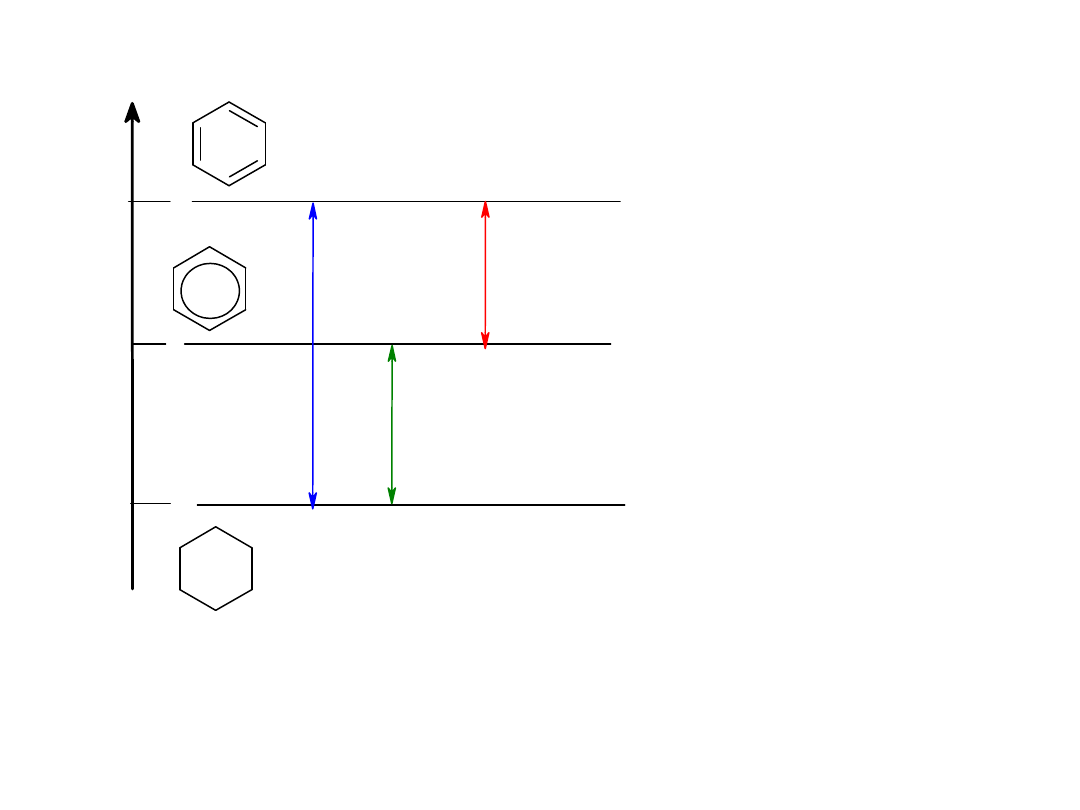
150 kJ /mol
energia aromatyzacji
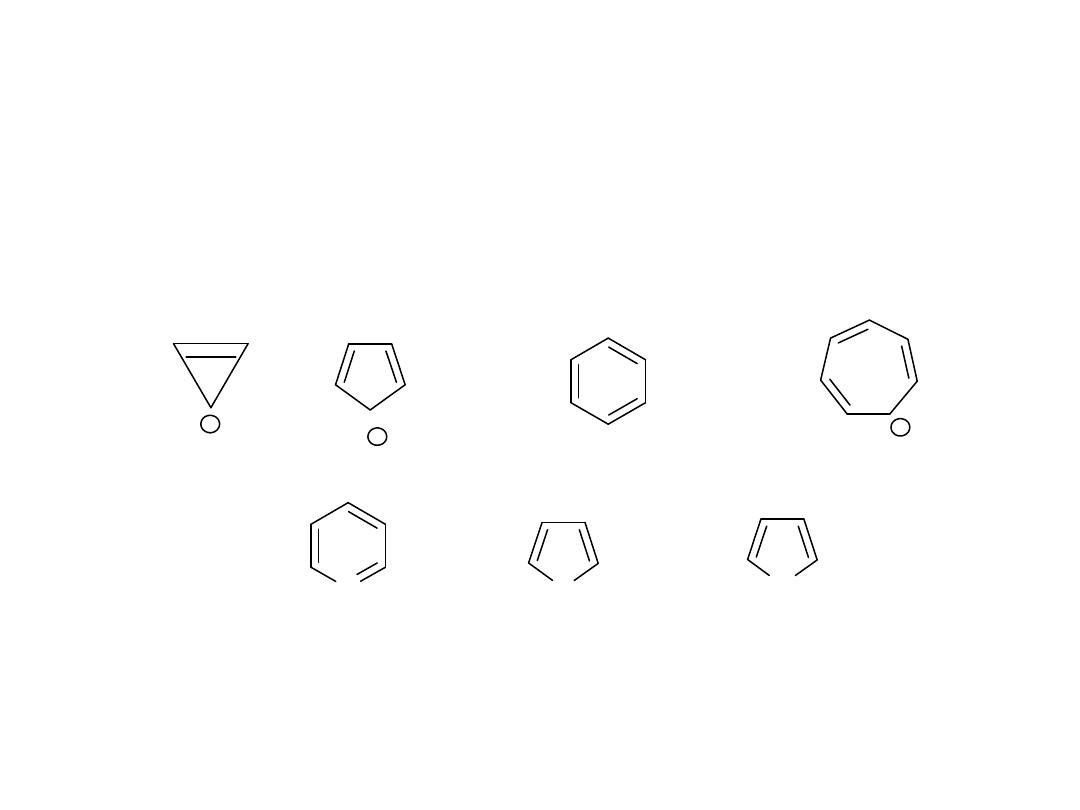
Reguła Hückla 4n+2
Układem aromatycznym jest tylko związek płaski, cykliczny, w którym
wiązania podwójne są sprzężone, a elektrony obsługują całą
cząsteczkę. Liczba elektronów obsługująca cząsteczkę musi spełniać
warunek:
liczba elektronów =4n+2
N
+
+
-
S
..
..
O
..
..
..
pirydyna
tiofen
furan
O związkach, które spełniają regułę Hückla mówimy, że są
aromatyczne
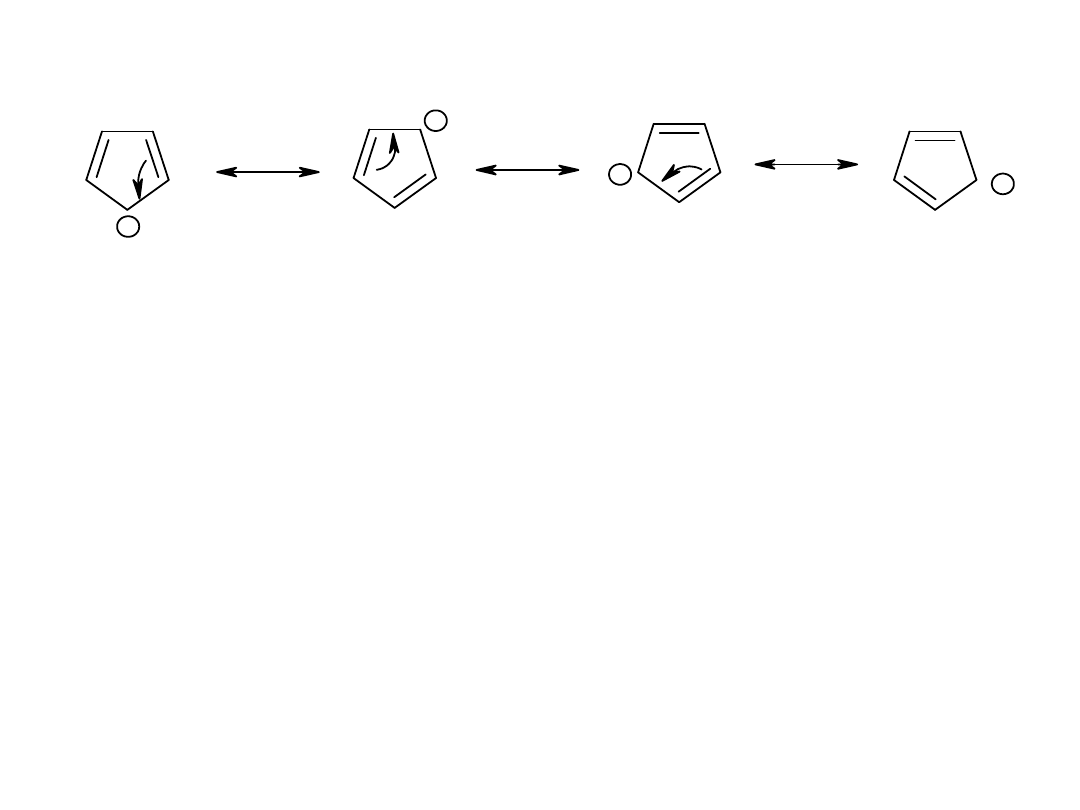
+
+
+
+
Mimo, że dla związku możemy zapisać wiele struktur
granicznych, a elektrony obsługują cały pierścień, związek nie
jest aromatyczny ponieważ posiada 4n elektronów . O takim
związku mówimy, że jest
antyaromatyczny
i jest on wybitnie
nietrwały (najczęściej nie istnieje).
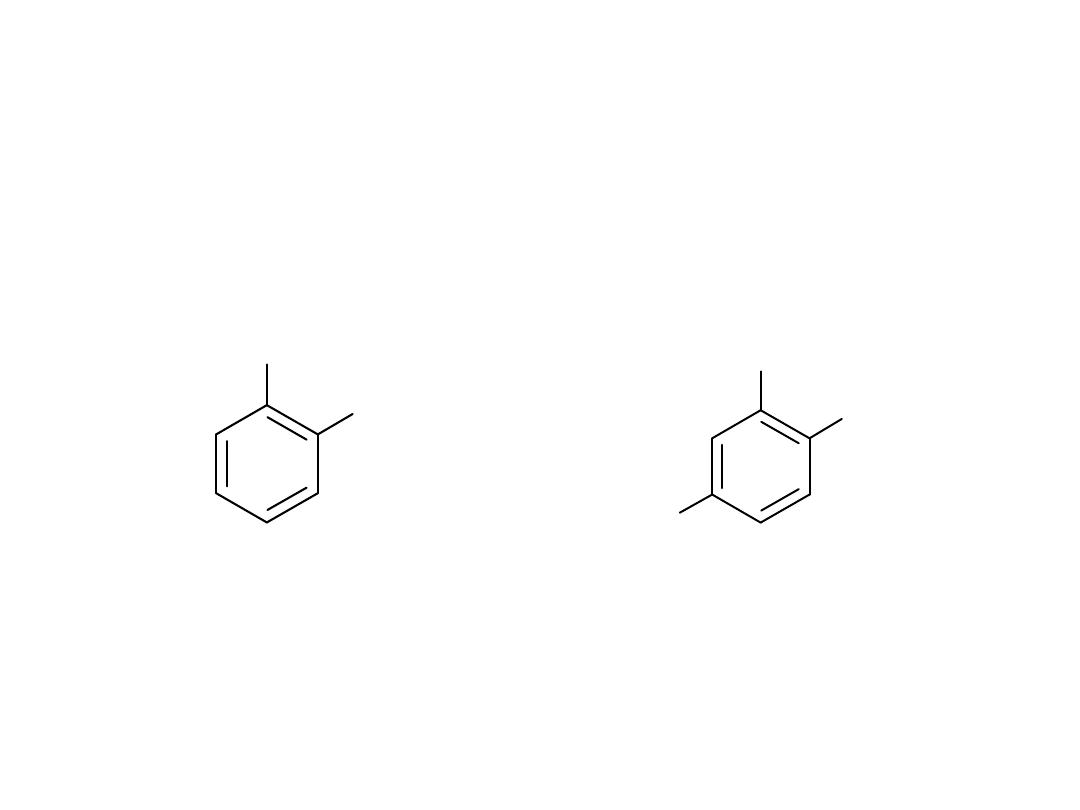
Nazewnictwo
Cl
Br
Pierścień numeruje się w taki sposób, by uzyskać jak
najmniejszy zbiór lokantów. Jeżeli to możliwe, podstawnik
którego pierwsza litera w nazwie jest bliżej początku alfabetu
uzyskuje mniejszy lokant.
1-bromo-2-
chlorobenzen o-
bromochlorobenzen
Br
Cl
O
2
N
2-bromo-1-chloro-4-
nitrobenzen
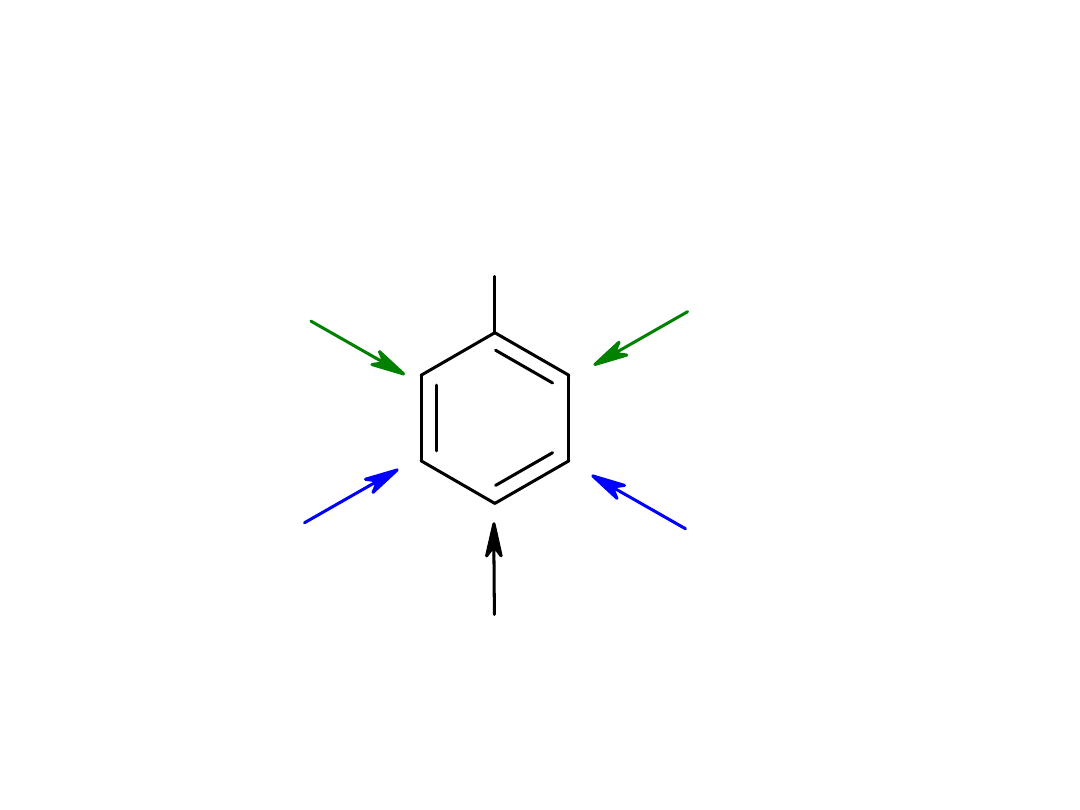
Nazewnictwo
A
orto (o-)
meta (m-)
para (p-)
orto (o-)
meta (m-)

Właściwości fizyczne
• Substancje niepolarne lub mało
polarne
• Słabo rozpuszczalne w wodzie,
dobrze rozpuszczalne w
odczynnikach organicznych
• Alkilowe pochodne benzenu mają
słabe momenty dipolowe.

Właściwości chemiczne
• Substytucja elektrofilowa
• Redukcja
• Utlenianie
• Podstawienie w łańcuchu bocznym.
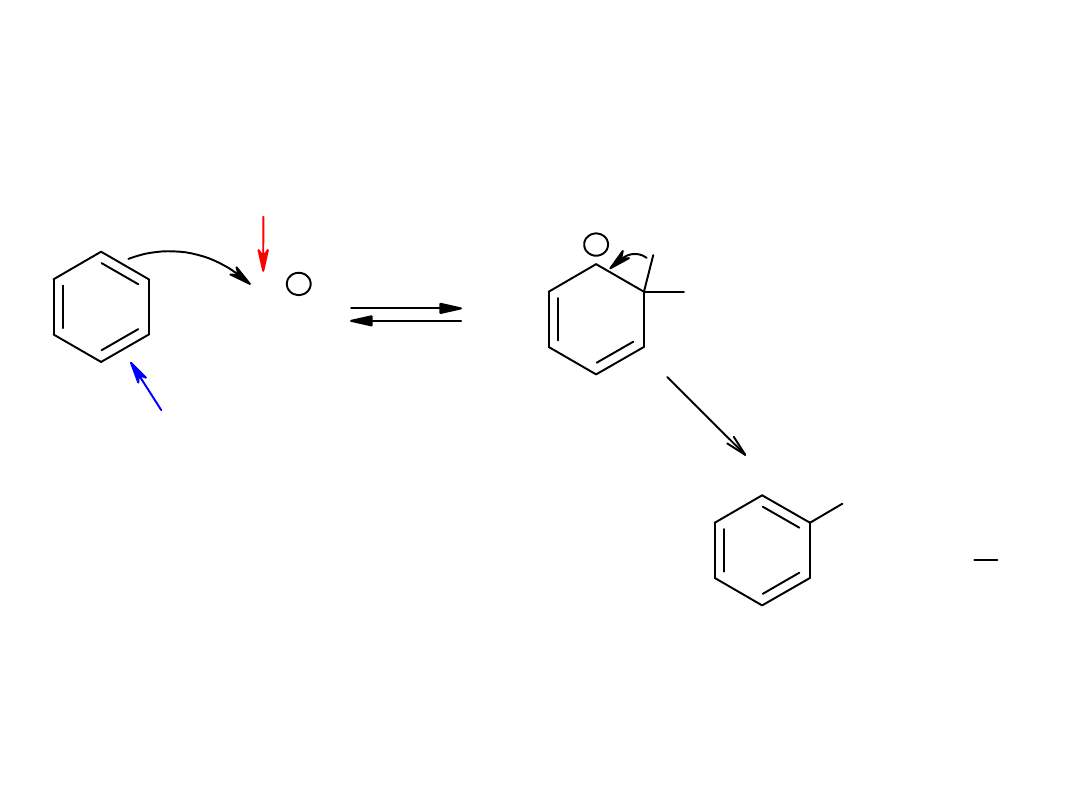
Substytucja elektrofilowa
+
H
E
+
E
H Nu
c.n.
+ E
c.e.
+
H O
N O
O
-
+
+
H O
N O
O
H
-
+
H O
H
-
+
N O
O
N O
O
+
:
..
..
+ H
..
..
:
..
..
..
:
..
..
..:
2
HNO
3
+ 2H
2
SO
4
H
3
O
+
+ NO
2
+
+ 2HSO
4
-
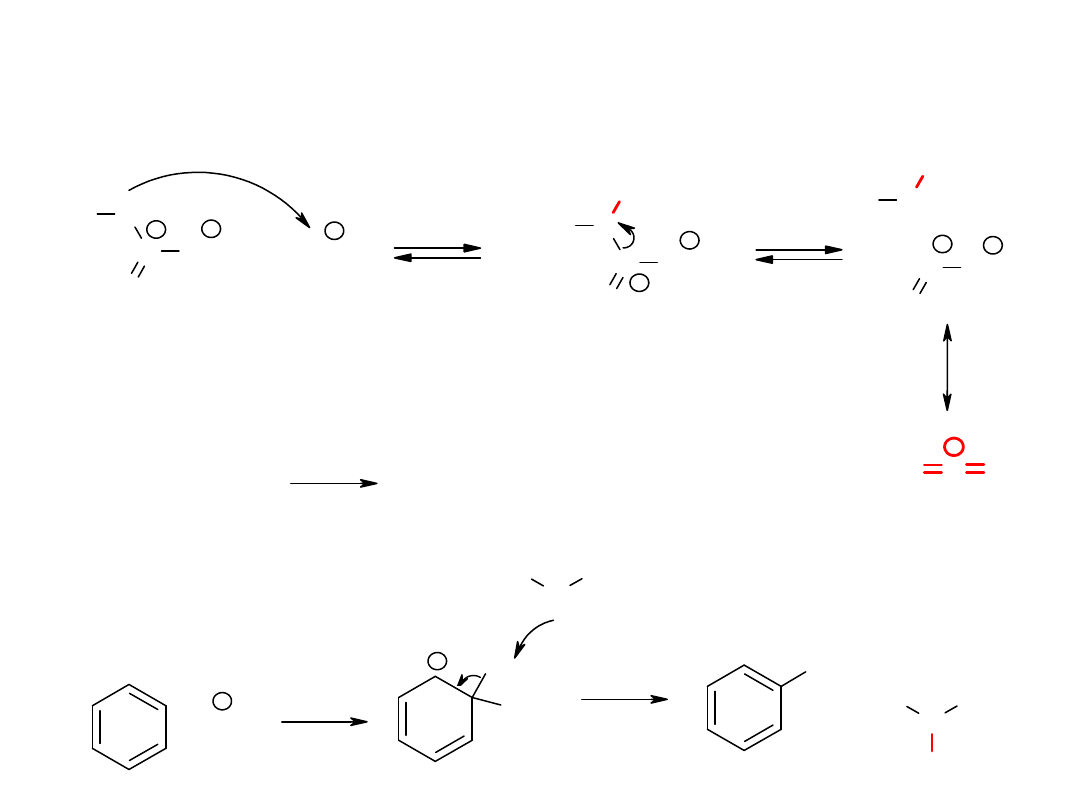
Nitrowanie związków
aromatycznych
+
H
NO
2
+
+ NO
2
O
H
H
..
..
O
H
H
H
..
+
NO
2
X X
:
:
..
..
..
..
FeX
3
+
-
X
+ FeX
4
:
..
..
Halogenowanie związków aromatycznych
H
X
+
+ X
+
-
X
FeX
4
+ HX + FeX
3
Br
+ Br
2
Fe
+ HBr
Document Outline
Wyszukiwarka
Podobne podstrony:
Pytania Wykład 5 Chemia organiczna aromaty
AROMATY, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZNA konwersatorium
ZWIAZKI AROMATYCZNE 2009pop., Chemia Organiczna
Chemia organiczna czesc I poprawiona
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia Organiczna 4
Chemia organiczna IV
CHEMIA- CHEMIA ORGANICZNA, CHEMIA
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
więcej podobnych podstron