ZASTOSOWANIE
KLINICZNE METOD
BIOLOGII MOLEKULARNEJ
W DIAGNOSTYCE
PREDYSPOZYCJI
NOWOTWOROWYCH

GEN BRCA1
Jest to pierwszy zidentyfikowany gen
supresorowy związany z dziedzicznymi
nowotworami sutka. Zlokalizowany jest na
długim ramieniu chromosomu 17 (17q21).
Gen BRCA1 posiada długość około 80 tysięcy
par zasad. Zawiera region kodujący, który
obejmuje 22 eksony o łącznej długości 5592
nukleotydów.
W genie BRCA1 zidentyfikowano dotychczas
około 170 różnych, rozproszonych w całej
długości genu mutacji predysponujących do
rozwoju nowotworu jajnika i sutka.
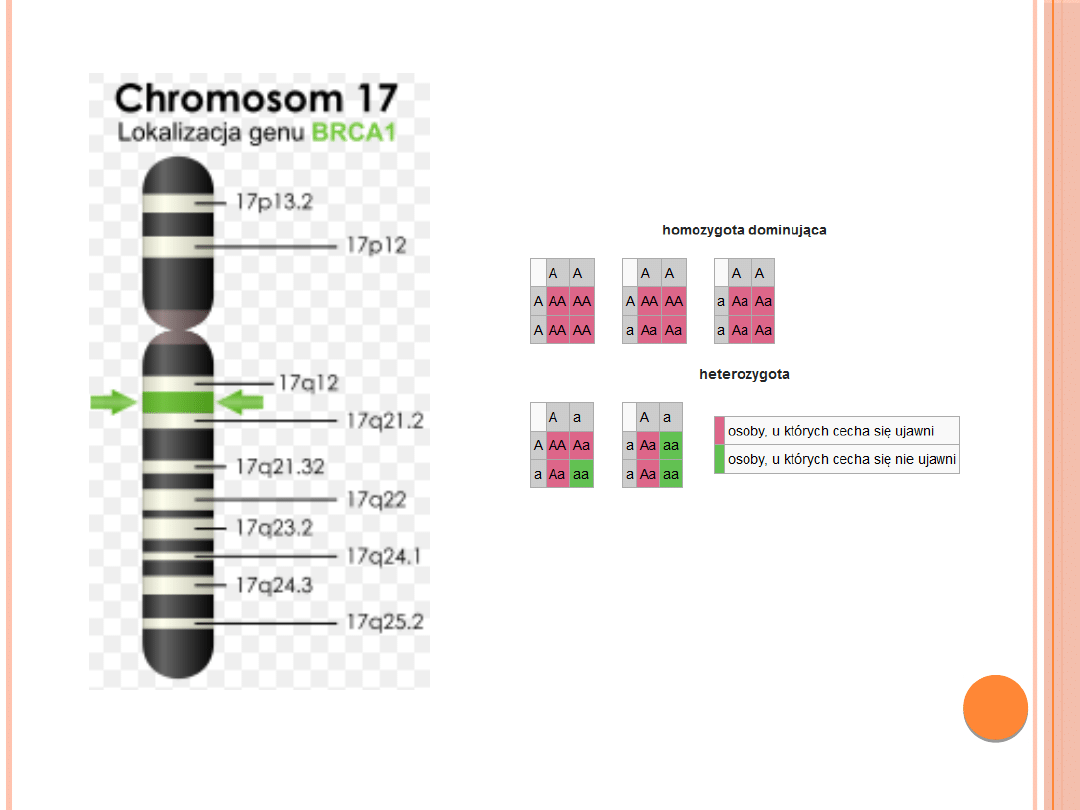
Lokalizacja genu BRCA1 zaznaczona
na zielono
dziedziczenie autosomalne dominujące

GEN SUPRESOROWY
Gen supresorowy- (Antyonkogen) gen
działający hamująco na procesy proliferacji
komórkowej (geny bramkowe) bądź
stabilizująco na procesy utrzymujące
stabilność genetyczną komórki (geny
opiekuńcze).

GENY SUPRESOROWE – W
ZALEŻNOŚCI OD MECHANIZMU
DZIAŁANIA DZIELIMY NA DWIE GRUPY:
geny „stróże genomu”
geny „opiekunowie genomu”
-geny regulujące apoptozę
-geny regulujące naprawę DNA

BIAŁKO BRCA1
Białko BRCA1 o masie cząsteczkowej około
220 kD jest fosfoproteiną składającą się z
1863 aminokwasów. W pobliżu jego końca
aminowego znajduje się motyw palca
cynkowego, charakterystyczny dla białek
wiążących się z kwasami nukleinowymi.
Białko BRCA1 oraz BRCA2, kodowane
przez geny o tych samych nazwach, pełni
krytyczną rolę w naprawie DNA, kontroli
cyklu komórkowego i zachowaniu
stabilności materiału genetycznego.
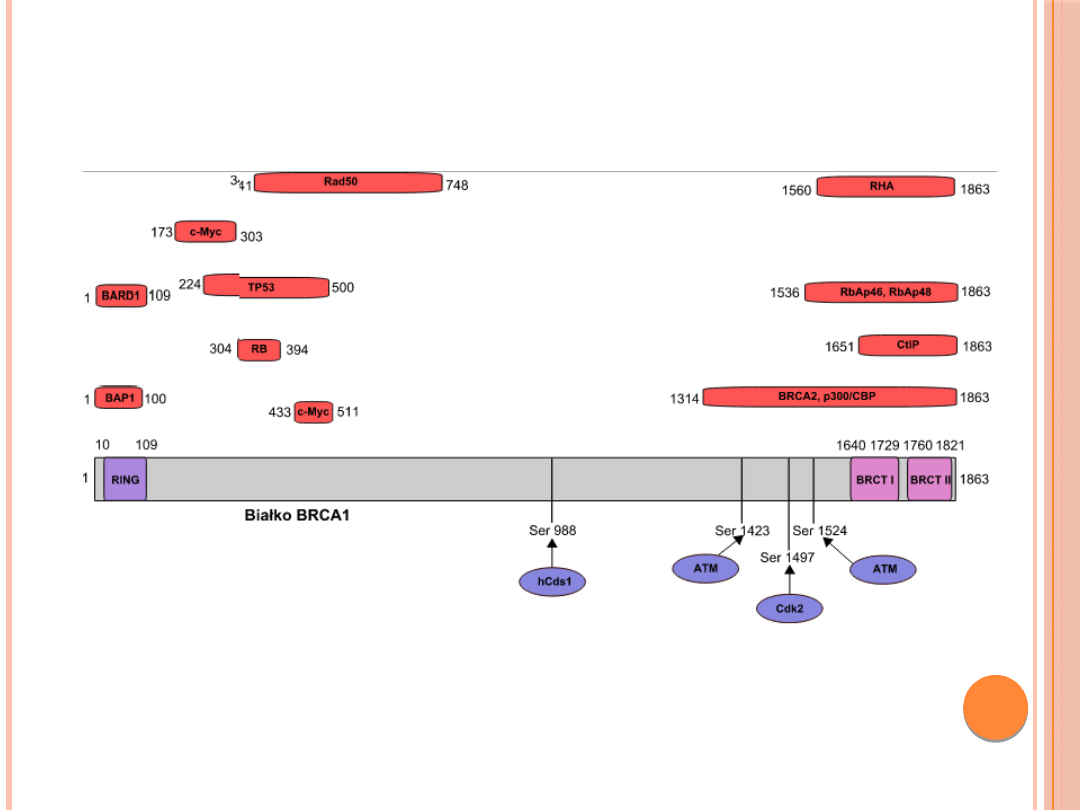
BUDOWA I FUNKCJA BIAŁKA BRCA1

JAKIE SĄ FUNKCJE BIAŁKA
BRCA1 ?
Gen zapewnia instrukcję dotyczącą powstawania białka
BRCA1, które:
- zapobiega przed wzrostem i podziałem w gwałtowny i
niekontrolowany sposób.
- jest zaangażowane w naprawianie uszkodzonego DNA.
W jądrze wielu typów normalnych komórek, białko
BRCA1
wchodzi w interakcję z kilkoma innymi białkami ( także
tymi wyprodukowanymi na bazie genów RAD51 i
BARD1) żeby naprawić uszkodzenia w DNA, które mogą
być spowodowane promieniowaniem, czynnikami
środowiska lub gdy chromosomy wymieniają się
materiałem genetycznym podczas przygotowywania do
podziału komórki.

Pełni rolę w utrzymaniu stabilności informacji
genetycznej w komórce.
reguluje także aktywność innych genów
odgrywa ważną rolę w rozwoju
embrionalnym
- oddziałuje z innymi białkami supresorowymi,
które także pełnią funkcję regulatorowe

MUTACJE
Mutacje w tym genie odpowiadają za autosomalny,
dominujący zespół dziedzicznej predyspozycji do
wcześnie rozwijających się nowotworów sutka i
jajnika.
Mutacje w tym genie występują w około 45% rodzin z
dziedzicznym zespołem raka sutka i ponad 80%
rodzin z dziedzicznym zespołem raka jajnika.
Oszacowano, że kobiety będące nosicielkami
dziedzicznej mutacji w genie BRCA1 są zagrożone
ryzykiem w wysokości ponad 80% zachorowania na
raka sutka przed ukończeniem 70 roku życia. Ciąży na
nich również zwiększone ryzyko zachorowania na raka
jajnika (44%).

PRZEZ MUTACJE GENU BRCA1
NASTEPUJE:
-
produkcja niekompletnego, krótszego, niefunkcjonalnego
białka BRCA1
- uniemożliwienie powstawania białka na podstawie genu
- zmiany aminokwasów prowadzące do powstania białka
o prawidłowej wielkości, lecz zaburzonej funkcji
usunięcie fragmentu DNA z genu
Do chwili obecnej zidentyfikowano ponad 1000
mutacji
Nagromadzenie tych efektów pozwala komórce
na
niekontrolowany wzrost i podział

W kilku populacjach wykryto mutacje, które występują ze
zwiększoną częstością u kobiet z rodzinną postacią raka
piersi
(tzw. founder mutations – mutacje związane z „efektem
założyciela”), co pozwala w znacznym stopniu przyspieszyć
identyfikację patogennej zmiany w genie BRCA1.
W populacji polskiej są to mutacje:
5382insC, C61G i 4153delA
(I etap diagnostyki), które stanowią około 90% wykrywanych
mutacji BRCA1.
Jednakże zgodnie ze wskazaniami EMQN, mając na
względzie heterogenność populacji europejskich, analizy
genu BRCA1 nie należy ograniczać jedynie do najczęściej
występujących mutacji. Uzupełnieniem podstawowej
diagnostyki u kobiet spełniających kryteria* badania genu
BRCA1, powinna być analiza całej sekwencji kodującej (+
sekwencje otaczające eksony, w których mogą wystąpić
mutacje zaburzające składanie RNA).

Nosicielstwo mutacji w genach BRCA1 i
BRCA2
nie jest jednoznaczne z wystąpieniem raka
Bardzo istotną rolę w patogenezie tej choroby
odgrywają także czynniki środowiskowe,
biochemiczne czy genetyczne.
Badanie genetyczne daje natomiast
informację o predyspozycji do rozwoju raka.

CZYNNIKI MUTAGENNE
• czynniki fizyczne
• czynniki chemiczne
• czynniki biologiczne

ETAPY TWORZENIA NOWOTWORÓW
Preinicjacja
Inicjacja
Promocja
Progresja

METODY WYKRYWANIA MUTACJI W
BRCA1
RFLP/PCR- wykrywanie mutacji za pomocą
enzymów restrykcyjnych w produktach PCR)
ASA - – allelo-specyficzna amplifikacja
PCR w czasie rzeczywistym
Sondy TaqMan
Sondy SimpleProbes
GENOTYPOWANIE SNaPshot
TEST PASKOWY
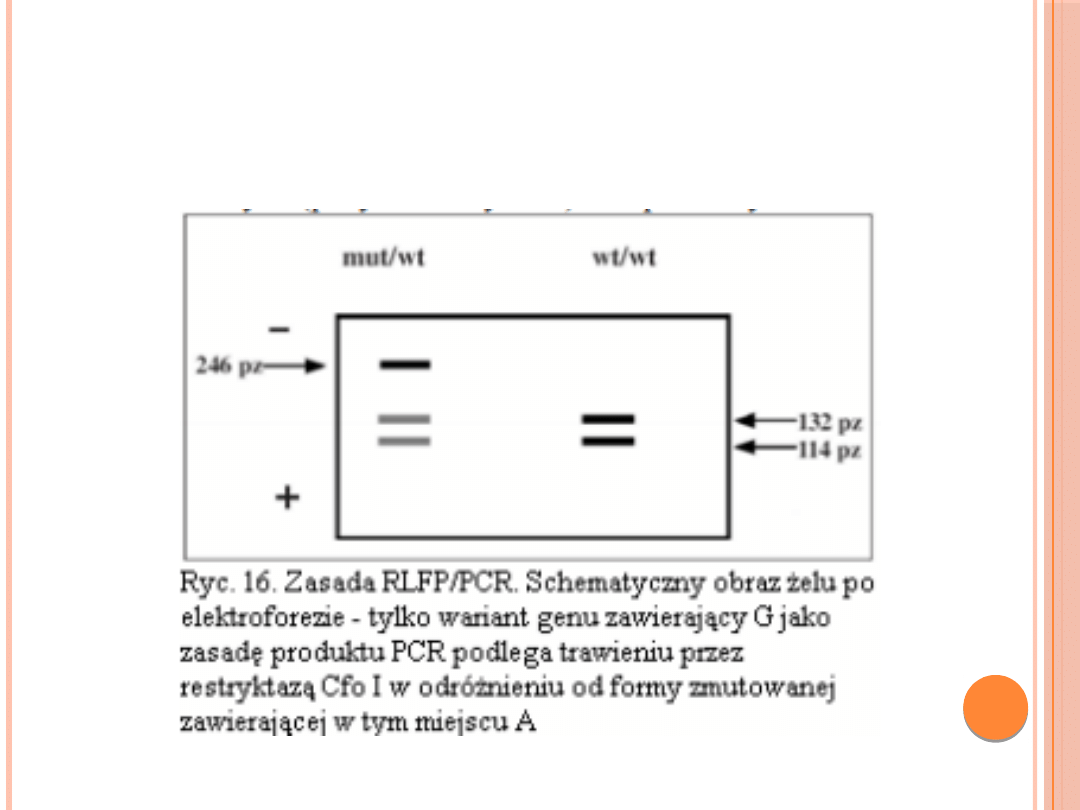
RFLP/PCR
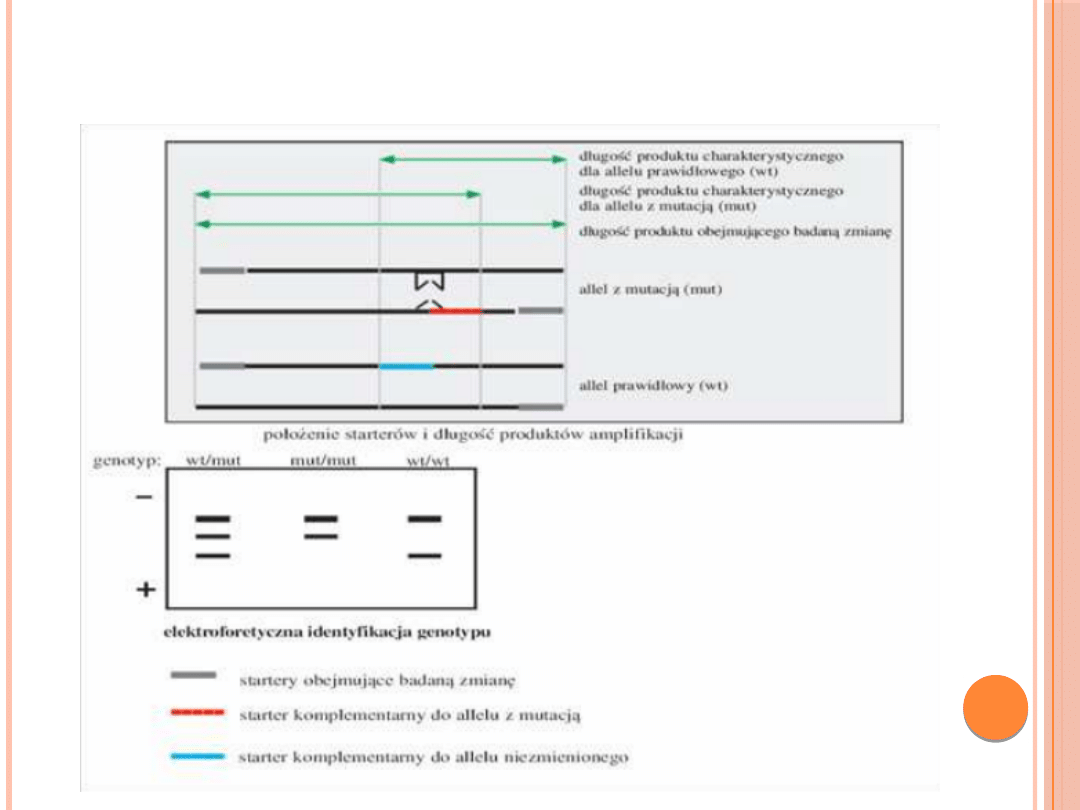
ASA
DIAGNOSTYKA WIRUSA
HPV
BUDOWA WIRUSA
Ludzkie wirusy brodawczaka HPV należą do rodziny
Papillomaviridae. HPV mają nieosłonięty wirion o
symetrii ikosaedralnej i średnicy 55 nm. Kapsyd
zbudowany jest z dwóch białek strukturalnych: 360
kopii białka L1 i 12 kopii białka L2 zorganizowanych
w 72 kapsomery . Genom wszystkich wirusów
brodawczaka ma postać kolistej, kowalencyjnie
zamkniętej cząsteczki dsDNA, zbudowanej z około 8
tysięcy par zasad, zasocjowanej z histonami tworząc
strukturę podobną do chromatyny. Tylko jedna nić
DNA jest kodująca i zawiera do 8 nachodzących na
siebie otwartych ramek odczytu.
STRUKTURA I ORGANIZACJA
GENOMU WIRUSA BRODAWCZAKA
LUDZKIEGO
Materiał genetyczny ludzkich, jak i zwierzęcych wirusów
brodawczaka zorganizowany jest tak samo. W jego
genomie można wyróżnić trzy rejony: wczesny (E) –
kodujący białka niestrukturalne wirusa, późny (L)–
kodujący
białka
strukturalne
oraz
długi
rejon
regulatorowy (LCR lub NCR) (ang. Long Control Region,
Noncoding Region). Rejony E i L przedzielone są dwoma
miejscami poliadenylacji: wczesnym AE i późnym AL.
Najbardziej zachowawczy jest region kodujący białka E1 i
L1, natomiast najmniej – LCR. Rejon regulatorowy wirusa
(LCR) umieszczony jest pomiędzy otwartymi ramkami
odczytu L1 oraz E6 i zawiera około 1000 pz.
Zlokalizowany jest w nim promotor oraz liczne
sekwencje funkcjonujące jako wzmacniacze i wyciszacze
transkrypcji wirusowych genów.

Dotychczas zidentyfikowano około dwudziestu czynników
białkowych wiążących się z określonymi elementami sekwencji
w LCR. Późne geny L1 i L2 są odpowiedzialne za syntezę białek
otoczki, natomiast wczesny geny E1 i E2 odpowadają za
replikację genomu HPV. Onkoproteiny E5, E6 i E7 biorą udział w
procesie nowotworzenia (transformacji nowotworowej). Białko
E4 umożliwia interakcję z keratynami, co powoduje widoczny
efekt w postaci zmian brodawkowych.
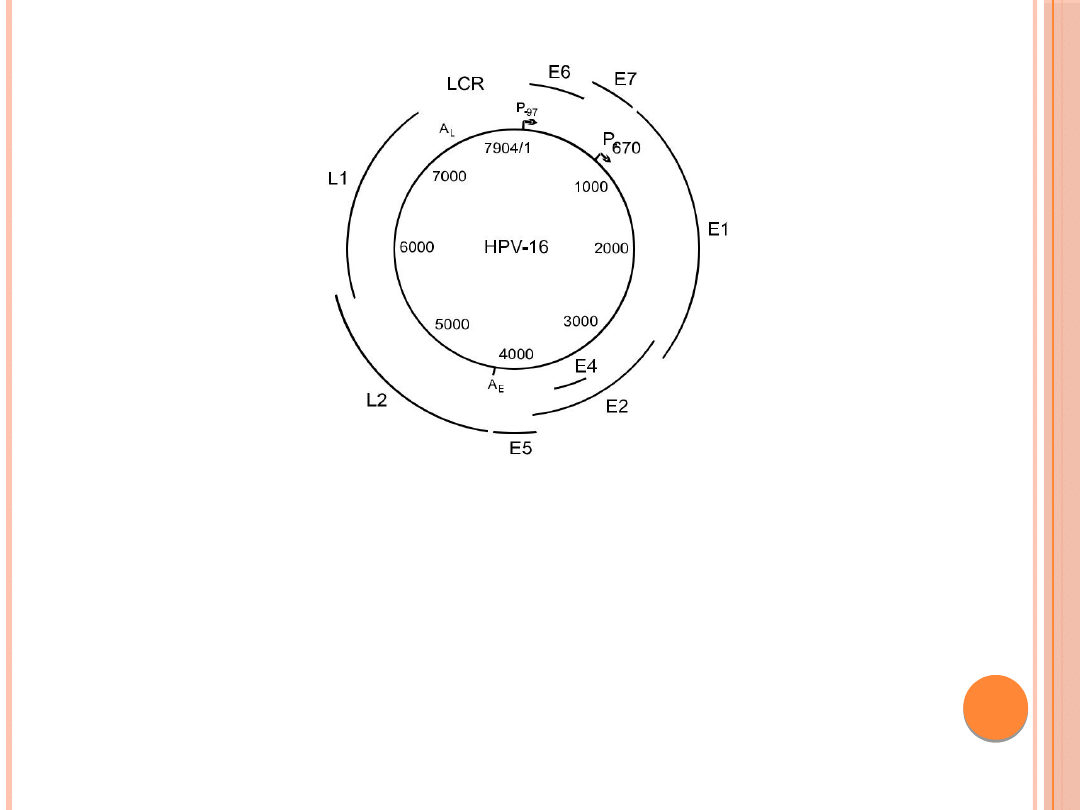
Rys. 1. Schemat genomu wirusa brodawczaka: LCR – długi region
regulatorowy, L1-L2 – otwarte ramki odczytu kodujące białka
późne wirusa, E1-E7 – otwarte ramki odczytu kodujące białka
wczesne wirusa, A
L
– późne miejsca poliadenylacji, A
E
– wczesne
miejsca poliadenylacji, P
97
– wczesny promotor, P
670
– późny
promotor; numery zawarte w wewnętrznym okręgu wskazują
pozycję nukleoty-dów.
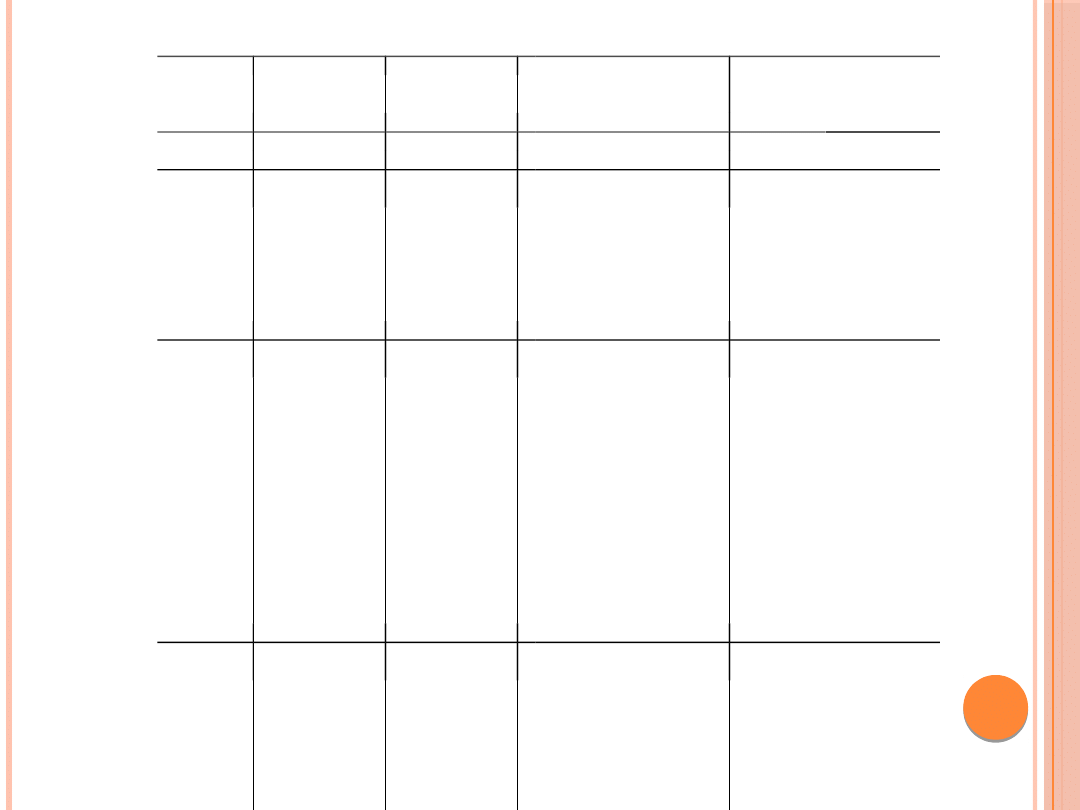
Nazwa
białka
Liczba
Masa
Waściwości
Funkcje
aminokwasów
cząsteczkowa
(kDa)
1
2
3
4
5
E1
649
73
– ATP zale¿na
– inicjacja replikacji
wirusowego
helikaza DNA
DNA
– razem z białkiem E2
odpowia-
da za utrzymanie DNA
wirusowe-
go w postaci episomalnej
E2
365
41,8
– hydrofobowe
– razem z bialkiem E1
bierze
–
aktywator, represor
transkrypcji
udział w replikacji
wirusowego
DNA i jego segregacji
podczas po-
działów komórki
(asocjuje do mi-
totycznych
chromosomów)
– regulacja transkrypcji i
kontro-
la ekspresji genów
wczesnych E6
i E7
E4
95
10,5
–
zachowawczy koniec N
bogaty
– uwalnianie wirionów
potom-
w reszty leucynowe,
nych
–
może ulegaæ
fosforylacji
– destabilizacja włókien
keraty-
nowych w
komórce
– zdolne do zatrzymania
cyklu
komórkowego w fazie G2
Właściwości i funkcje białek wirusów HPV
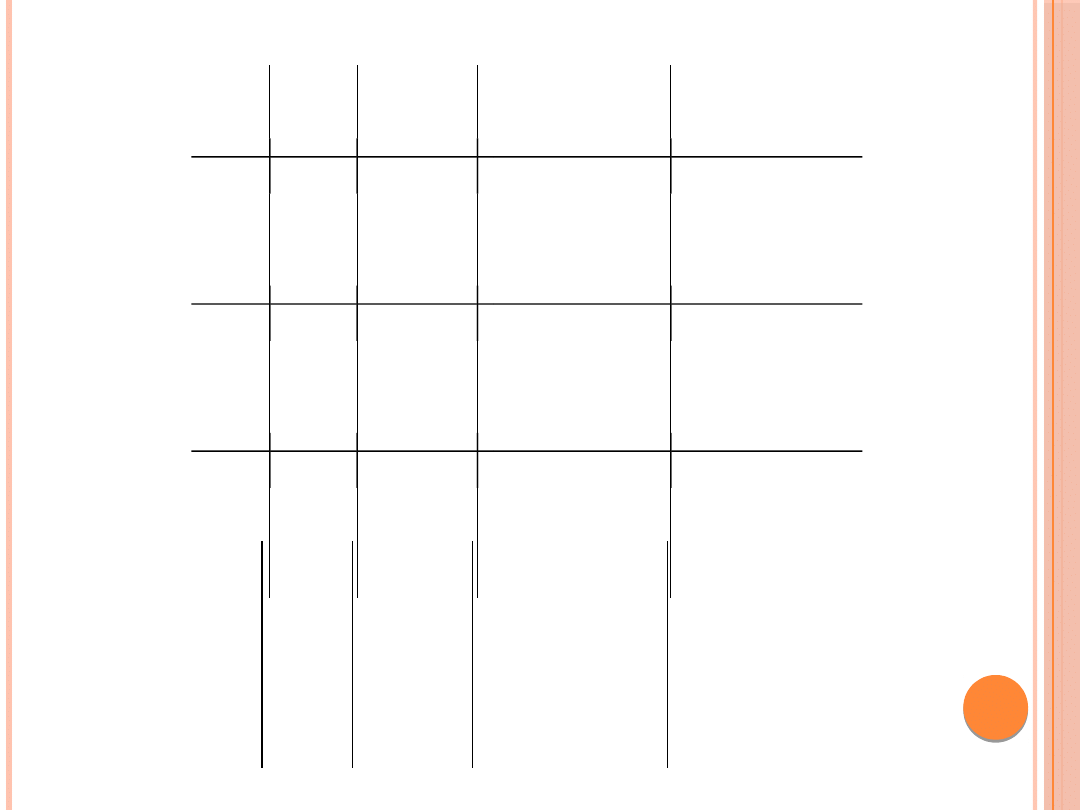
E5
83
9,4
– hydrofobowe
– obniża poziom białek
MHC klasy
– onkogenne
I i II
– bia³ko b³onowe
– hamuje apoptozę
E6
158
19,2
–
aktywator
transkrypcji
– udzial w regulacji
replikacji wi-
– onkogenne
rusa
–
zawiera dwie domeny
o struk-
–
oddziałuje z
komórko
wym
turze palców
cynkowych
białkiem
P53
E7
98
11
–
aktywator
transkrypcji
– udział w regulacji
replikacji wi-
– onkogenne
rusa
–
zawiera jeden motyw
o struk-
–
oddziałuje z
komórko
wym
turze palca cynkowego
białkiem
pRB
L1
531
59,4
–
może ulegać
gliokozylacji
– główne białko
kapsydu
–
właœciwości
antygenowe
–
zachowawcza
sekwencja wśród
różnych typów
wirusów HPV
L2
473
50,6
–
może ulegać
fosforylacji
– białko kapsydu
–
właściwości
antygenowe
– rekrutacja
wirusowych geno-
–
może wiązać się z
DNA
mów w czasie składania
cząstek po-
–
zróżnicowana
sekwencja wśród
tomnych
różnych typów wirusów
HPV
– transport wirusowego
DNA do
jądra

JAKIE INFEKCJE POWODUJE?

Wirus brodawczaka ludzkiego - HPV (Human papilloma virus)
-Niektóre z typów HPV wywołują dość powszechne u kobiet i
mężczyzn łagodne zmiany skóry i błon śluzowych narządów
rozrodczych określane jako brodawki płciowe lub kłykciny
kończyste. Są to niewielkie płaskie lub wyniosłe zmiany, pojawiające
się pojedynczo lub w grupach w okolicach narządów rozrodczych i
odbytu, a nawet na udach. U kobiet kłykciny rozwijają się najczęściej
w pochwie, na sromie i szyjce macicy, u mężczyzn zaś w obrębie
penisa, moszny i krocza. W pewnych sytuacjach brodawki płciowe
mogą stanowić poważny problem zdrowotny, na ogół jednak są one
stosunkowo łatwe do leczenia i nie predysponują do rozwoju
nowotworów.

Jednakże niektóre z typów wirusów HPV - tzw. wysokiego ryzyka lub
inaczej onkogenne - przy długotrwałej, przetrwałej infekcji trwającej
wiele miesięcy lub lat mogą doprowadzić u kobiet do rozwoju raka
szyjki macicy. Najczęściej jest za to odpowiedzialny wirus typu 16,
rzadziej 18. W badaniach przesiewowych wskazuje się jednak, że
tylko z niewielu zmian spowodowanych infekcji HPV rozwija się
nowotwór. Do zakażenia dochodzi najczęściej w rejonie tarczy
szyjki.
Wykazano
także
związek
pomiędzy
infekcją
niektórymi typami HPV a rozwojem innych nowotworów, takich jak:
rak sromu i pochwy u kobiet oraz rak prącia u mężczyzn. Ostatnie
doniesienia naukowe wskazują na udział onkogennych wirusów HPV
w rozwoju m.in. niektórych nowotworów głowy i szyi, górnych dróg
oddechowych, a nawet płuc.

TYPY WIRUSA
o niskim poziomie ryzyka
onkologicznego (wirus HPV 6, 11, 42, 43,
44) - odpowiedzialne są one głównie za
niegroźne zmiany skórne
o wysokim poziomie ryzyka
onkologicznego (typu onkogennego)
wysokiego ryzyka (HPV 16, 18, 31, 33, 35,
39, 45, 46, 51, 52, 56, 58, 67) - te typy
wirusa brodawczaka ludzkiego (wirus HPV)
znajdowane są głównie w komórkach raka
szyjki macicy.

Wirusy typu 16 i
18 uważane są za
najbardziej
kancerogenne


JAK GO WYKRYĆ?
Diagnostyka zakażeń wirusami HPV opiera
się na :
ocenie wyglądu zmian w przypadku
brodawek i kłykcin kończystych na
powierzchni skóry i błon śluzowych,
badaniu cytologicznym w przypadku infekcji
dróg rodnych,

badaniu materiału z biopsji pobranej w
obrębie zmiany lub, jeśli znajduje się ona w
rejonie szyjki macicy, na badaniu
kolposkopowym z biopsją obszaru
zmienionego,
potwierdzenie wirusowej etiologii choroby
jest możliwe dopiero po wykonaniu testów
molekularnych wykrywających DNA wirusa w
materiale pobranym od pacjenta.

TEST PAP
W przypadku infekcji dróg rodnych celem
przesiewowego badania cytologicznego jest
pobranie i zbadanie materiału ze strefy
przejściowej szyjki macicy (nabłonek
walcowaty kanału szyjki macicy przechodzi
tu w nabłonek płaski części pochwowej), w
której powstaje rak.

WYNIKI PAP OKREŚLAJĄ:
Stopień dysplazji komórek
Śródnabłonkową neoplazję szyjki macicy

Metody cytologiczne
mają szereg
niedoskonałości

Badanie DNA HPV metodą
PCR
Diagnostyka molekularna obecności wirusów
wysokoonkogennych i wybranych
niskoonkogennych z możliwością identyfikacji
genotypów.
Czyli badanie kwasów nukleinowych wirusa
(DNA) techniką PCR

Test wykorzystuje amplifikację fragmentu
DNA za pomocą reakcji łańcuchowej
polimerazy(PCR) hybrydyzację ( połączenie
DNA z tzw. primerem w wyniku czego
powstaje tzw. hybryda) kwasów
nukleinowych do wykrywania konkretnych
genotypów wysokiego ryzyka
Następnie hybrydyzację ( połączenie DNA z
tzw. primerem w wyniku czego powstaje tzw.
hybryda) kwasów nukleinowych do
wykrywania konkretnych genotypów
wysokiego ryzyka.

BADANIE MRNA HPV HR
W diagnostyce przewlekłego zakażenia
wirusem HPV pomocne jest nowe badanie
oparte na metodach diagnostyki
molekularnej, które polega na stwierdzeniu
obecności transkryptów mRNA onkogenów E6
i E7, wirusów wysokiego ryzyka.

BADANIE CYTOHISTOCHEMICZNE
Aby zwiększyć uleczalność tej choroby, a
zarazem uratować jak najwięcej kobiet, warto
poszerzyć diagnostykę zmian rakowych i
przedrakowych o nowoczesne testy p16/Ki-
67.

SZCZEPIONKA NA HPV
PROFILAKTYKA
Zapobieganie rozwojowi raka szyjki macicy możemy
podzielić na profilaktykę pierwotną i wtórną.
*Pierwotna profilaktyka obejmuje:
-szczepienia przeciwko wysokoonkogennym typom
HPV (typ 16, 18) oraz typom powodującym kłykciny
kończyste (typ 6, 11),
-ograniczenie liczby partnerów seksualnych,
-stosowanie prezerwatywy w sposób prawidłowy i
konsekwentny,

-unikanie
długotrwałego
stosowania
antykoncepcji hormonalnej,
-zaniechanie palenia papierosów.
*Wtórna profilaktyka obejmuje:
-regularne wykonywanie przesiewowych badań
cytologicznych (co 3 lata),
-leczenie stanów przednowotworowych.
SZCZEPIONKA
Obecnie do szczepienia przeciwko HPV najczęściej
stosowana jest czterowalentna szczepionka przeciwko
HPV 6, 11, 16 i 18. Szczepionka ta wydaje się być
skuteczna w zapobieganiu wystąpienia dysplazji
szyjki macicy dużego i średniego stopnia (CIN2/3),
rakowi szyjki macicy, zmian dysplastycznych sromu
dużego i średniego stopnia (VIN 2/3) oraz brodawek
zewnętrznych
narządów
płciowych
(kłykcin
kończystych).
KOMU?
Zaleca się rutynowe podawanie szczepionki
dziewczętom w wieku 11–12 lat, ale także
młodszym, począwszy od dziewiątego roku życia
oraz chłopcom w wieku 9–15 lat. Najkorzystniejsze
jest
szczepienie
kobiet/dziewczynek
przed
potencjalną ekspozycją na zakażenie HPV, a więc
przed inicjacją seksualną. Pełny cykl szczepień
obejmuje podanie domięśniowe trzech dawek
szczepionki (dwie kolejne dawki po 2 i po 6
miesiącach od dawki pierwszej). Szczepienia nie
wykonuje się u kobiet w ciąży.
JAKIE SZCZEPIONKI PRZECIWKO
WIRUSOWI BRODAWCZAKA LUDZKIEGO
SĄ DOSTĘPNE W POLSCE?
W Polsce dostępne są 2 różne szczepionki przeciwko
wirusom
brodawczaka
ludzkiego
w postaci
zastrzyków do podawania domięśniowego:
Cervarix przeciwko 2 typom HPV, rakotwórczym
wirusom: HPV16 i HPV18
Silgard przeciwko 4 typom HPV, rakotwórczym
wirusom HPV16 i HPV18 oraz HPV6 i HPV11
odpowiedzialnym za brodawki płciowe (kłykciny).
Document Outline
- Slide 1
- Gen BRCA1
- Slide 3
- Gen supresorowy
- Slide 5
- Białko BRCA1
- Budowa i funkcja białka BRCA1
- Jakie są funkcje białka BRCA1 ?
- Slide 9
- Mutacje
- Przez mutacje genu BRCA1 nastepuje:
- Slide 12
- Slide 13
- Czynniki mutagenne
- Etapy tworzenia nowotworów
- Metody wykrywania mutacji w BRCA1
- RFLP/PCR
- ASA
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Jakie infekcje powoduje?
- Slide 27
- Slide 28
- Typy wirusa
- Slide 30
- Slide 31
- Slide 32
- Jak go wykryć?
- Slide 34
- test Pap
- Wyniki Pap określają:
- Slide 37
- Badanie DNA HPV metodą PCR
- Badanie mRNA HPV HR
- badanie cytohistochemiczne
- Szczepionka na HPV
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
Wyszukiwarka
Podobne podstrony:
nasza prezentacja 0306
NASZA PREZENTACJA
1 Nasza prezentacja Oddziaływaniaid 9495 ppt
zboża nasza prezentacja 2
NASZA PREZENTACJA GRUPA 1 WERSJA OSTATECZNA
PREZENTACJA PCC NASZA
Prezentacja zarzadzanie kompeten w org [1] NASZA
prezentacja finanse ludnosci
prezentacja mikro Kubska 2
Religia Mezopotamii prezentacja
Prezentacja konsument ostateczna
Strategie marketingowe prezentacje wykład
motumbo www prezentacje org
lab5 prezentacja
Prezentacja 18
Materialy pomocnicze prezentacja maturalna
Prezentacja na seminarium
Lato prezentacja 3
więcej podobnych podstron