
Węglowodory i ich
fluorowcopochodne,
mechanizmy reakcji
związków organicznych,
izomeria Z, E
Marta Augustyniak
Barbara Kopera
Katarzyna Wargacka
Magdalena Wiśniewska
Joanna Zagożdżon

Węglowodory i ich fluorowcopochodne,
mechanizmy reakcji związków organicznych,
izomeria Z, E
1. Podział węglowodorów.
2. Alkany i cykloalkany.
3. Alkeny.
4. Alkiny.
5. Węglowodory aromatyczne.
6. Halogenopochodne.
7. Występowanie węglowodorów w
przyrodzie.
8. Właściwości biologiczne węglowodorów.
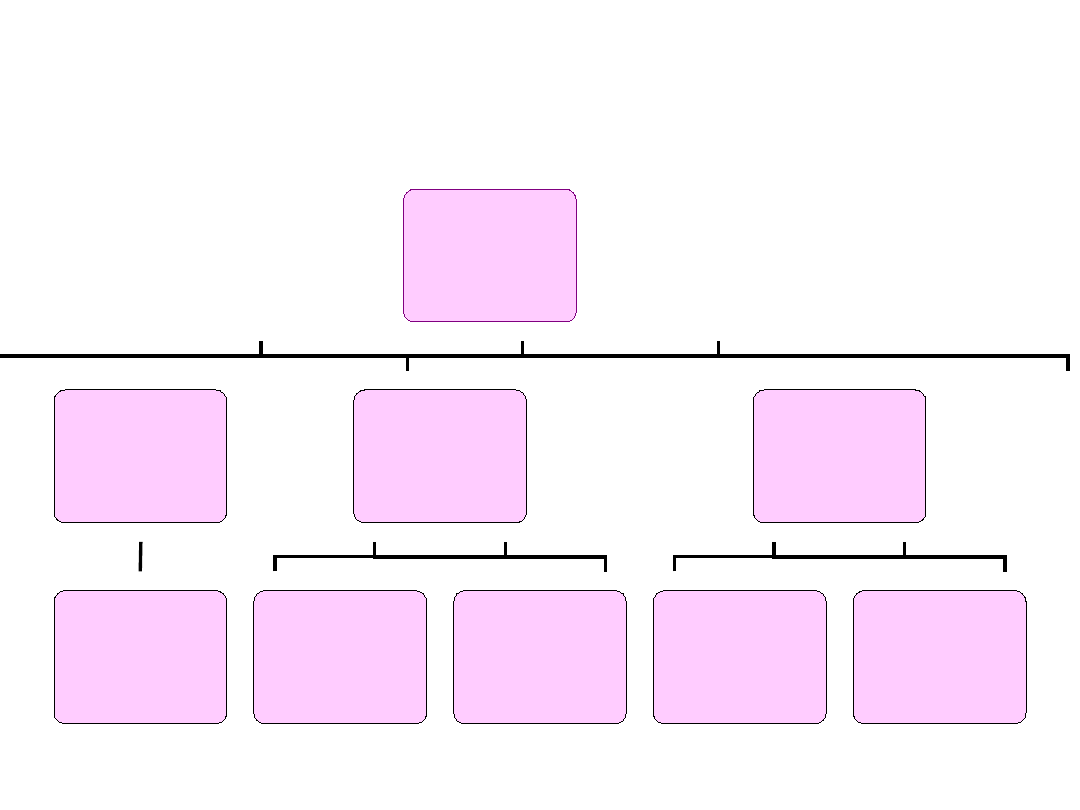
PODZIAŁ WĘGLOWODORÓW
WĘGLOWODORY
NASYCONE
wiązania
pojedyncze
NIENASYCONE
wiązania
podwójne
i potrójne
PIERŚCIENIOWE
Alkany:
metan, etan,
propan, butan….
Węglowodory
cykliczne:
cykloalkany,
cykloalkeny
i cykloalkiny
Aromatyczne:
benzen
Alkeny:
eten, propen,
but-1-en…
Akliny:
etyn (acetylen),
propyn…
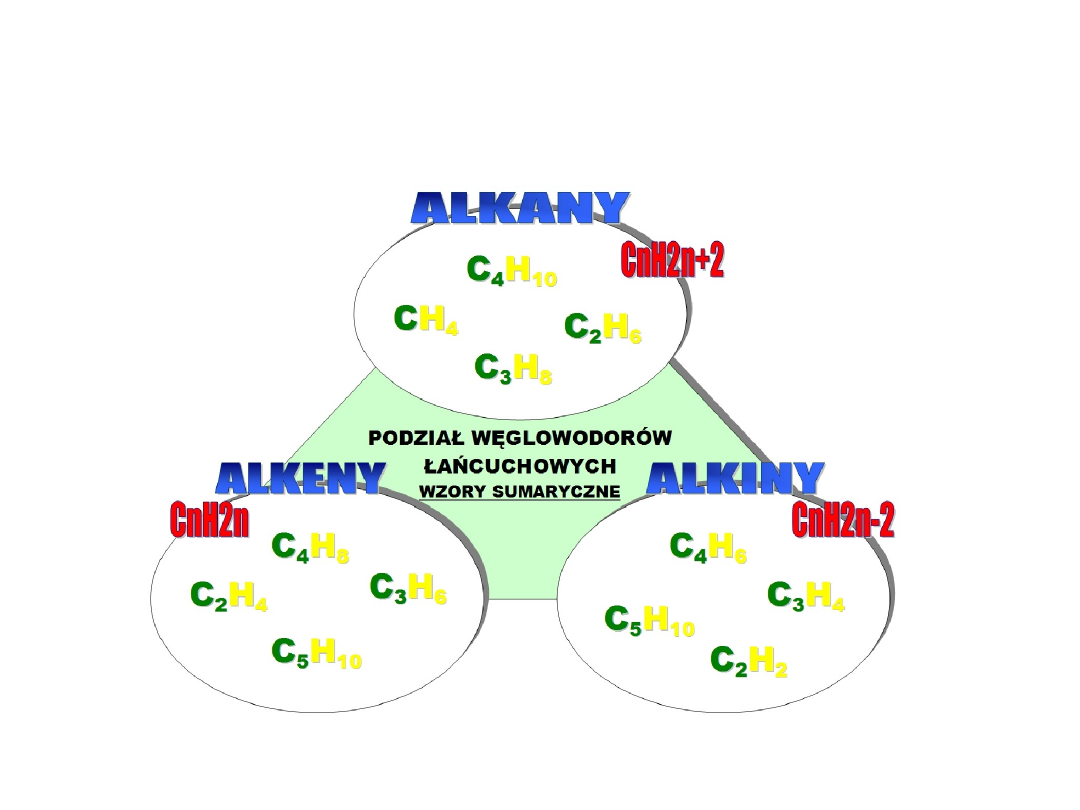
WĘGLOWODORY
ŁAŃCUCHOWE
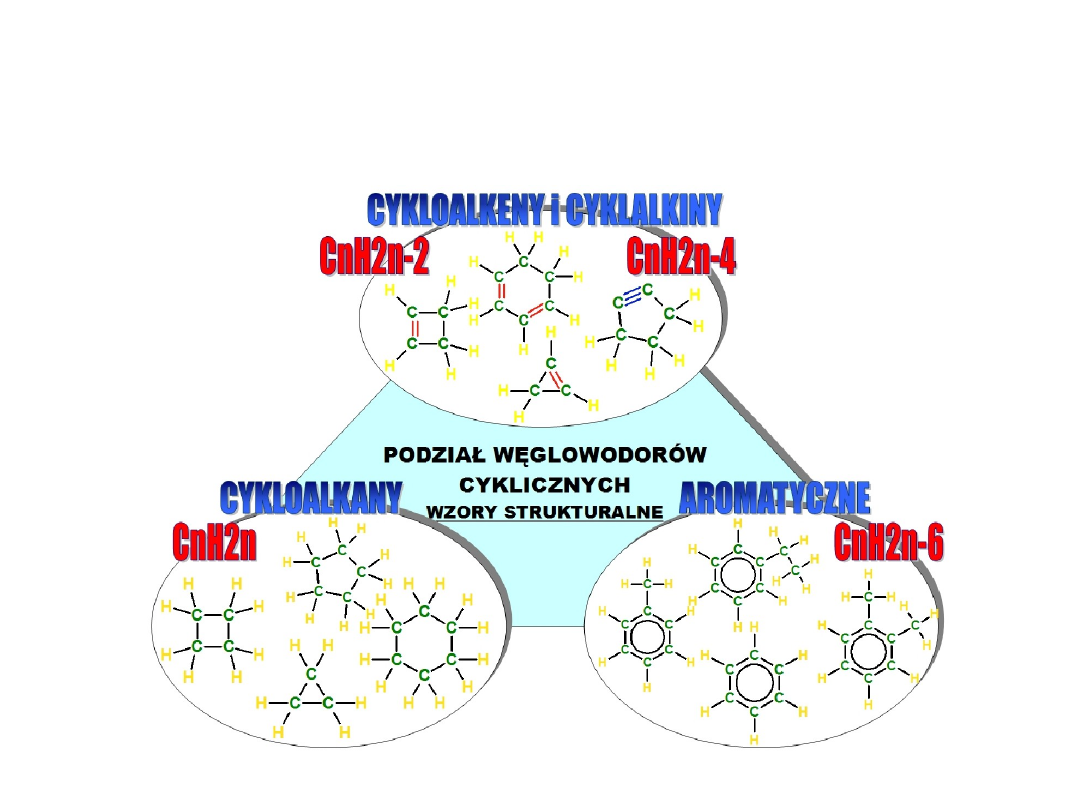
WĘGLOWODORY CYKLICZNE

ALKANY
• łańcuchowe węglowodory nasycone
• wzór ogólny: C
n
H
2n+2
• Hybrydyzacja : sp3
• Nazewnictwo:
- nazwy alkanów oprócz pierwszych
czterech odpowiadają liczbie atomów
węgla w łańcuchu
- tworzymy je poprzez dodanie końcówki
–an do przedrostków określających liczbę
atomów węgla

ALKANY – REGUŁY
NAZEWNICTWA
- W rozpatrywanej cząsteczce wybiera się najdłuższy
łańcuch węglowy i nazwę alkanu odpowiadającemu
temu łańcuchowi przyjmuje się jako podstawę tworzonej
nazwy
- Atomy węgla w najdłuższym łańcuchu numeruje się
zaczynając od jednego z atomów skrajnych. Kierunek
numeracji powinien być taki, żeby liczby wskazujące
położenie podstawników były jak najmniejsze
- Nazwy grup alkilowych będących podstawnikami przy
atomach węgla z najdłuższego łańcucha są wymieniane
w porządku alfabetycznym
- Liczbę podstawników identycznych zaznacza się
przedrostkami di- tri- tetra-
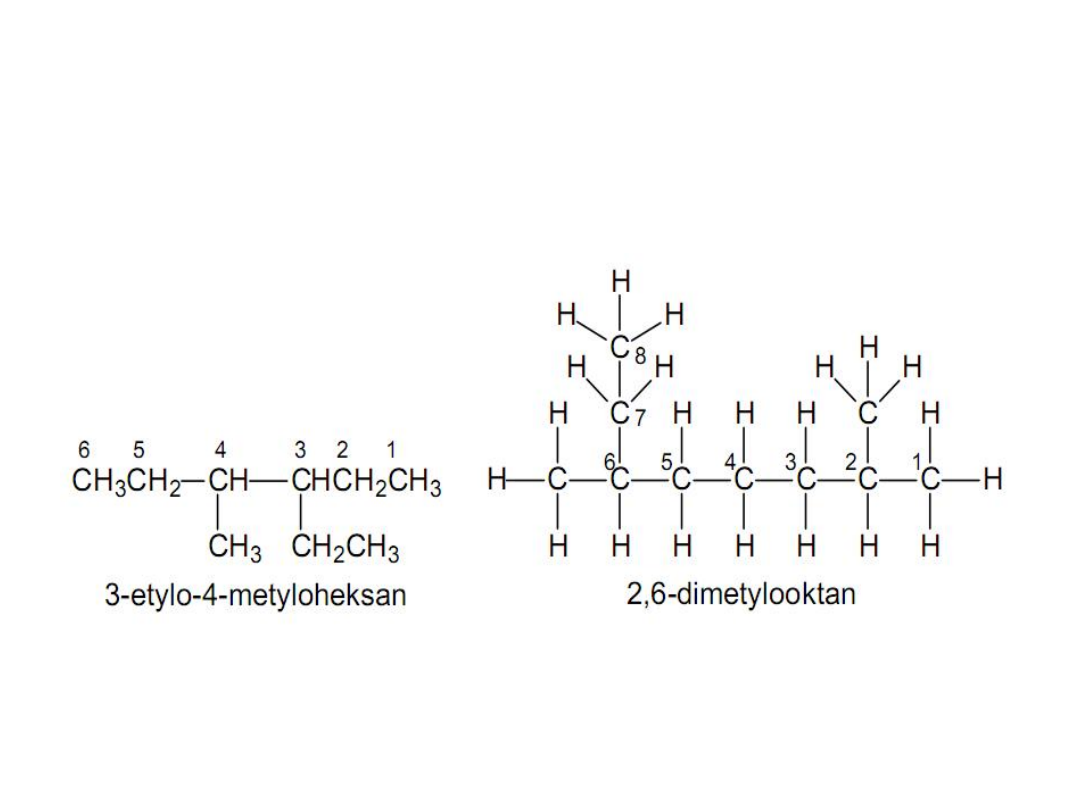
PRZYKŁADY

ALKANY - OTRZYMYWANIE
A)
Uwodornienie C lub CO
2
C (lub CO
2
) + 2H
2
CH
4
(+H
2
0)
B) Redukcja CO
2
CO
2
+ 4H
2
(Ni, temp.) CH
4
+ 2H
2
O
C) Uwodornienie alkenów/alkinów
CH
2
=CH
2
(lub CHΞCH) + H
2
(Pt) C
2
H
6
D) Redukcja halogenopochodnych
R-X ([H]) R-H + HX

ALKANY - OTRZYMYWANIE
E) Reakcja Wurtza
2R-X + 2 Na R-R + 2NaX
G) Hydroliza związków
metaloogranicznych
Al
4
C
3
+ 12 HCl
(aq)
3CH
4
+ 4HCl
3
R
2
Zn + 2H
2
O 2 R-H + Zn(OH)
2

ALKANY – REAKCJE
Reakcje podstawienia(chlorowania,
bromowania)
Są to reakcje wymiay podstawników
R-X + Y → R-Y +X

ALKANY – REAKCJE
• 3 etapy:
–
inicjowanie, wytwarzane są rodniki X2 pod wpływem
światła lub ciepła dysocjuje na atomy
–
kontynuacja
Cl˙ + CH
4
CH
3
˙ + HCl
CH
3
˙ + Cl
2
CH
3
Cl + Cl˙
–
zakończenie – przerwanie reakcji łańcuchowej –
reakcja zużywająca wolne rodniki
2 Cl˙ Cl
2
2 CH
3
˙ CH
3
CH
3
Cl˙ + CH
3
˙ CH
3
Cl

• Nitrowanie
R-H(g) + HNO
3
(g) → R-NO
2
+ H
2
(g)
Reakcja przebiega pod wpływem temperatury i ciśnienia
• Izomeryzacja
CH
3
-CH
2
-CH
2
-CH
3
pod wpływem AlCl
3
i temp. Daje CH
3
-
CH
2
(CH
3
)-CH
3
• Piroliza
– CH
3
-CH
2
-CH
2
-CH3 pod wpływem temp. 600 stopni
Celsjusza rozpada się na CH
3
* + CH
3
CH
2
CH
2
*
ALKANY – REAKCJE

CYKLOALKANY
• Cykloalkany:
• różnią się od alkanów budową
pierścieniową.
• nazwy tworzymy przez dodanie
przedrostka cyklo- do nazwy alkanu.
• ulegają reakcji utleniania,
izomeryzacji, aromatyzacji.
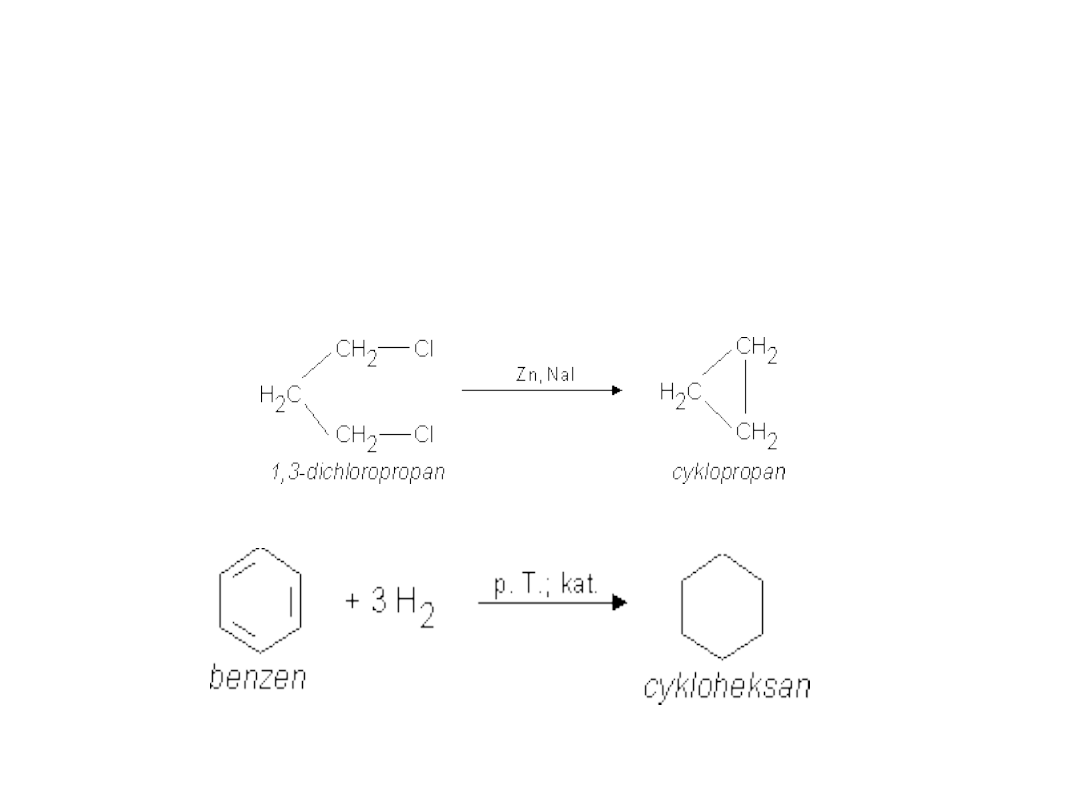
CYLKOALKANY -
OTRZYMYWANIE
A) Cyklizacja alifatycznych związków
łańcuchowych
B) Hydrogenacja związków
aromatycznych
C) Pozyskiwanie z ropy naftowej
ALKENY
• Ogólny wzór – C
n
H
2n
• Węglowodory nienasycone posiadające w
swojej cząsteczce wiązanie podwójnie
• Hybrydyzacja: sp2
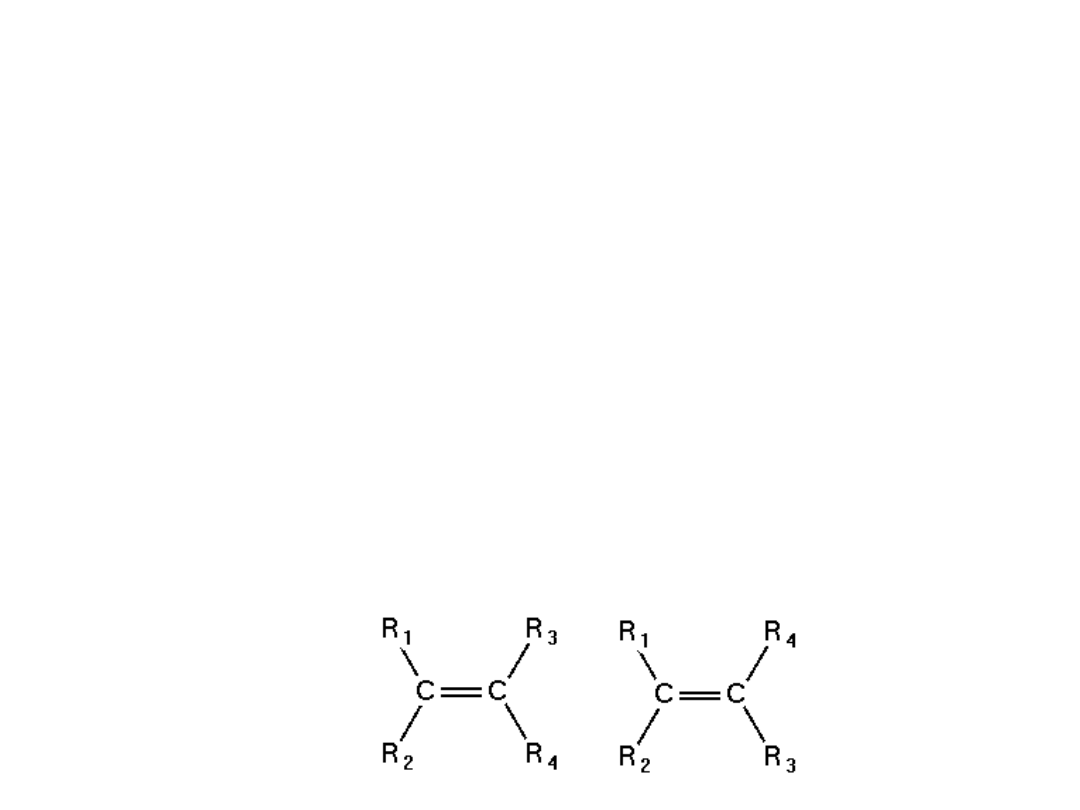
• Występuje izomeria:
A) METAMERIA
CH
2
=CH—CH
2
—CH
3
CH
3
—CH=CH—CH
3
B) IZOMERIA CIS-TRANS

ALKENY
•REGUŁA ZAJCEWA:
Podczas
reakcji
eliminacji
wiązanie
podwójnie powstaje tak, aby było położone
możliwie centralnie w cząsteczce.
•REGUŁA MARKOWNIKOWA:
W reakcjach addycji niesymetrycznych
reagentów do niesymetrycznych alkenów
atom wodoru przyłącza się tam, gdzie jest
już więcej atomów wodoru.
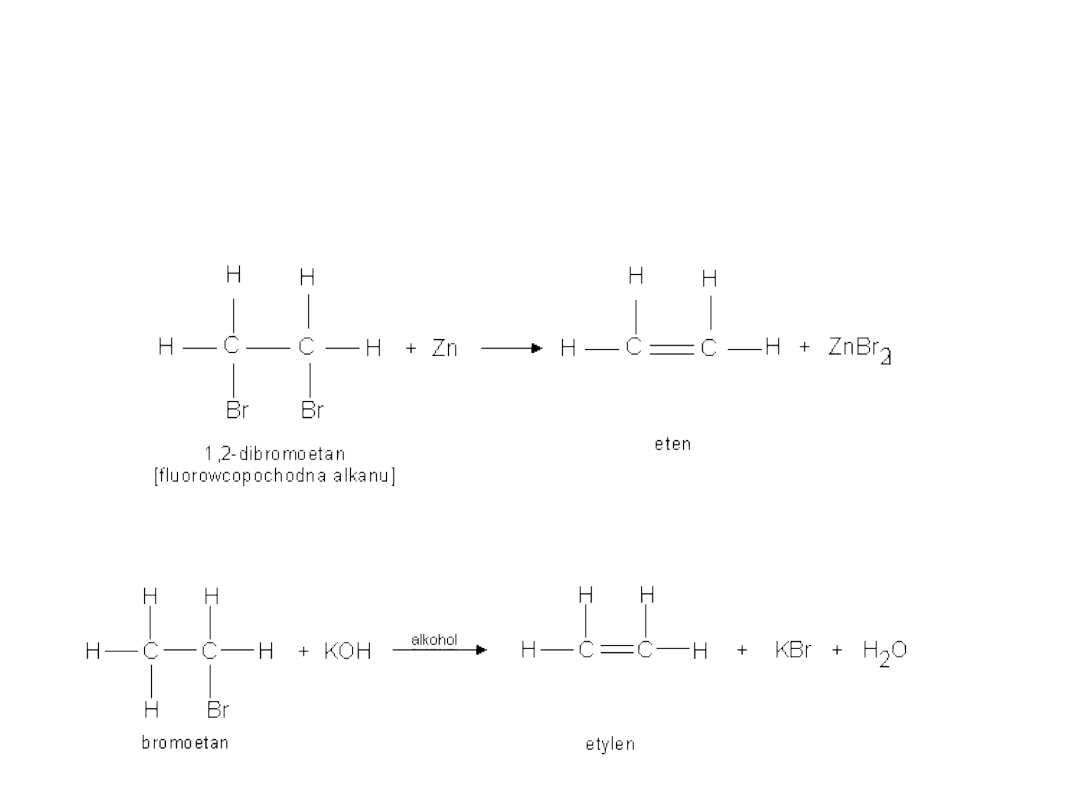
ALKENY - OTRZYMYWANIE
A) Eliminacja halogenku = Dehalogenacja
B) Eliminacja hydrohalogenku =
Dehydrohalogenacja
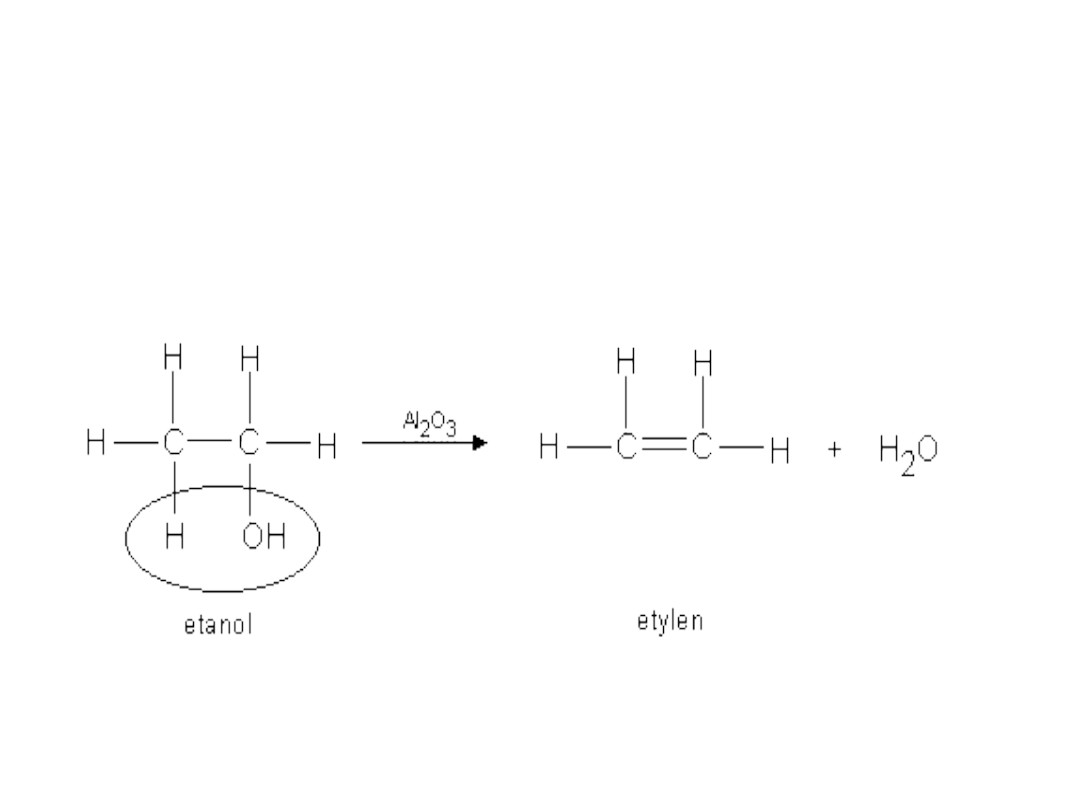
ALKENY – OTRZYMYWANIE
Reakcje alkenów:
C) Eliminacja wody = Dehydratacja
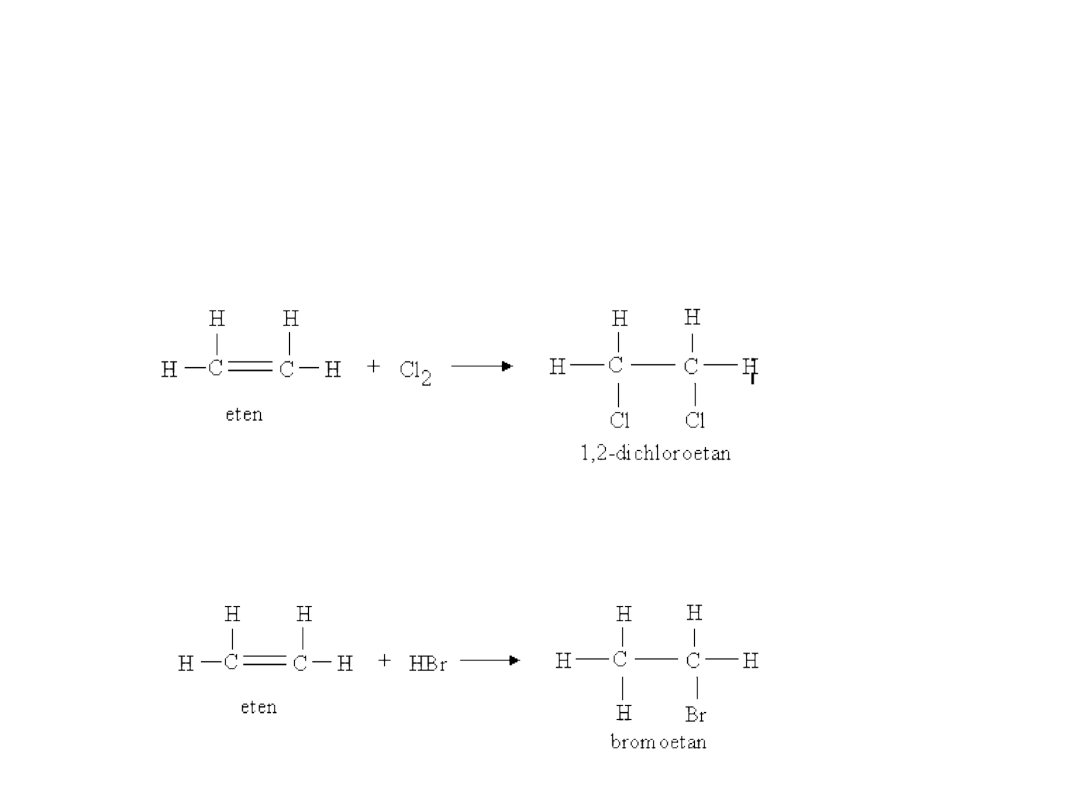
ALKENY – REAKCJE
A) Addycja halogenów = Halogenacja
B) Addycja hydrohalogenku =
Hydrohalogenacja
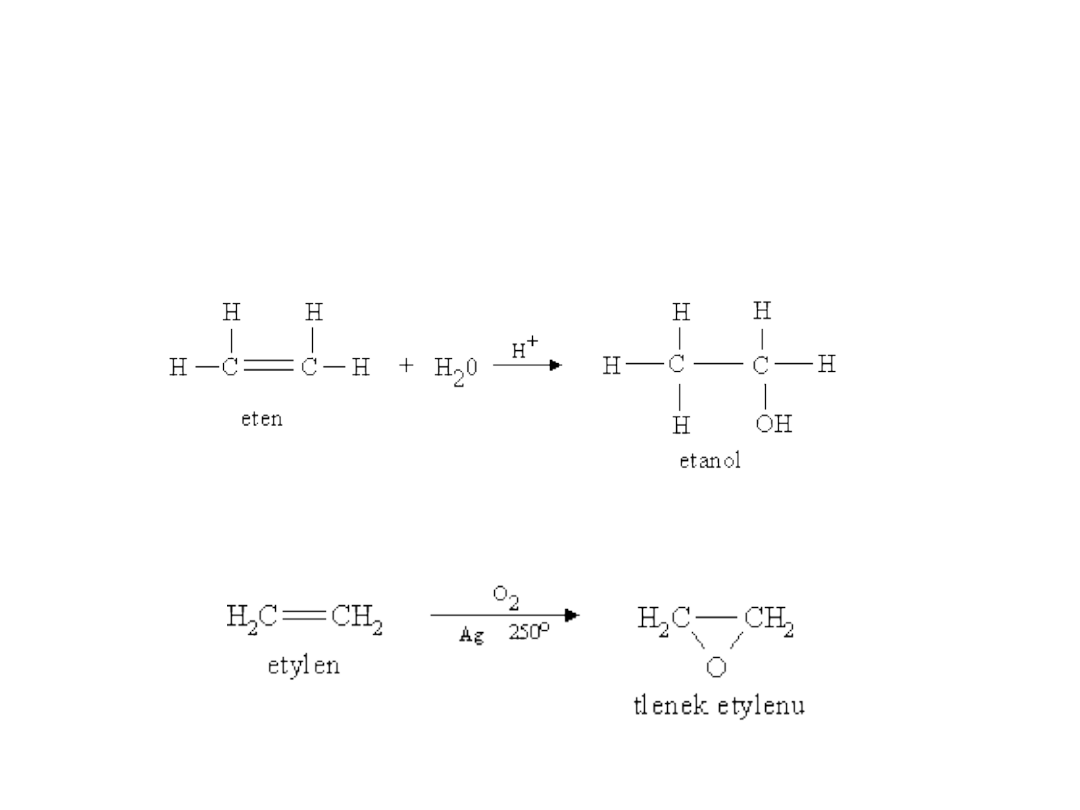
ALKENY – REAKCJE
C) Addycja wody = Hydratacja
D) Utlenianie do epoksydu
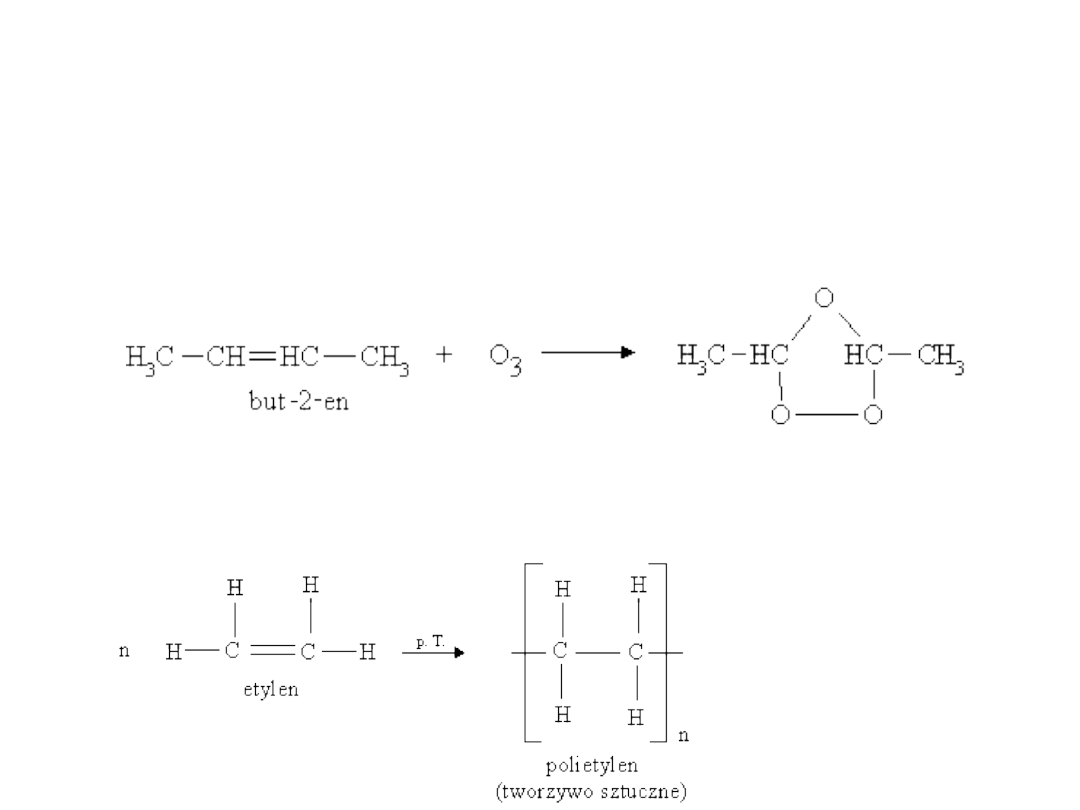
ALKENY – REAKCJE
E) Ozonoliza:
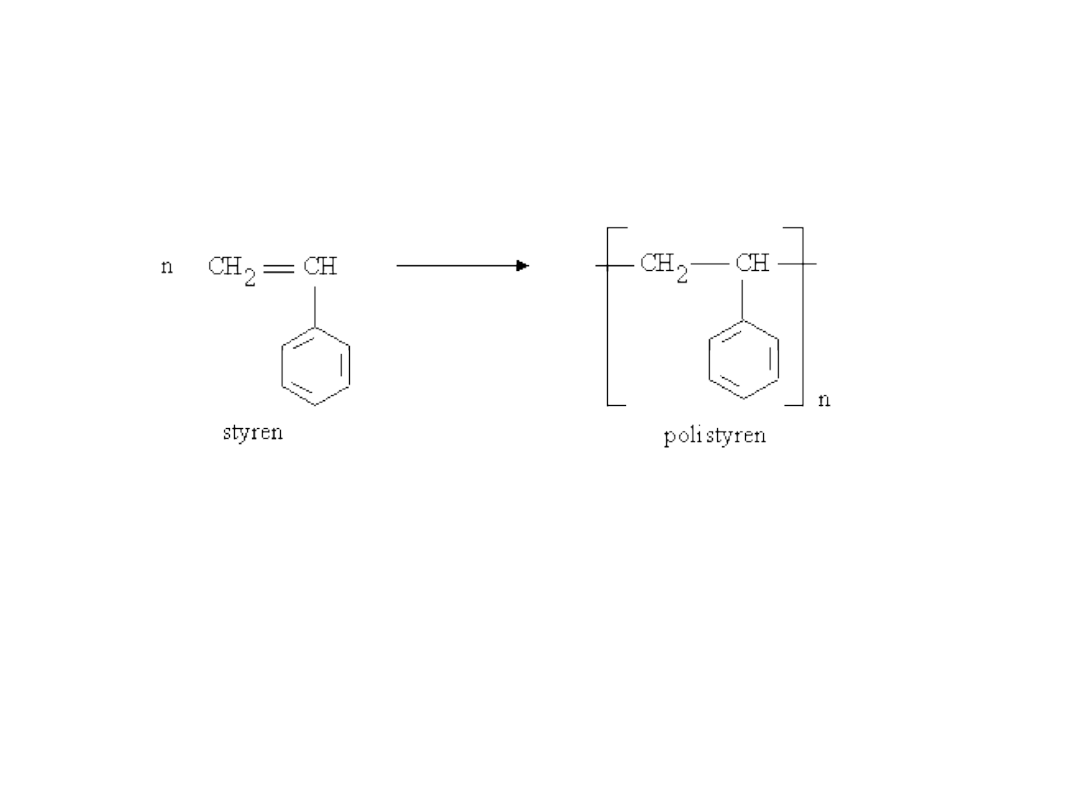
F) Polimeryzacja:
a) etylen
ALKENY – REAKCJE
b) chlorek winylu
c) tetrafluoroeten
ALKENY – REAKCJE
d) styren
G) Spalanie:
a) całkowite: C
2
H
4
+ 3O
2
---> 2CO
2
+ 2H
2
O
b) półspalanie: C
2
H
4
+ 2O
2
---> 2CO +
2H
2
O
c) spalanie niecałkowite: C
2
H
4
+ O
2
--->
2C + 2H
2
O
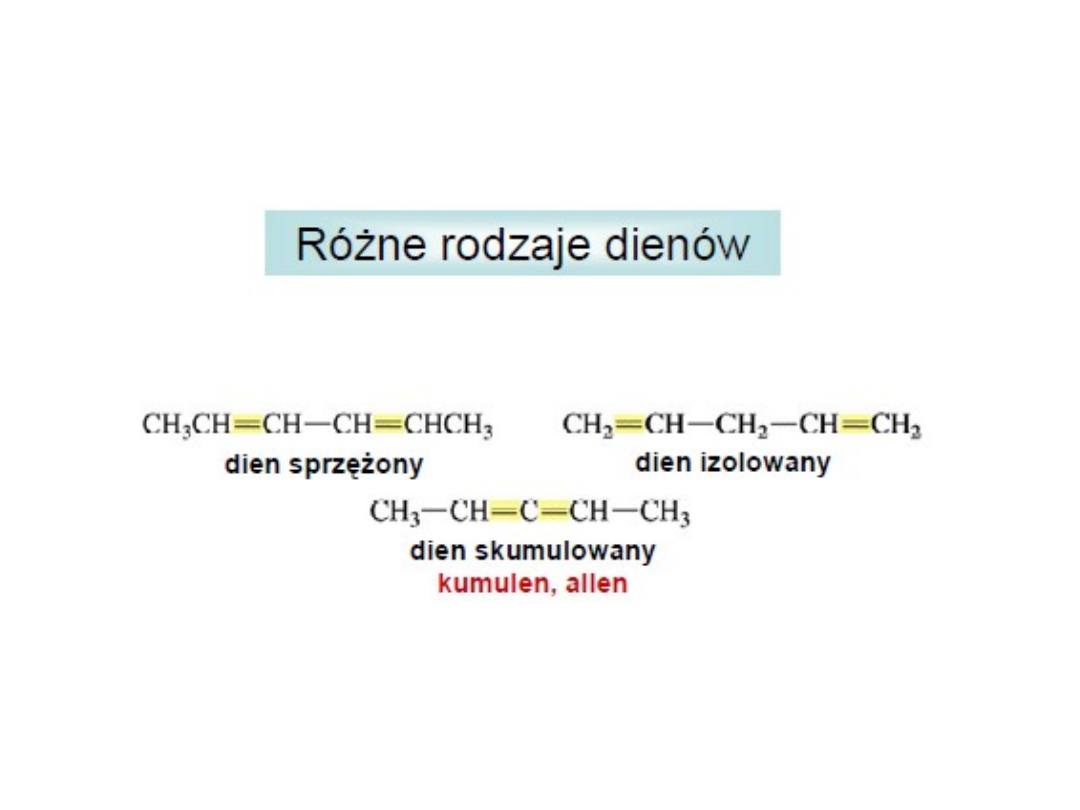
DIENY

ALKINY
• Węglowodory nienasycone
posiadające w swojej cząsteczce
wiązanie potrójne
• Wzór ogólny: C
n
H
2n-2
• Hybrydyzacja typu: sp

ALKINY – REAKCJE
A)
Addycja wodoru:
R – C≡CH + H
2
→ R – CH = CH
2
(na katalizatorze Lindlara: Pd/CaCO
3
)
R – C≡CH + 2 H
2
→ R – CH
2
– CH
3
(na katalizatorze Pd/C aktywny)
B) Addycja halogenku X
2
R – C≡CH + Br
2
→ R – CBr = CHBr
R – CBr = CHBr + Br
2
→ R – CBr
2
– CHBr
2
C) Addycja halogenowodoru HX
R – C≡CH + HBr → R – CBr CCH
2
R – CBr = CH
2
+ HBr → R – CBr
2
– CH
3

ALKINY – REAKCJE
• REAKCJE ALKINÓW:
D) Addycja wody = Synteza Kuczerowa
R – C≡CH + H
2
O → R – CO – CH
3
(w obecności HgSO
4
i H
2
SO
4
)
E) Spalanie
2 C
2
H
2
+ O
2
→ 4 C + 2 H
2
O (spalanie
niecałkowite)
2 C
2
H
2
+ 5 O
2
→ 4 CO
2
+ 2 H
2
O (spalanie
całkowite)
F) Odbarwianie wody bromowej
HC≡CH + Br
2
(aq) → CHBr = CHBr
CHBr = CHBr + Br
2
(aq) → CBr
2
– CBr
2

ALKINY - OTRZYMYWANIE
A) eliminacja HX z halogenków alkilowych
R – CCl = CH – R + KOH → R – C≡C – R + KCl
+ H2O
(w obecności etanolu)
R – CHCl – CHCl – R + 2 KOH → R – C≡C – R + 2
KCl + 2 H2O
(w obecności etanolu)

ALKINY - OTRZYMYWANIE
B) Otrzymywanie acetylenu
a) reakcja karbidu (węglik wapnia) z wodą
CaC2 + 2 H2O → C2H2 + Ca(OH)2
lub
CaC2 + 2 HCl → C2H2 + CaCl2
b) piroliza (rozkład w wysokiej temperaturze)
metanu
2 CH4 → C2H2 + 3 H2 (temperatura ok. 1200
º C)

WĘGLOWODORY
AROMATYCZNE
• Benzen – charakterystyka
– Wyodrębniony ze smoły węglowej
– Węgle w jego cząsteczce wykazują hybrydyzację sp2
– Jego struktura przestrzenna i nakładając się orbitale
sprawiają, że w przypadku jego cząsteczki benzenu mówimy
o UKŁADZIE WIĄZAŃ ZDELOKALIZOWANYCH ( tzw.
zdelokalizowany sekstet elektronowy)
– Efektem wiązań zdelokalizowanych jest powstanie chmury
elektronowej zarówno nad , jak i pod płaszczyzną pierścienia,
dlatego analizując strukturę cząsteczki ustalamy
poszczególne wiązania jako pojedyncze lub podwójne tylko
formalnie, w rzeczywistości te wiązania to coś pomiędzy
jednym i drugim)

BENZEN – WŁAŚCIWOŚCI
CHEMICZNE
A.
Benzen nie zachowuje się jak związek nienasycony
(nie reaguje z wodą bromową i roztworem
nadmanganianu potasu w zwykłych warunkach,
wykazując podobieństwo do alkanów)
B.
Wiązania C – C w benzenie są krótsze niż wiązania
pojedyncze, ale dłuższe niż wiązania podwójne w
etenie
C.
Benzen spala się kopcącym płomieniem, pary benzenu
tworzą z powietrzem mieszaninę wybuchową.
D.
Ulega reakcji podstawienia w pierścieniu
aromatycznym. (podobieństwo do alkanów) - reakcja z
bromem lub chlorem w obecności katalizatora.
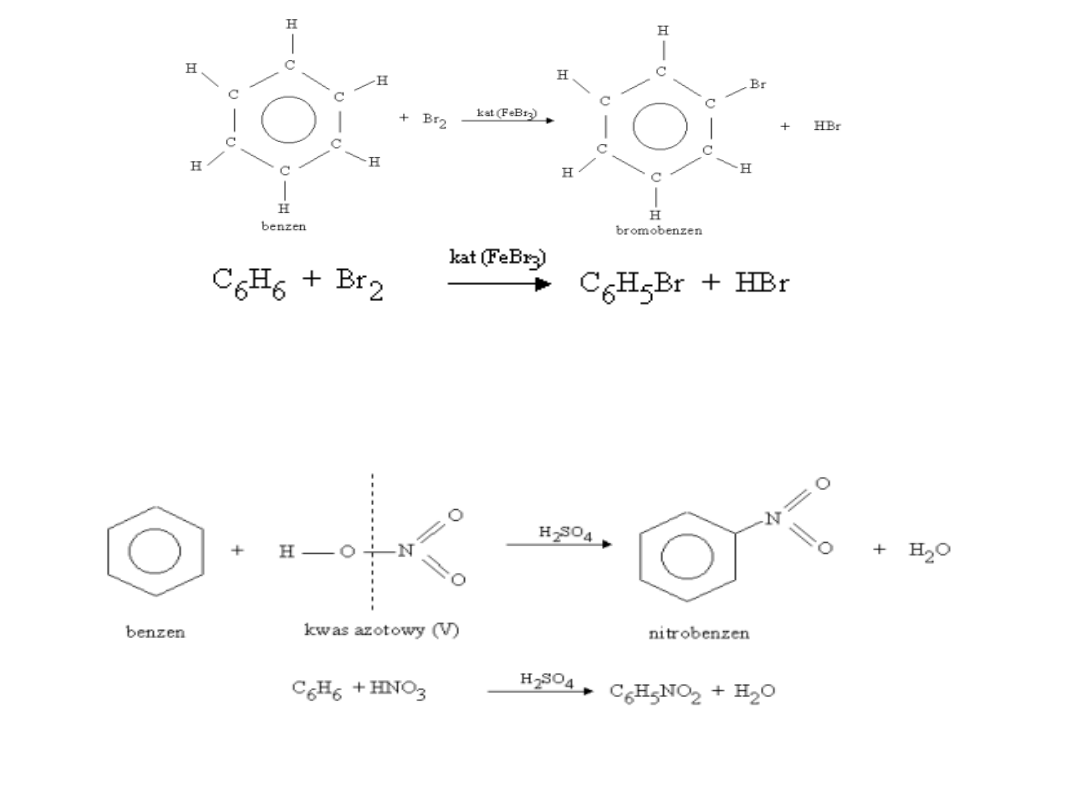
D. Reakcja nitrowania Reakcja z tzw. mieszaniną nitrującą
(mieszaniną stężonych kwasów: azotowego i siarkowego.
Jest to reakcja podstawienia atomu wodoru grupą nitrową
(reakcja charakterystyczna dla związków aromatycznych.)
E. Reakcja uwodornienia (reakcja przyłączenia - podobieństwo
do alkenów)
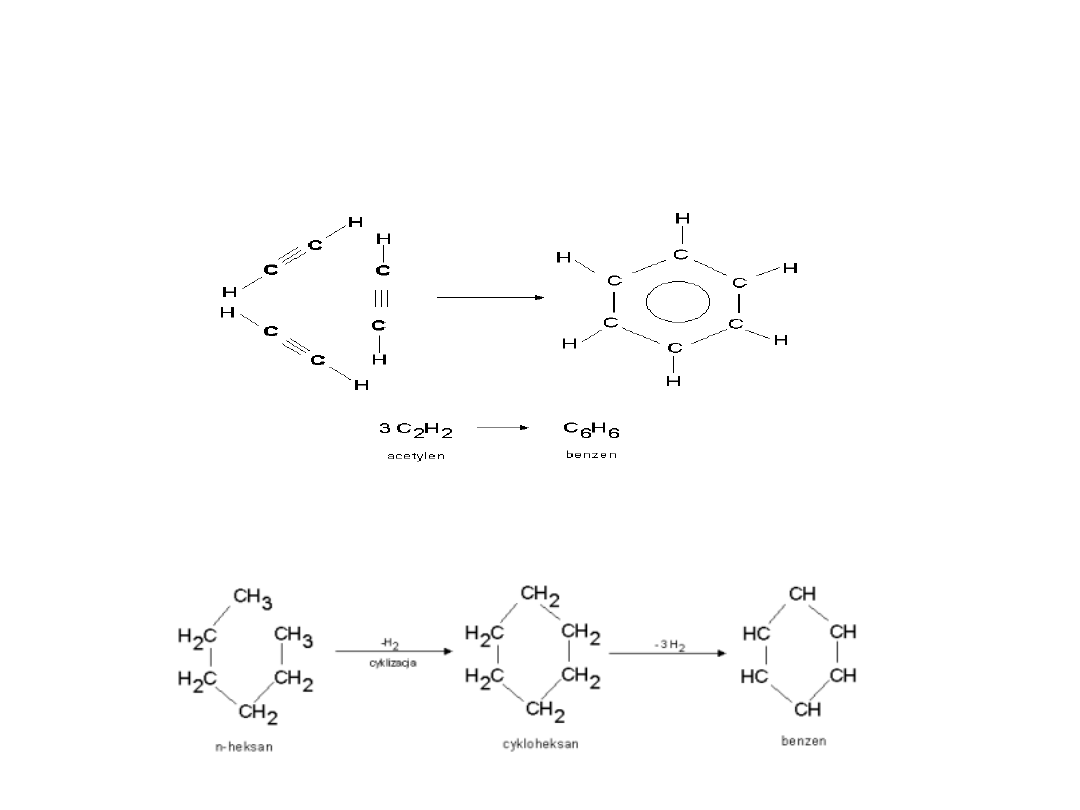
BENZEN - OTRZYMYWANIE
1. Trimeryzacja cząsteczek acetylenu
2. Na skalę przemysłową w procesie cyklizacji (zamknięcia w
pierścień zawartych w ropie naftowej alkanów) i odwodornienia
powstałych cykloalkanów.
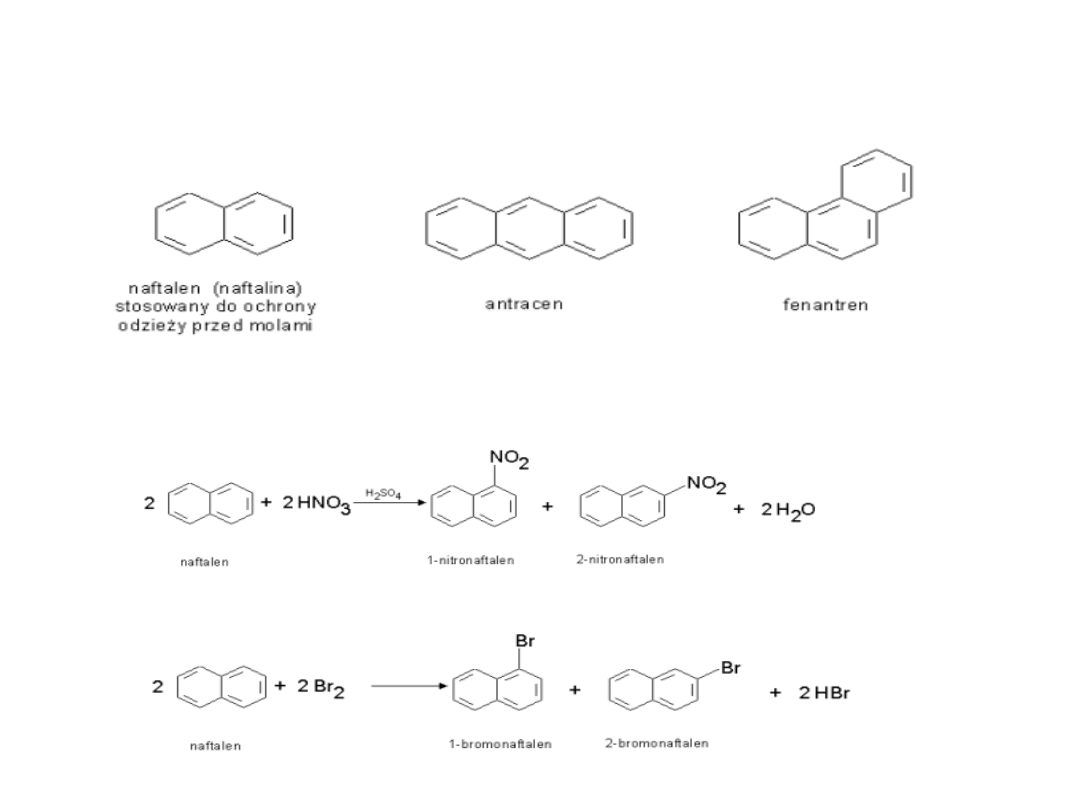
INNE ZWIĄZKI
AROMATYCZNE
Związki te ulegają reakcjom chemicznym analogicznie do benzenu
a) reakcja nitrowania
b) reakcja bromowania

WŁAŚCIWOŚCI HOMOLOGÓW
BENZENU
• Najbliższe homologi benzenu są podobnie jak on :
cieczami bezbarwnymi, nierozpuszczalnymi w
wodzie, o gęstości mniejszej niż gęstość wody.
• Naftalen:
– białe ciało stałe
– charakterystyczny zapach
– nie rozpuszcza się w wodzie
– łatwo sublimuje ( ze względu na strukturę kryształu,
tzn. tak jak beznen tworzy kryształ cząsteczkowy, czyli
taki, gdzie cząsteczki przyciągają się jedynie słabymi
siłami van der Waalsa), dlatego podczas ogrzewania
przechodzi bezpośrednio z fazy stałej w fazę gazową

KIERUJĄCY WPŁYW PODSTAWNIKÓW W REAKCJI SUBSTYTUCJI
ELEKTROFILOWEJ
• Analizowane wcześniej reakcje, jakim ulega benzen ( nitrowanie,
chlorowcowanie, alkilowanie ) są przykładami rekacji typu substytucji
elektrofilowej, w której cząsteczka benzenu zostaje zaatakowana przez
elektrofil, który ma niedobór elektronów lub jest jonem dodatnim.
Zachodzi ona w następujących etapach:
1. Wytworzenie elektrofila
2. Atak elektrofila na pierścień aromatyczny
3. Odtworzenie katalizatora
• Podstawnik już wprowadzony do pierścienia decyduje o miejscu ataku
elektrofilowego, czyli o miejscu przyłączenia nowego podstawnika. W
oparciu o to wyróżnia się 2 zasadnicze grupy podstawników :
PODSTAWNIKI I RODZAJU : kierują do pozycji orto- lub para-
Np. –CH3 , -C2H5, - OH, -SH, -NH2 , -Cl , -Br, -I , -F
PODSTAWNIKI II RODZAJU : kierują do pozycji meta-
Np. –NO2 , -CHO, -COOH , -COOR , -CONH2

HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
.
• OTRZYMYWANIE
• Metody oparte na reakcjach węglowodorów z fluorowcami
lub fluorowcowodorami podane wcześniej
• Reakcje podstawienia grupy hydroksylowej w alkoholach
• R – OH + HX → R – X + H2O
• R – OH + SOCl2 →R – Cl + HCl + SO2
• R – OH + PCl
5
→R – Cl + HCl + POCl
3
• 3R – OH + PBr
3
→3R – Br + H3PO
3
• (CH3)
3
C – OH + HCl →(CH3)
3
C – Cl + H2O
• CH3CH2– OH + SOCl2 →CH3CH2 – Cl + H – Cl + SO2

HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
Charakterystyczne reakcje
I. Reakcje substytucji nukleofilowej:
1. Hydroliza (synteza alkoholi)
R – X + H
2
O → R – OH + HX
R – X + KOH → R – OH + KX
R – X + Ag
+
+ H
2
O → R – OH + AgX + H
+
2. Synteza tioli
R – X + NaHS → R – SH + NaX
3. Synteza amin:
R – X + NH3 → R – NH2 + HX

HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
R – X + R1 – NH2 → R – NH – R1 + HX
II. Reakcje B-eliminacji
• Gdy nukleofil jest bardzo mocną zasadą, wówczas
zamiast substytucji następuje konkurencyjna
eliminacja.
R – CH2 – CH2 – X + KOH → R –CH = CH2 + KX + H2O
III. Synteza związków magnezoorganicznych =
Grignard’a
R – X + Mg → R – Mg – X

HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
• WŁAŚCIWOŚCI FIZYCZNE:
• stan skupienia w temp. pokojowej – ciecze; z
wyjątkiem CH3Cl i CH3Br, które są gazami
• temp. wrzenia: CH3l > CH3Br > CH3Cl > CH3F
• wrażliwe na światło – pod wpływem światła
często ulegają rozkładowi
• nie rozpuszczają się w wodzie
• chloroalkany – lżejsze od wody
• bromo– i jodoalkany – cięższe od wody
• lotne halogenoalkany są lakrymatorami

HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
Przykłady zastosowań halogenopochodnych węglowodorów
• CCl4 ; tetrachlorometan (tetrachlorek węgla); stosowany jako
rozpuszczalnik tłuszczów
• CHBrCl - CF3 ; 2-bromo-2-chloro-1,1,1-trifluoroetan (halaton);
środek do znieczulania ogólnego
• CHI3 ;Trijodometan (jodoform); żółta krystaliczna substancja,
właściwości antyseptyczne - używany jako zasypka do ran
powierzchniowych
• CHCl2 - CHCl2 ; Tetrachloroetan ; środek przeciwpasożytniczy dla
psów, rozpuszczalnik organiczny, może powodować uszkodzenie
wątroby
• CHCl3 ; Trichlorometan (chloroform); ciecz o charakterystycznym
zapachu, używany dawniej do znieczulenia, działał toksycznie na serce
i wątrobę i dlatego został wycofany. Pod wpływem wilgoci, światła
rozpada się na trujący fosgen i chlorowodór.

HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
• FREONY:
CFCl3 (trichlorofluorometan) freon -11
CCl2F2 (dichlorodifluorometan) freon -12
Czynniki chłodzące w chłodziarkach sprężarkowych
• HALON
CBrClF2 (bromochlorodifluorometan)
Środek gaśniczy
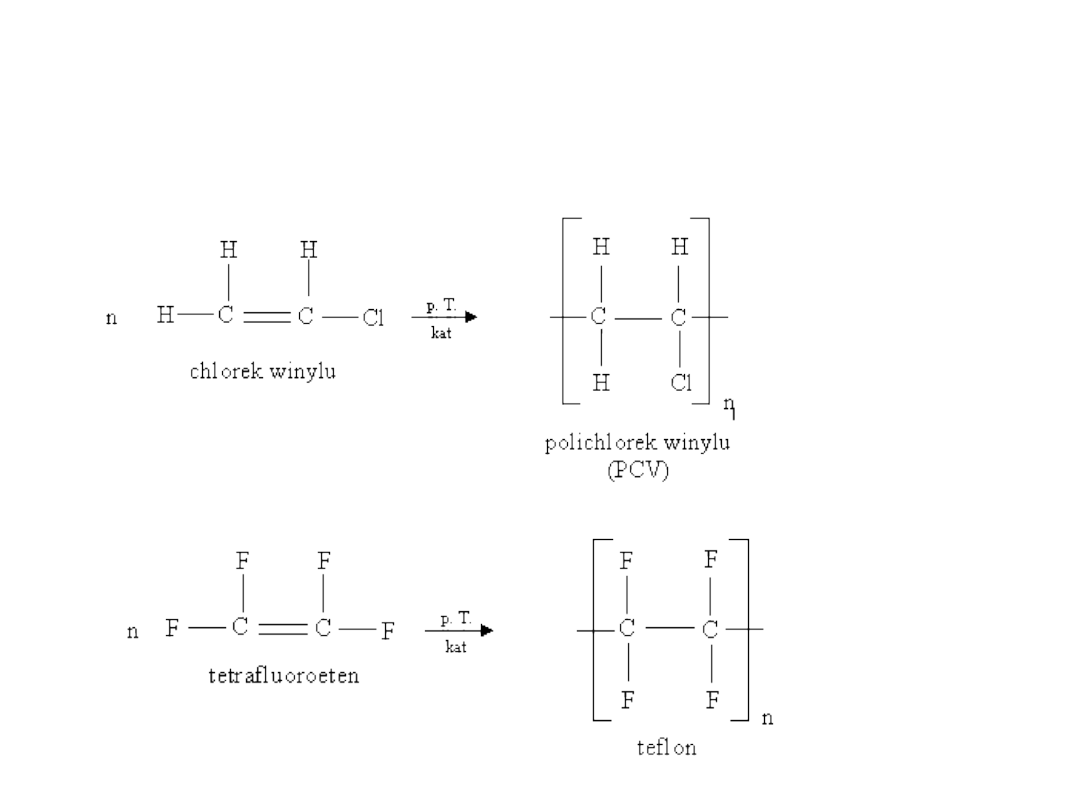
POLICHLOREK WINYLU (PCV)
Substancją wyjściową jest chlorek winylu [CH2=CHCl (chloroeten)], który
poddany procesowi polimeryzacjii tworzy polichlorek winylu [-CH2-CHCl-]n
Do produkcji tworzyw sztucznych
• TEFLON
Substancją wyjściową jest tetrafluoroeten [CF2=CF2], który poddany
procesowi polimeryzacji tworzy teflon [-CF2-CF2-]n
Tworzywo odporne na chemikalia i temperaturę (patelnie teflonowe)

WĘGLOWODORY W PRZYRODZIE.
• Najważniejsze surowce naturalne
zawierające węglowodory to:
– Gaz ziemny
– Ropa naftowa
– Węgiel kamienny

Gaz ziemny
Skład:
• Gaz ziemny jest mieszaniną lekkich alkanów.
• Głównym jego składnikiem jest metan (50% - 98%),
a pozostałe to oprócz węglowodorów: azot,
dwutlenek węgla, siarkowodór, hel.
Występowanie:
• Gaz ziemny pod zwiększonym ciśnieniem tworzy
pokłady tzw. gazu suchego, ale najczęściej
towarzyszy złożom ropy naftowej jako tzw. gaz
mokry.
• W Polsce występuje na Podkarpaciu (Jasło, Krosno),
w okolicach Lubaczowa i Rybnika.

Gaz ziemny
Przeróbka gazu ziemnego może być prowadzona metodami:
• zachowawczą, polegającą na rozdziale mieszaniny
węglowodorów na podstawie
różnych własności fizycznych;
• przetwórczą , zmieniającą strukturę chemiczną
węglowodorów w celu otrzymania nowych produktów
Zastosowanie:
Gaz ziemny stosowany jest jako paliwo, np.
w domowych kuchenkach i piecach
centralnego ogrzewania oraz jako surowiec
dla przemysłu chemicznego
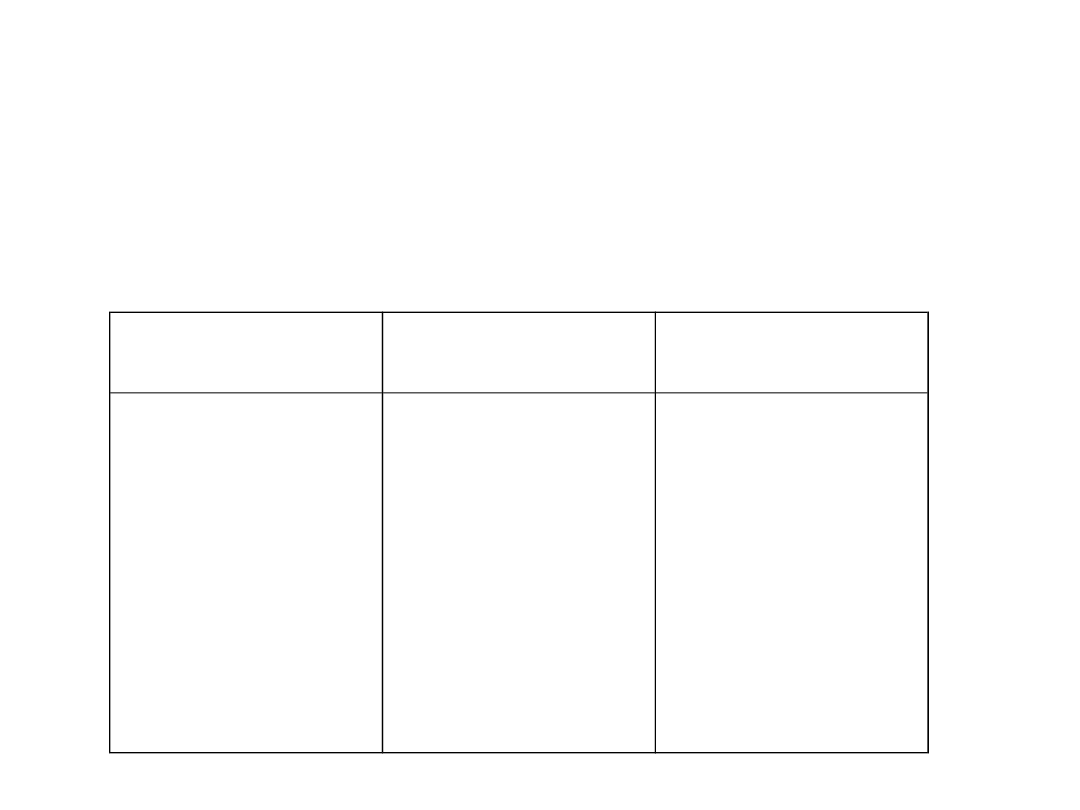
Ropa naftowa
• Z chemicznego punktu widzenia ropa naftowa to
mieszanina różnych węglowodorów. W węglowodorach
stałych rozpuszczone są węglowodory ciekłe i gazowe.
Niemetale
Związki
chemiczne
Metale
węgiel(C)
wodór(H)
siarka(S)
tlen(O)
azot(N)
chlorek
sodu(NaCl)
siarkowodór(H2
S)
amoniak(NH3)
woda(H2O)
fenole
tioalkohole
związki
heterocykliczne
nikiel(Ni)
mangan(Mn)
żelazo(Fe)
chrom(Cr)
sód(Na)
rtęć(Hg)

Ropa naftowa
Destylacja frakcyjna
•
Najważniejszym procesem przeróbki ropy
naftowej jest destylacja frakcyjna, w której
wykorzystuje się różnice temperatur wrzenia
poszczególnych składników ropy. Pozwala ona
rozdzielić ropę na frakcje, czyli grupy związków
organicznych mających zbliżone własności
•
Polski chemik - Ignacy Łukasiewicz
przeprowadził pierwszą destylację ropy naftowej
i wybudował pierwsze rafinerie.
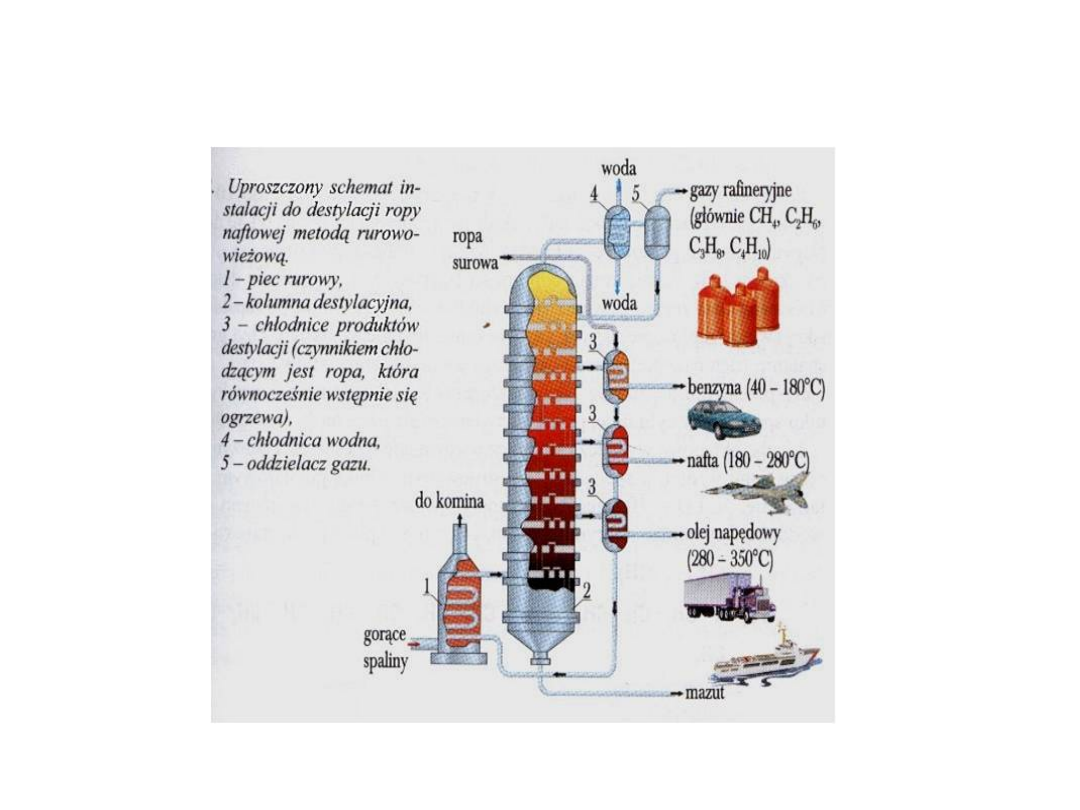
Ropa naftowa
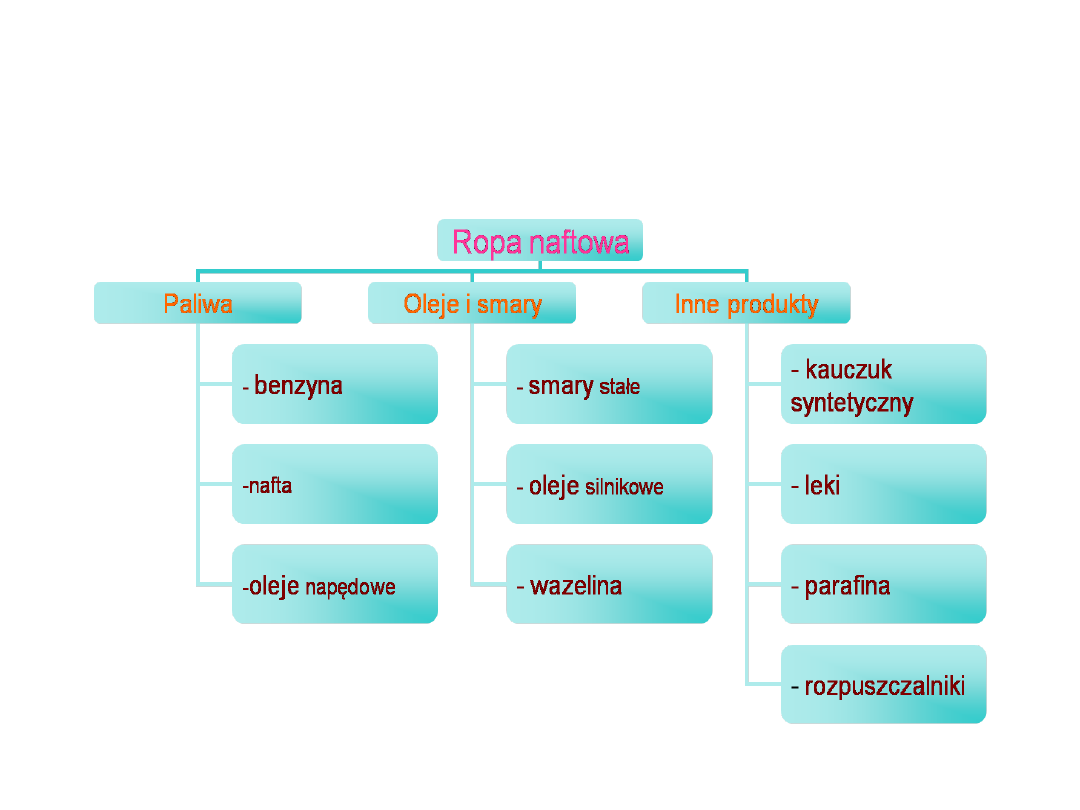
Ropa naftowa
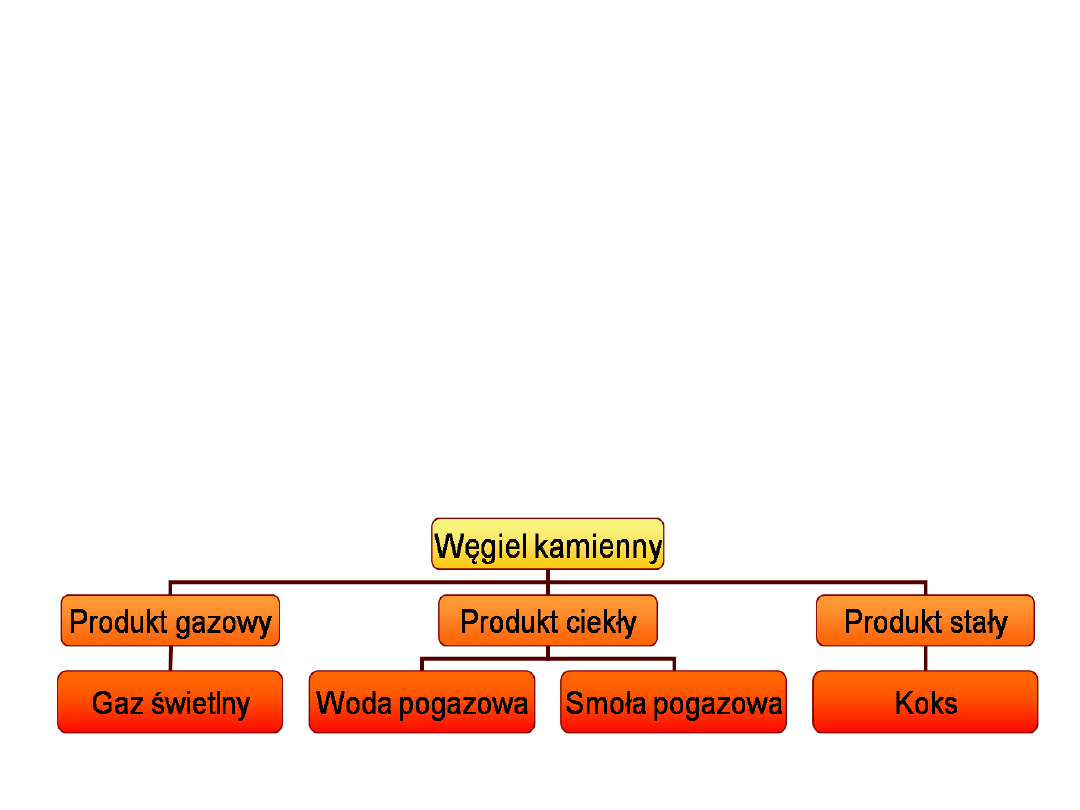
Węgiel kamienny
• Nieustanne, powolne ruchy skorupy ziemskiej w
odległych okresach geologicznych spowodowały,
że martwe organizmy roślinne zostały odcięte od
dostępu tlenu i pod wpływem temperatury oraz
ciśnienia przekształciły się w pokłady węgla.
• Węgiel kamienny zawiera: 80-95% C, 4-5,5% H, 3-
13% O, 1,4-1,8% N, 0,3-0,7% S, 3-11% popiołu.
Produkty suchej destylacji:

Pojęcia
• Kraking – jest procesem rozkładu alkanów o dużych
cząsteczkach na związki o mniejszych cząsteczkach.
• Reforming – jest procesem przetwarzania alkanów
łańcuchowych w związki rozgałęzione.
• Sucha destylacja – to proces ogrzewania substancji
bez dostępu powietrza.
• Liczba oktanowa – określa przydatność benzyny
jako paliwa do silników spalinowych z zapłonem
iskrowym, a wyznacza się ją przez porównanie
właściwości benzyny z właściwościami wzorca:
izooktanu.
• Liczba cetanowa – jest odpowiednikiem liczby
oktanowej, ale dla
paliw w silnikach z zapłonem
samoczynnym (silniki Diesla)

Właściwości biologiczne
węglowodorów.
• Do związków najczęściej spotykanych w rożnych dziedzinach działalności człowieka
należą węglowodory różnych typów, stosowane szeroko jako paliwa, surowce i
półprodukty przemysłowe oraz jako rozpuszczalniki.
• Węglowodory nasycone, z którymi mamy do czynienia najczęściej ( benzyna,
paliwo do zapalniczek, gaz ziemny itd.), nie wywierają działania toksycznego o ile
kontakt z nimi nie jest zbyt długotrwały i stężenia w powietrzu nie są zbyt wysokie.
• Charakterystyczne dla gazowych i łatwo lotnych węglowodorów nasyconych i
nienasyconych są ich właściwości narkotyczne : ALKANY – są słabymi narkotykami,
CYKLOPROPAN - wdychany w mieszaninie z tlenem, wywołuje bardzo szybko
głęboką narkozę, ETYLEN i ACETYLEN – też wywołują stan narkozy chirurgicznej i
bywają sporadycznie stosowane w tym celu.
• Węglowodory aromatyczne są natomiast silnie trujące, a wśród nich najbardziej
niebezpieczny jest BENZEN ( jedna z najbardziej niebezpiecznych trucizn
przemysłowych). Wdychanie par benzenu nawet o niewielkim stężeniu prowadzi do
ciężkich zatruć, m.in. do nieodwracalnego uszkodzenia układu krwiotwórczego i
białaczki. Objawy zatrucia rozwijają się powoli i są niedostrzegalne, a zmiany w
organizmie wywołane przez benzen są nieodwracalne !
• Są też węglowodory rakotwórcze ( głównie areny wielopierścieniowe ).

DZIĘKUJEMY
ZA UWAGĘ
Document Outline
- Slide 1
- Slide 2
- PODZIAŁ WĘGLOWODORÓW
- WĘGLOWODORY ŁAŃCUCHOWE
- WĘGLOWODORY CYKLICZNE
- Slide 6
- ALKANY
- ALKANY – REGUŁY NAZEWNICTWA
- PRZYKŁADY
- ALKANY - OTRZYMYWANIE
- ALKANY - OTRZYMYWANIE
- ALKANY – REAKCJE
- ALKANY – REAKCJE
- CYKLOALKANY
- CYLKOALKANY - OTRZYMYWANIE
- ALKENY
- ALKENY
- ALKENY - OTRZYMYWANIE
- ALKENY – OTRZYMYWANIE
- ALKENY – REAKCJE
- ALKENY – REAKCJE
- ALKENY – REAKCJE
- ALKENY – REAKCJE
- ALKENY – REAKCJE
- DIENY
- ALKINY
- ALKINY – REAKCJE
- ALKINY – REAKCJE
- ALKINY - OTRZYMYWANIE
- ALKINY - OTRZYMYWANIE
- WĘGLOWODORY AROMATYCZNE
- BENZEN – WŁAŚCIWOŚCI CHEMICZNE
- Slide 34
- BENZEN - OTRZYMYWANIE
- INNE ZWIĄZKI AROMATYCZNE
- WŁAŚCIWOŚCI HOMOLOGÓW BENZENU
- Slide 38
- HALOGENOPOCHODNE WĘGLOWODORÓW F–; Cl–; Br–; I– .
- HALOGENOPOCHODNE WĘGLOWODORÓW F–; Cl–; Br–; I–
- HALOGENOPOCHODNE WĘGLOWODORÓW F–; Cl–; Br–; I–
- HALOGENOPOCHODNE WĘGLOWODORÓW F–; Cl–; Br–; I–
- HALOGENOPOCHODNE WĘGLOWODORÓW F–; Cl–; Br–; I–
- HALOGENOPOCHODNE WĘGLOWODORÓW F–; Cl–; Br–; I–
- WĘGLOWODORY W PRZYRODZIE.
- Gaz ziemny
- Gaz ziemny
- Ropa naftowa
- Ropa naftowa
- Ropa naftowa
- Ropa naftowa
- Węgiel kamienny
- Pojęcia
- Właściwości biologiczne węglowodorów.
- Slide 55
Wyszukiwarka
Podobne podstrony:
PREZENTACJA WERSJA OSTATECZNA, Politologia, Administracja Publiczna
Płeć i rodzaj prezentacja wersja ostateczna
PREZENTACJA KSC 06 11 wersja ostateczna
Wojna Secesyjna 1861 1865 Prezentacja wersja ostateczna
WYKŁAD PL wersja ostateczna
DRZEWA LIŚCIASTE wersja ostateczna
2 Pytania z przedmiotu prawo prawo rodzinne i opiekuńcze na kolkwium ustne w 2014r wersja ostatecz
Bibliografia ( wersja ostateczna), Prywatne
wersja ostateczna
PROJEKCIK ekonomika wersja3 ostateczna, Ochrona Środowiska, semestr VI, Ekonomika i finanse ochrony
Mikrobiologia opracowanie na podstawie części II Skryptu WAM wersja ostateczna wreszcie kurna!!! , Z
kalkulacja dochodowosci produktow?nkowych wersja ostateczna
DYPLOMACJA CYFROWA wersja ostateczna, Studia
Leki p bólowe wersja ostateczna ostatecznej
Prawo miejscowe-referat wersja ostateczna, I SEMESTR, streszczenia na egzamin
Doktryny opracowanie zagadnień (wersja ostateczna) UMK
więcej podobnych podstron