Literatura
•
A. Bielański, „Chemia Nieorganiczna”, PWN, W-wa 2003
•
L. Kolditz (red.) „Chemia nieorganiczna”, PWN, W-wa 1994
•
F. A. Cotton, G. Wilkinson, P. L. Gaus, „Chemia nieorganiczna.
Podstawy”, PWN, W-wa 1998
Chemia nieorganiczna
•
J.D.Lee, „Zwięzła chemia nieorganiczna ”, PWN, W-wa 1994
•
A.W. Wells „Strukturalna chemia nieorganiczna” WNT W-wa wykład, 30 h
1993
•
D.F. Shriver, P.W. Atkins „Inorganic chemistry” Oxford University Press 2002
Dr hab. inż. Marian Turek, prof. Pol. Śl.
•
W.W. Porterfield “Inorganic chemistry. A unified approach”
Academic Press, Inc. San Diego, N.Y. , Boston, London, ul. B. Krzywoustego 6, p. 227
Sydney, Tokyo 1993
•
P. A. Cox “Chemia nieorganiczna. (krótkie wykłady)” PWN, W-Marian.Turek@polsl.pl
wa 2003
•
H.B. Gray „Elektrony i wiązania chemiczne” PWN W-wa, 1968
•
B. Jeżowska-Trzebiatowska, S. Kopacz, T. Mikulski „Pierwiastki rzadkie cz. I. Występowanie i technologia” PWN Warszawa –
Wrocław, 1976
PIERWIASTKI
• gazy atomowe (He, Ne, Ar, Kr Xe, Rn)
(wiązania van der Waalsa);
• gazy cząsteczkowe (H , O , F , Cl , N ) 2
2
2
2
2
Klasy substancji chemicznych
(wiązania atomowe i van der Waalsa);
• ciecze (ciekły niemetal – Br , ciekły metal – Hg); 2
• ciała stałe:
Substancje nieorganiczne
– cząsteczkowe substancje stałe (B , P , S , As ) 12
4
8
4
(wiązania atomowe i van der Waalsa);
– makrocząsteczki lub krystaliczne substancje stałe (diament grafit); (wiązania atomowe);
– metale
(wiązania metaliczne);
Związki chemiczne nieorganiczne
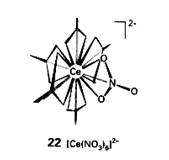
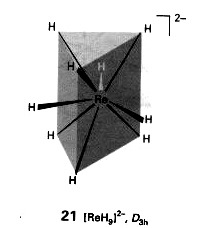
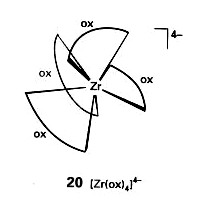
Związki koordynacyjne (przykłady)
Jonowe;
jednordzeniowe z ligandami jednopodstawnymi
- proste związki jonowe rozpuszczalne w wodzie lub innych rozpuszczalnikach polarnych:
* kwasy: HCl, HBr, HClO , HNO , H SO ............
4
3
2
4
* zasady: NaOH, KOH, Ca(OH) , Ba(OH) ...........
2
2
* sole: NaCl, AgNO , Na S, K SO , Na CO ........
3
2
2
4
2
3
- tlenki jonowe nierozpuszczalne w wodzie (Al O , Nb O ), tlenki mieszane (np.
2
3
2
5
krzemiany, spinele);
- halogenki (AgCl, TlCl), siarczki (PbS, ZnS), węgliki (CaC , Al C ) inne (SiC, GaAs, 2
4
3
BN);
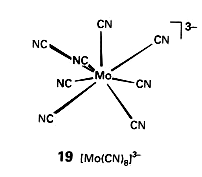
- związki zawierające solwatowane jony ([Ni(H O) ]2+, ałuny) lub jony kompleksowe 2
6
([Fe(CN) ]4-, [Co(NH ) ]3+, [SiF ]2-)
6
3 6
6
Cząsteczkowe;
jednordzeniowe z ligandami wielopodstawnymi
- proste związki cząsteczkowe (PF , SO , OsO , UF ); 3
2
4
6
- kompleksowe zwiazki zawierające metal:
[PtCl (PMe ) ] – dichloro-bis(trimetylofosfina) platyna(II), 2
3 2
[RuH(CO Me)(PPh ) ] – hydrydooctanotris(trifenylofosfina)ruten(II); 2
3 3
- związki metaloorganiczne zawierające wiązania M – C: [Ni(CO) ], [Zr(CH C H ) ] –
4
2
6
5 4
tetra(benzyl)cyrkon(IV), [U(C H ) ] – bis(η8-cyklookta-1,3,5,7-tetraen)uran 8
8 2
Stopy;
- międzywęzłowe;
- substytucyjne.
1
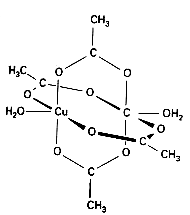
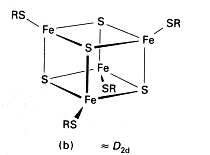
Związki koordynacyjne (przykłady)
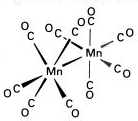
wielordzeniowe z ligandami jednopodstawnymi u
metaloorganiczne
klastery
2
Wyszukiwarka
Podobne podstrony:
1 Wprow klasy substancji chemicznychid 10031
Zagrożeniem chemicznym mogą być substancje chemiczne
INSTRUKCJA substancji chemicznej niebezpiecznej lub szkodliwej, instrukcje bhp
adr ZNAKI I SYMBOLE INFORMACYJNE SUBSTANCJI CHEMICZNYCH
Od?rdzo?wna ludzie wykorzystują substancje chemiczne w życiu codziennym
Immunologia - Wyklady, immuno sciaga, Antygen - substancja chemiczna wielkocząsteczkowa, posiada cec
Substancja chemiczna, Wypracowania do szkoły, Chemia
Analiza substancji chemicznej atmosferycznych aerozoli, Analiza substancji chemicznej atmosferycznyc
biologia, ZANIECZYSZCZENIA WODY2, Zanieczyszczenia wód, wprowadzone do wód naturalnych organizmy żyw
instrukcja bhp postepowania z odczynnikami i substancjami chemicznymi w laboratorium
instrukcja bhp przy pracy z substancja chemiczna estrogenem sterydowym
Zatrucia lekami i substancjami chemicznymi
Rodzaje oddziaływań pomiędzy substancjami chemicznymi
Szkol Substancje chemiczne zagrożenia
Nazwy związków i substancji chemicznych
Substancje chemiczne wyłączone spod przepisów rozporządzenia REACH, BEZPIECZEŃSTWO I HIGIENA PRACY,
więcej podobnych podstron