Zakład Fizyki, Akademia Rolnicza
Do u ytku wewn trznego
WICZENIE 14
WYZNACZANIE CIEPŁA TOPNIENIA LODU
Kraków, 06.02.2007 r.
SPIS TRE CI
I. CZ
TEORETYCZNA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2
1. UKŁADY JEDNO I WIELOFAZOWE.............................................................................................................................. 2
2. CIEPŁO PRZEMIANY FAZOWEJ (CIEPŁO UTAJONE) .................................................................................................. 2
3. PRZEMIANY FAZOWE I-EGO I II-EGO RODZAJU ....................................................................................................... 3
4. ZMIANY STANU SKUPIENIA........................................................................................................................................ 3
5. TOPNIENIE CIAŁ ........................................................................................................................................................ 5
6. CIEPŁO TOPNIENIA.................................................................................................................................................... 6
7. TEMPERATURA TOPNIENIA ....................................................................................................................................... 7
8. ZASADA BILANSU CIEPLNEGO ................................................................................................................................... 8
9. ZASADA POMIARU CIEPŁA TOPNIENIA ..................................................................................................................... 9
II. CEL WICZENIA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10
III. WYKONANIE WICZENIA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10
IV. OPRACOWANIE WYNIKÓW. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11
V. LITERATURA UZUPEŁNIAJ CA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11
VI. INDEKSY. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12
ZAKRES WYMAGANYCH WIADOMOCI
Poj cia: ciepło wła ciwe, ciepło wła ciwe ciał stałych, cieczy i gazów, ciepło topnienia, ciepło
parowania, temperatura, energia wewn trzna. Zmiany stanu skupienia. Warunki stosowalno ci
bilansu cieplnego. Obowi zuje umiej tno uło enia bilansu cieplnego stosowanego w tym
wiczeniu. Tak e wpływ ró nych czynników na temperatur topnienia ciał. Przemiany fazowe I i
II rodzaju. Nale y ponadto umie zestawi bilans cieplny dla stosowanego układu
do wiadczalnego.
2
I. CZ
TEORETYCZNA
Ogrzewanie ciał prowadzi zwykle do wzrostu ich temperatury lecz mo e tak e prowadzi
do ich wewn trznych przemian. By przemiany te sklasyfikowa i opisa wprowadzimy kilka
definicji.
1. Układy jedno i wielofazowe
Faz nazywamy makroskopow cz
układu maj c wsz dzie jednakowe własno ci
fizyczne, oddzielon od pozostałych cz ci tego układu powierzchni rozdziału nazywan granic
faz. Rozró nia si układy jedno i wielofazowe.
Układ jednofazowy jest to układ zło ony tylko z jednej fazy (stałej, ciekłej lub gazowej)
substancji. Lód jest przykładem układu jednofazowego i jedno- składnikowego.
Układ wielofazowy jest układem zło onym z wi cej ni jednej fazy. Przykładem układu
wielofazowego mo e by układ zło ony z wody i pary wodnej zawieraj cy tylko jeden składnik
tzn. wod . Przykładem układu wielofazowego i wielo- składnikowego mo e by naczynie z
wod , do której dolali my rt ci. Poniewa rt nie miesza si z wod , wi c w tym przypadku
mamy dwie fazy ciekłe (wod i rt ) oraz jedn gazow (para wodna, pary rt ci i powietrze), oraz
dwa składniki którymi s woda i rt .
Z do wiadczenia wynika, e współistnienie faz mo liwe jest w ci le okre lonych
warunkach. Warunkiem równowagi jest np. równo temperatur wszystkich faz. Je li warunki
równowagi nie s spełnione nast puje przekształcanie si jednych faz w inne.
2. Ciepło przemiany fazowej (ciepło utajone)
Rozpatrzmy nast puj cy przykład. Gdy lód o temperaturze 0oC i masie jednego kilograma
topi si i zamienia całkowicie w wod , to pochłaniane jest przy tym ciepło równe około 3.3·105J.
Gdy woda zamarza wtedy taka sama ilo ciepła wydziela si do otoczenia. Ciepło to zostaje
zu yte tylko na zamian lodu w wod (lub na odwrót), gdy podczas tego procesu temperatura
lodu pozostaje równa 0oC, a powstaj ca z niego woda utrzymuje tak e stał temperatur równ
0oC.
Wiele innych procesów np. wrzenie przebiega podobnie i tak e towarzyszy im
wydzielanie lub pochłanianie pewnej ilo ci ciepła. Ta ilo ciepła podzielona przez mas
substancji nazywa si ciepłem przemiany (Qprz, [J/kg]). Ciepło przemiany nazywane jest tak e
ciepłem utajonym.
3
3. Przemiany fazowe I-ego i II-ego rodzaju
Przemiany fazowe I-ego rodzaju s to zmiany fazy układu, podczas których g sto (ρ)
oraz takie funkcje termodynamiczne jak: energia wewn trzna (U), energia swobodna (F), entalpia
(H) oraz entropia (S) doznaj skokowej zmiany. Przy przej ciach fazowych I-ego rodzaju ciepło
przemiany jest ró ne od zera (Qprz≠O). Przej ciami fazowymi I-ego rodzaju s m.inn: topnienie,
krzepni cie i parowanie. Poza zmianami stanu skupienia do przej fazowych I-ego rodzaju
nale równie niektóre zmiany struktury krystalicznej w ciałach stałych.
Inny rodzaj przemian to przemiany fazowe II-ego rodzaju. Przemiany fazowe II-ego
rodzaju s to takie przemiany, w których ciepło przemiany równe jest zero (Qprz=O) i zachodz
one bez zmiany g sto ci. W przemianach tych zmieniaj si natomiast skokowo: ciepło wła ciwe,
izotermiczny współczynnik ci liwo ci i współczynnik rozszerzalno ci obj to ciowej.
Do przej fazowych drugiego rodzaju nale np. przej cia ferromagnetyk- paramagnetyk.
Przykładem mo e tu by elazo, które w temperaturze poni ej tzw. punktu Curie (768oC) jest
ferromagnetykiem i ma sie krystaliczn typu α.
W temperaturze 768oC g sto elaza nie ulega zmianie, natomiast współczynnik
rozszerzalno ci cieplnej zmienia si skokowo i w temperaturach wy szych staje si ujemny
(długo maleje przy ogrzewaniu). Okazuje si , e w tej przemianie elaza, zmienia si typ sieci
krystalicznej z α na β. elazo β jest paramagnetykiem.
4. Zmiany stanu skupienia
Najlepiej znanymi z ycia codziennego przej ciami fazowymi I-ego rodzaju s zmiany
stanu skupienia ciał. W przyrodzie wyró nia si trzy stany skupienia ciał: stały, ciekły i gazowy.
Gdy ciało stałe przechodzi w ciecz (np. lód w wod ) mamy do czynienia z topnieniem; przej cie
odwrotne, od stanu ciekłego do stałego nazywamy krzepni ciem. Przej cie od stanu ciekłego do
gazowego jest parowaniem, a przej cie odwrotne-skraplaniem (kondensacj ). Proces przej cia
ciała stałego bezpo rednio w gaz nazywamy sublimacj , a przej cie odwrotne-resublimacj .
Niekiedy mo emy zaobserwowa , e dwie a czasem wszystkie trzy fazy: stała ciekła i
lotna mog współistnie ze sob . Np. po wrzuceniu kostki lodu do wody zauwa a si , e przez
pewien czas obie fazy wyst puj jednocze nie. Mo liwy jest tak e przypadek, w którym
całkowite stopnienie lodu w wodzie nie zajdzie i stan taki nazywamy równowag fazow . W
opisie mikroskopowym równowag fazow opisuje si jako proces, w którym tyle samo
cz steczek przechodzi z fazy ciekłej do stałej ile odwrotnie.
4
Temperatura okre laj ca stan równowagi fazowej nazywa si temperatur przemiany
fazowej. Warto temperatury przemiany fazowej zale y od ci nienia. Np. dla wody z lodem,
równowaga faz wyst puje w temperaturze 0oC jedynie przy ci nieniu zwanym normalnym
(p=101325 Pa), a przy innych ci nieniach warto temperatury jest inna. Dla ró nych ciał
zale no pomi dzy temperatur przemiany fazowej pierwszego rodzaju i ci nieniem
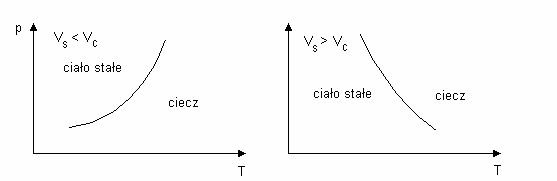
reprezentowana jest na wykresie p(T) przez pewne krzywe (rys.1).
Rys. 1. Krzywe równowagi dwufazowego układu ciało stałe-ciecz. Vs oznacza obj to ciała w
stanie stałym, a Vc jest obj to ci w stanie ciekłym.
Ka dy punkt tych krzywych przedstawia stan równowagi dwóch współistniej cych faz
(stałej i ciekłej). Dla warto ci parametrów p i T po lewej stronie krzywej mo e istnie ciało stałe,
a po prawej - ciecz. Przy czym jak wida na rys.1a, w przypadku ciał które podczas topnienia
zwi kszaj swoj obj to (Vs<Vc), temperatura przemiany fazowej ro nie wraz ze wzrostem
ci nienia. Natomiast je eli Vs>Vc (rys.1b) to zale no temperatury przemiany fazowej od
ci nienia jest malej ca. Na ogół mamy jednak do czynienia z t pierwsz sytuacj .
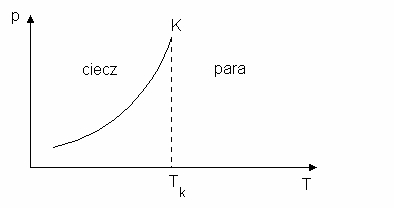
Analogicznie jak dla układu ciało stałe-ciecz mo na sporz dzi wykres układu
dwufazowego ciecz-para. Warto ci temperatury i ci nienia przy których istnieje równowaga
pomi dzy ciecz i par ko czy si w punkcie krytycznym K (patrz rys.2). Stan równowagi
pomi dzy ciecz i par mo na wyja ni nast puj co. Je eli rozpatrzymy naczynie wypełnione
cz ciowo wod i par wodn , to woda zawarta w tym naczyniu paruje i zwi ksza si masa pary,
a tym samym wzrasta jej g sto i ci nienie. Gdy para osi gnie najwi ksz g sto i ci nienie w
danej temperaturze co oznacza, e taka sama ilo cz steczek wyparuje jaka ulegnie skropleniu to
nazywamy t par nasycon .
Zło enie wykresów z rys. 1 i 2 powoduje przeci cie si krzywych w pewnym punkcie,
który oznaczamy przez M i nazywamy go punktem potrójnym. Dla warto ci parametrów
odpowiadaj cych temu punktowi, istnieje równowaga pomi dzy wszystkimi trzema fazami: stał ,
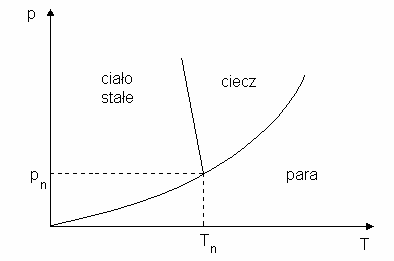
5
ciekł i gazow (fazy te współistniej ze sob ). Parametry punktu potrójnego s ci le okre lone i
na przykład dla lodu, wody i pary (pn =611 Pa, Tn=273,16 K).
Rys. 2. Krzywa równowagi układu dwufazowego ciecz-para.
Rys. 3. Krzywe równowagi układu trójfazowego (np. lodu, wody i pary)
Jak wida na rys.3 w temperaturze mniejszej od Tn i przy ci nieniu mniejszym od pn lód
jest w równowadze nie z ciecz ale z par nasycon . Zjawisko bezpo redniego przechodzenia
lodu w par nazywamy sublimacj , a odwrotne -resublimacj .
5. Topnienie ciał
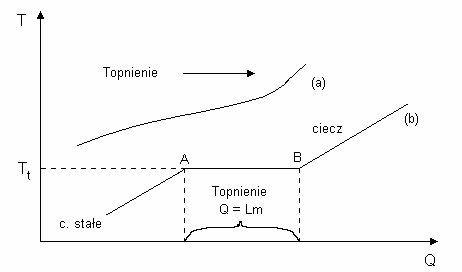
Przej cie substancji ze stanu stałego w stan ciekły nazywamy topnieniem. Jest to
przemiana fazowa I-ego rodzaju przy czym, jak wykazuje do wiadczenie, krzywe ogrzewania ciał
bezpostaciowych (amorficznych) i krystalicznych s ró ne.
Je eli ogrzewamy ciało bezpostaciowe (np. wosk) dostarczaj c mu energii Q, to jego
temperatura T ro nie w sposób nieprzerwany (rys.4a). Jak ilustruje rys.4a, proces topnienia ciał
bezpostaciowych nie zachodzi w stałej temperaturze lecz w pewnym przedziale temperatur. Dla
danej substancji bezpostaciowej nie mo na poda ci le okre lonej temperatury topnienia i, jak
zobaczymy poni ej, nie jest tak e mo liwe okre lenie ciepła topnienia. Zmiana stanu skupienia
takich substancji zachodzi stopniowo, substancja mi knie i trudno okre li , kiedy mamy ciało
6
stałe a kiedy ju tylko ciecz. Ciała krystaliczne (np. lód) zachowuj si odmiennie. Przy
równomiernym dostarczaniu energii, obserwujemy ustalenie si pewnej ci le okre lonej
temperatury Tt, w której zachodzi zjawisko topnienia (rys.4b).
Rys. 4 . Krzywe ogrzewania ciał bezpostaciowych (a) i krystalicznych (b)
Temperatura ta nie ulega zmianie dopóki nie stopi si całe ciało krystaliczne. Poziomy
odcinek AB wykresu (4b), odpowiada przej ciu ciała stałego w ciecz i charakteryzuje on
współistnienie dwóch faz: stałej i ciekłej. Odcinkowi AB odpowiada pewna ilo ciepła, któr
nale y doprowadzi do ciała stałego, przy stałej temperaturze Tt, dla całkowitego stopienia go. Ta
ilo ciepła Q potrzebna do zamiany ciała stałego w ciecz o tej samej temperaturze jest
proporcjonalna do masy tego ciała m: Q = L·m. Współczynnik proporcjonalno ci L nazywany jest
ciepłem topnienia.
6. Ciepło topnienia
Ciepło topnienia (L) okre lone jest nast puj cym wzorem:
Q
L = m 1
gdzie: Q oznacza ilo ciepła potrzebn do zamiany ciała stałego w ciecz o tej samej
temperaturze, m jest mas ciała.
Liczbowo ciepło topnienia [L] jest równe ilo ci energii potrzebnej do stopienia jednostki
masy substancji bez zmiany temperatury. Jednostk ciepła topnienia jest w układzie SI [J/kg].
Ciepło topnienia jest wielko ci charakteryzuj c rodzaj ciała czyli jest ono stał
materiałow (nie zale y od masy ciała lecz od substancji, z której ciało jest wykonane).
Wyznaczone do wiadczalnie warto ci ciepła topnienia niektórych substancji zamieszczono w
Tabeli 1.
7
Tabela 1. Ciepło topnienia i temperatura topnienia niektórych substancji. [Je ewski M., Kalisz J., Tablice wielko ci fizycznych oraz pomocnicze tablice matematyczne, PWN, W-wa
1957,s.96;s.109].
Substancja
Ciepło topnienia [J/kg]
Temperatura topnienia [oC]
rt (Hg)
13 000
-39
ołów (Pb)
25 000
327
srebro (Ag)
105 000
960
mied (Cu)
205 000
1O84
lód (H2O)
333 630
0
aluminium (Al)
400 000
660
7.Temperatura topnienia
Jak wida na rys.4b proces przej cia ciała stałego krystalicznego, w ciecz zachodzi w
stałej temperaturze. T stał temperatur nazywamy temperatur topnienia (Tt).
Warto temperatury topnienia zale y od ci nienia, przy którym nast puje przemiana ciała
stałego w ciecz (rys. 1). Przedstawion na rys. 1, do wiadczalnie stwierdzon zale no
temperatury topnienia od ci nienia opisuje równanie Clapeyrona-Clausiusa mo liwe do
wyprowadzenia na gruncie termodynamiki:
∆T
(
)
t
Tt VC VS
=
−
∆p
L
2
gdzie: ∆Tt jest to zmiana temperatury topnienia, ∆p oznacza zmian ci nienia, Vc i Vs s to
obj to ci wła ciwe cieczy i ciała stałego tj. obj to ci jednostki masy: V=1/ρ
(ρ - g sto substancji), L - ciepło topnienia. Równanie Clapeyrona-Clausiusa pozostaje
prawdziwe tak e dla innych przej fazowych I rodzaju.
Poni ej w oparciu o równanie Clapeyrona-Clausiusa przedyskutujemy kiedy wzrost
ci nienia powoduje wzrost, a kiedy zmniejszenie temperatury topnienia. Zazwyczaj podczas
topnienia zwi ksza si obj to wła ciwa substancji (Vc>Vs). Poniewa ciepło topnienia L jest
zawsze wi ksze od zera (L>O) to z równania (2) wynika, e
∆Tt/∆p>O.
Oznacza to, e zgodnie z rys. 1a w przypadku ciał które podczas topnienia zwi kszaj swoj
obj to , wzrost ci nienia powoduje zwi kszenie temperatury topnienia.
W przypadku niektórych substancji, takich jak: woda, gal i bizmut, obj to fazy ciekłej
jest mniejsza ni stałej (Vc<Vs). Np. lód podczas topnienia zmniejsza swoj obj to o 9%. Dla
tego typu substancji równanie (2) prowadzi do wniosku i temperatura topnienia maleje wi c
8
wraz ze wzrostem ci nienia. Rzeczywi cie mo na stwierdzi do wiadczalnie, e pod ci nieniem
wi kszym od atmosferycznego lód topi si w temperaturze ni szej ni 0oC. Obni enie to wynosi
około 0.007 stopnia przy wzro cie ci nienia o jedn atmosfer (tj. o około 105 N/m2). Przy
ci nieniu 2200 razy wi kszym temperatura topnienia spada do -22oC. Warto ci te s w dobrej
zgodno ci z warto ciami wynikaj cymi ze wzoru (2). Dalszy wzrost ci nienia prowadzi jednak do
wzrostu warto ci temperatury topnienia lodu.
Du y wpływ na temperatur krzepni cia ma równie obecno nawet niewielkiej ilo ci
substancji rozpuszczonej w cieczy. Wyniki do wiadczenia wskazuj , e roztwory krzepn w
ni szych temperaturach ni czysty rozpuszczalnik, przy czym obni enie temperatury krzepni cia
jest w przybli eniu proporcjonalne do st enia roztworu. Krzepni cie przebiega w ten sposób, e
pocz tkowo krzepnie czysty rozpuszczalnik, wskutek czego st enie pozostałego roztworu
wzrasta, a temperatura ci gle obni a si a do chwili gdy roztwór staje si nasycony. Dalsze
krzepni cie zachodzi ju w stałej temperaturze zwanej eutektyczn , przy czym z roztworu
wydziela si jednocze nie rozpuszczalnik i substancja rozpuszczona.
8.Zasada bilansu cieplnego
Ró ne ciała stykaj c si ze sob mog wymienia energi . Jednym z podstawowych i
powszechnych sposobów wymiany energii mi dzy ciałami jest wymiana na sposób ciepła.
Warunkiem koniecznym takiej wymiany jest istnienie ró nicy temperatur i wówczas ciepło
przepływa od ciał o wy szej temperaturze do ciał o ni szej temperaturze. Niekiedy wymiana
ciepła jest jedyn przyczyn zwi kszania lub pomniejszania energii wewn trznej ciała. Taka
sytuacja ma miejsce w przypadku układu ciał umieszczonych w kalorymetrze, czyli w
urz dzeniu, które uniemo liwia wymian ciepła z otoczeniem realizuj c ide izolacji ciał od
otoczenia. W takich warunkach energia wewn trzna całego układu jest stała mimo, e zachodzi
wymiana ciepła pomi dzy tworz cymi go ciałami i energie wewn trzne tych ciał ulegaj zmianie.
Układ taki d y do stanu równowagi termodynamicznej, w którym to stanie temperatura
wszystkich elementów jest jednakowa. Pierwsza zasada termodynamiki pozwala stwierdzi , e
wówczas suma ilo ci ciepła pobranego (Qp) przez jedne ciała układu izolowanego równa jest
sumie ilo ci ciepła oddanego przez Q0 inne ciała tego układu, tak e zmiana energii wewn trznej
całego układu była zerowa. Stwierdzenie to nazywane jest zasad bilansu cieplnego i zapisywane
w formie równania:
Q1 + Q2 + . . = Q'1 + Q'2 + . .
czyli
9
Qp = Q0
gdzie: poszczególne Q oznaczaj ilo ci ciepła pobrane przez poszczególne ciała w układzie a Q'
oznaczaj ciepła oddane przez inne ciała tego układu.
9. Zasada pomiaru ciepła topnienia
W czasie pomiaru kawałek lodu o masie m i temperaturze 0oC wrzucamy do wody
znajduj cej si w kalorymetrze. Lód topi c si pobiera ciepło Q1:
Q1 = mL
gdzie L jest to ciepło topnienia lodu. Woda powstała z lodu ogrzewa si pobieraj c ciepło Q2 i jej
temperatura wzrasta od T0=0oC do temperatury ko cowej Tk. Ciepło Q2 jest równe
Q2 = cwm(Tk - T0)
gdzie: m - masa wody powstałej z lodu równa masie lodu, cw - ciepło wła ciwe wody. Całkowita
ilo ciepła Qp pobranego przez lód i powstał z niego wod jest równa:
Qp = Q1 + Q2 = mL + cwm(Tk - T0)
Metod okre lenia ciepła Qp jest zastosowanie zasady bilansu cieplnego. Zasad t mo na
stosowa do układów izolowanych, w naszym wiczeniu ide izolacji układu od otoczenia
realizuje kalorymetr. Zgodnie z zasad bilansu cieplnego ciepło pobrane przez lód i powstał z
niego wod jest równe ciepłu oddanemu (Qo) przez ciała, które pozostaj z nim w kontakcie
cieplnym:
Qp = Q0
Ciepło Qo oddaje kalorymetr i uprzednio nalana do niego woda o masie mw. Ciepło to mo na
obliczy o ile dokonamy pomiarów warto ci temperatur oraz mas kalorymetru i wody:
Q0 = ckmk(Tp - Tk) + cwmw(Tp - Tk)
gdzie: ck - ciepło wła ciwe kalorymetru, mk - masa naczynia kalorymetrycznego wraz z
mieszadłem, Tp - temperatura pocz tkowa wody w kalorymetrze i naczynia kalorymetrycznego,
Tk - ich temperatura ko cowa, mw - masa wody w kalorymetrze (przed wrzuceniem i stopieniem
si lodu). Posługuj c si zasad bilansu cieplnego otrzymujemy nast puj cy zwi zek pomi dzy
wielko ciami mierzonymi, a wyznaczanym ciepłem topnienia lodu:
m
( c +
)( − )
w w
mkck Tp T
L
k
=
− c ( − 0)
w Tk
T
m
3
Przy układaniu bilansu cieplnego zakładali my, e kalorymetr jest idealnie izolowany od
otoczenia. W rzeczywisto ci podczas całego procesu topnienia lodu nast puje stały dopływ ciepła
10
do układu. Ten dopływ ciepła mo na uwzgl dni w bilansie odejmuj c od wyznaczonej
do wiadczalnie temperatury ko cowej odpowiedni poprawk ε i dopiero t temperatur
uto samiaj c z Tk. Metody wyznaczania warto ci poprawki ε mo na znale w broszurze
"Opracowanie i prezentacja wyników pomiarów" w przykładzie 3.
II. CEL WICZENIA
Celem wiczenia jest wyznaczenie ciepła topnienia lodu.
III. WYKONANIE WICZENIA
1. Zwa y osuszone naczynie kalorymetryczne (bez osłony) i mieszadełko (masa mk) notuj c
dokładno pomiaru masy ∆m.
2. Nala do naczynia kalorymetrycznego wod destylowan do połowy jego wysoko ci.
Wyznaczy mas cało ci m1. Masa wody mw = m1 - mk.
3. Odczyta i zanotowa temperatur pocz tkow wody Tp.
4. Z zamra alnika lodówki wyj kawałek lodu i umie ci go w niewielkiej zlewce zawieraj cej
około 50ml wody destylowanej. Po upływie 1 do 2 minut mo na uzna , e temperatura lodu
osi gn ła 0oC.
5. Lód wyj , osuszy bibułk i wrzuci do kalorymetru. Zanotowa czas rozpocz cia pomiaru.
6. Wł czy mieszadło magnetyczne. W odst pach jednominutowych notowa wskazania
termometru.
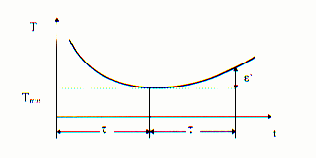
7. Nie przerywaj c pomiaru temperatury zapisa czas topnienia lodu t, tzn. czas po którym
temperatura kalorymetru osi gn ła warto minimaln (Tmin).
8. Po osi gni ciu minimum temperatura naczynia kalorymetrycznego wzrasta na skutek
niedoskonałej izolacji cieplnej. Nale y zmierzy i zanotowa przyrost temperatury ε′ po
upływie nast pnego odcinka czasu t (patrz rysunek poni ej).
9. Wył czy mieszadło magnetyczne.
11
10. Zwa y naczynie kalorymetryczne z wod (m2). Masa stopionego lodu:
m = m2-m1.
11. Je eli wyznaczona w do wiadczeniu ró nica temperatur Tp-Tmin jest mniejsza od 3÷5oC
nale y powtórzy czynno ci opisane w punktach od 2 do 10 u ywaj c odpowiednio
wi kszego kawałka lodu.
IV. OPRACOWANIE WYNIKÓW
1. Obliczy ciepło topnienia lodu L korzystaj c ze wzoru (1). Zgodnie z definicj wynik powinien by wyra ony w [J/kg]. Jako temperatur ko cow nale y przyj Tk=Tmin-ε′ oraz nast puj ce
warto ci ciepła wła ciwego: (woda) cw=4187 J/kg·K, (kalorymetr miedziany) ck=377 J/kg·K,
(kalorymetr aluminiowy) ck=892 J/kg·K.
2. Obliczy maksymaln warto bł du ∆L metod ró niczki zupełnej. Wskazówki dotycz ce
obliczania tego bł du mo na znale w broszurze "Opracowanie i prezentacja wyników
pomiarów", s.18 -20. Jako bł d ∆Tp przyj bł d odczytu termometru cyfrowego równy 0.1oC,
jako ∆Tk przyj 0.2oC. Obliczy bł d wzgl dny ∆L/L.
3. Uzyskane wyniki porówna z warto ciami tablicowymi. Zasady porównywania wyników z
warto ciami tablicowymi podano w broszurze "Opracowanie i prezentacja wyników
pomiarów".
V. LITERATURA UZUPEŁNIAJ CA
Bolton W., Zarys fizyki, Tom 2, PWN, Warszawa 1988, s. 360-381
Buszmanow B.N., Chronow J.A., Wst p do fizyki ciała stałego, Warszawa 1973, s.44
Chyla K., Fizyka dla ZSZ, Wydanie trzecie, WSziP, Warszawa 1991. s.122-123
Dry ski T. Do wiadczenia pokazowe z fizyki, PWN, Warszawa, 1964
Encyklopedia fizyki, Tom 3, PWN, Warszawa 1974, s.22; 453; 569
12
Halliday D., Resnick R., Fizyka Tom 1, PWN, Warszawa 1994, s.523
Herman M., Kalesty ski A., Widomski L., Podstawy fizyki dla kandydatów na wy sze uczelnie,
PWN, Warszawa 1984, s.468
Gabrylewski E., Fizyka dla klasy I liceum ogólnokształc cego, technikum i liceum zawodowego.
PZWS, Warszawa 1973, s.217
Jaworski B.M., Pi ski A.A., Elementy fizyki, PWN, Warszawa 1979, s.321-346, 362-368
Je ewski M., Fizyka, PWN, Warszawa 1957, s.203-205
Jenike M., Fizyka. Podr cznik dla liceów ogólnokształc cych, WSZiP, Warszawa 1993, s.252-
270
Kami ski Z. Fizyka dla kandydatów na wy sze uczelnie techniczne, WNT, Warszawa 1984,
s.262-263, 323-33O
Szczeniowski Sz. Fizyka do wiadczalna, Tom II, PWN, Warszawa 1976, s.347-351
Wróblewski A.K., Zakrzewski J.A., Fizyka, Tom 2, PWN, Warszawa 1984, s.543-545; 552
VI. INDEKSY
ciepło
przemiany fazowej (3)
topnienia
(9)
utajone
(3)
faza
(2)
granica faz
(2)
kalorymetr
(11)
krzywe ogrzewania
(7)
obj to wła ciwa
(10)
przemiany fazowe
II-ego rodzaju
(3)
punkt potrójny
(7)
równowaga fazowa
(5)
temperatura
eutektyczna
(11)
topnienia
(10)
topnienie ciał
(7)
układ
jednofazowy
(2)
wielofazowy
(2)
zmiany stanu skupienia
(4)
Wyszukiwarka
Podobne podstrony:
Przebiegi cwiczeń, cwicz1
Cwicz12 2
cwicz11pl
cwicz10
cwicz11 12
cwicz1
cwicz15pl
Cwicz11Kolokwium
Cwicz1, Skrypty, UR - materiały ze studiów, studia, studia, Bastek, Studia, Rok 4, Semestr VIII, Bud
cwicz1, Podstawy elektrotechniki, laborki
cwicz10
cwicz1
Cwicz10 3
BAL 2011 Cwicz1
Cwicz1, wisisz, wydzial informatyki, studia zaoczne inzynierskie, przetwarzanie obrazow, cwiczenia
cwicz11
rownania cwicz1
cwicz1 3
cwicz1 3
cwicz15
więcej podobnych podstron