Sprawozdanie I laboratorium Biochemia
Temat: Amfoteryczny charakter białek i aminokwasów
Data zajęć: 12.12.2013
Prowadząca: dr inż Beata Greb-Markiewicz
Wykonawcy: Aleksandra Grodek 193200, Michał Izydorczyk, Grupa IV
1.
Wstęp teoretyczny
Aminokwasy posiadają grupy aminowe zdolne do włączania protonu oraz grupy karboksylowe zdolne do oddysocjowania protonu. Dodatkowe łańcuchy boczne mogą ulegać rożniej jonizacji. W zależności od pH jednych form jonowych jest więcej, nich mniej. Punkt izoelektrycznych (pI) to pH dla ktorego aminokwas/białko posiada sumaryczny ładunek elektryczny rowny zero. Wowczas cząsteczka taka cząsteczka nie porusza się w polu elektrycznym. Precyzyjną metodą wyznaczenia pI jest izoelektroogniskowanie. Polega na przyłożeniu napięcia do płytki żelowej z naniesionym białkiem. Żel został tak przygotowany, że posiada liniowy gradient pH. Białko zatrzyma się, gdy będzie nienaładowane, czyli dokładnie w pI. Inna metodą jest wytrącanie osadow. Białko w pI posiada najmniejszą rozpuszczalność. Sporządza się serię roztworow o rożnych pH i rozpuszcza się w nich białko.
Punkt izoelektrycznych białka jest rowny pH roztworu, gdzie wytrącił się największy osad.
Jest to metoda szybsza i łatwiejsza do wykonania, jednak mniej dokłada.
2.
Cel ćwiczenia
- Wykonanie krzywych miareczkowania dwóch aminokwasów (Alaniny i Glutaminianu), określenie ich punktów izoelektrycznych, pK grup funkcyjnych i przedziałów buforowania;
- Wyznaczenie punktu izoelektrycznego kazeiny.
3.
Materiały
Odczynniki:
- 1M NaOH;
- 1M HCl;
- wodne roztwory aminokwasów: 0,1 M alanina, 0,05M kwas glutaminowy;
- 1M kwas octowy;
- 0,1 M CH3COONa zawierający kazeinę w końcowym stężeniu 0,2%;
- bufory wzorcowe do kalibracji pehametru o pH 4,01; 7,01; 9,18.
Szkło i aparatura:
- probówki chemiczne na 20 ml i na 5 ml;
- pipety automatyczne oraz tipsy;
- pipety szklane;
- cylinder miarowy;
- zlewki o pojemności 50 ml;
- mieszadło magnetyczne;
- mieszadełka magnetyczne małe i duże;
- pehametr laboratoryjny z elektrodą.
4. Przebieg ćwiczenia
a)Wyznaczenie punktu izoelektrycznego kazeiny:
- Przygotowano 18 suchych probówek chemicznych (duże i małe). W 9 kolejno ponumerowanych dużych probówkach przygotowano serię rozcieńczeń wg schematu: próbka nr 1: 13,6 ml H2Odest + 6,4 ml 1M CH3COOH
próbka nr 2: 5,0 ml H2Odest + 5,0 ml próbki nr 1 po dokładnym wymieszaniu próbka nr 3: 5,0 ml H2Odest + 5,0 ml próbki nr 2 po dokładnym wymieszaniu (…)
próbka nr 9: 5,0 ml H2Odest + 5,0 ml próbki nr 8 po dokładnym wymieszaniu; W próbce nr 1 i 9 wyrównano objętość do 5 ml;
- Do 9 kolejno ponumerowanych małych probówek odmierzono po około połowie pojemności probówki przygotowanych rozcieńczeń kwasu octowego;
- Zmierzono pH każdego z roztworów, umieszczając elektrodę bezpośrednio w małych probówkach, a odczytane wartości zanotowano w Tabeli 1;
- Przelano roztwory z małych probówek do dużych;
- Do każdej z dużych probówek od 1 do 9 dodano po 1 ml 0,2% roztworu kazeiny i włączono stoper;
- Delikatnie wymieszano mieszaniny, nie dopuszczając do ich spienienia;
- Zbadano wygląd prób białka zaraz po zamieszaniu i zanotowano obserwacje;
- Odstawiono próby kazeiny na 90 minut (inkubowano w temp. pokojowej);
- Po upływie 90 minut wygląd prób ponownie zbadano, a wyniki zanotowano w Tabeli 2.
b) Miareczkowanie roztworów aminokwasów - roztworu kwasu glutaminowego i roztworu alaniny:
- Do czystej zlewki o pojemności 50 ml odmierzono 40 ml roztworu kwasu glutaminowego;
- Postawiono zlewkę na mieszadle magnetycznym, umieszczono w roztworze czyste małe mieszadło magnetyczne, uruchomiono mieszanie, a następnie zanurzono w roztworze aminokwasu elektrodę opłukaną wodą destylowaną;
- Posługując się pipetą automatyczną, ostrożnie dodawano kroplami 1M HCl, pamiętając , że początkowo niewielki dodatek kwasu może spowodować zmiany pH większe niż 0,5
jednostki i niewielkich zmianach pH w zakresie buforowania ( w tych zakresach dodawano większe ilości kwasu);
- Zmiany pH roztworu zapisywano;
- Zakończono dodawanie kwasu solnego po osiągnięciu pH poniżej 2.0;
- Postępowanie powtórzono dla roztworu alaniny;
- Analogicznie przeprowadzono miareczkowania obu roztworów aminokwasów za pomocą 1M NaOH. Miareczkowania zakończono po osiągnięciu przez roztwory pH = 13.
5. Wyznaczanie punktu izoelektrycznego kazeiny
Lp
1
2
3
4
5
6
7
8
9
pH
2,69
2,89
3,12
3,37
3,59
3,77
3,94
4,16
4,40
zmętnienie -
-
-
++
++
+++
+
-
-
osad
-
-
-
-
-
-
-
-
-
Po upływie 45 minut:
Lp
1
2
3
4
5
6
7
8
9
pH
2,69
2,89
3,12
3,37
3,59
3,77
3,94
4,16
4,40
zmętnienie -
-
-
+
++
++
-
-
-
osad
-
-
-
-
-
-
-
-
-
Legenda: w wierszach „osad” i „zmętnienie” użyte symbole oznaczają odpowiednio:
- brak; + mało/słabe; ++ dużo/silne; +++ bardzo dużo/bardzo silne.
Obserwacje:
W probówkach 4,5,6,7 zaobserwowano zmętnienie (największe w probówce numer 6). Nie zaobserwowano wytrącenia się osadu w rzadnej z probówek. Po upływie 45 minut zmniejszyło się zmętnienie w probówce numer 6 i 7.
Wnioski:
Na podstawie danych z powyższych tabelek można stwierdzić, iż punkt izoelektryczny kazeiny znajduje się w przedziale pH dla 3,59-3,77, gdyż wystąpiło tam największe zmętnienie roztworów.
Wyznaczony doświadczalne punkt izoelektryczny jest niestety znacząco różny od wartości literaturowej, która wynosi 4,6. Na rozbieżność wyników mogły mieć wpływ np. niedokładności przygotowania probówek lub działanie bakterii w roztworze kazeiny.
6.
Wykonanie krzywych miareczkowania dla dwóch aminokwasów: alaniny i glutaminianu
Tabela 1. Miareczkowanie kwasu glutaminowego za pomocą HCl
Lp
pH
Vtitranta [ml]
Ntitranta/Na
0
3,57
0
0
1
3,53
0,01
0,05
2
3,50
0,03
0,015
3
3,45
0,06
0,03
4
3,38
0,11
0,04
5
3,26
0,21
0,105
6
3,04
0,41
0,205
7
2,86
0,61
0,305
8
2,72
0,81
0,405
9
2,50
1,21
0,605
10
2,32
1,61
0,805
11
2,17
2,01
1,005
12
2,10
2,21
1,105
13
2,04
2,41
1,205
14
1,99
2,61
0,71
Tabela 2. Miareczkowanie kwasu glutaminowego za pomocą NaOH
Lp
pH
Vtitranta [ml]
Ntitranta/Na
0
3,53
0
0
1
3,54
0,01
0,005
2
3,55
0,02
0,01
3
3,57
0,04
0,02
4
3,61
0,06
0,03
5
3,62
0,08
0,04
3,64
0,1
0,05
7
3,67
0,12
0,06
8
3,71
0,16
0,08
9
3,76
0,2
0,1
10
3,80
0,24
0,12
11
3,84
0,28
0,14
12
3,89
0,32
0,16
13
3,93
0,36
0,18
14
3,96
0,4
0,2
15
4,00
0,44
0,22
16
4,04
0,48
0,24
17
4,08
0,52
0,26
18
4,12
0,57
0,285
19
4,16
0,62
0,31
20
4,20
0,67
0,335
21
4,24
0,72
0,36
22
4,28
0,77
0,385
23
4,32
0,82
0,41
24
4,36
0,87
0,435
25
4,41
0,93
0,465
26
4,45
0,99
0,495
27
4,50
1,05
0,525
28
4,56
1,11
0,555
29
4,62
1,19
0,595
30
4,69
1,27
0,635
31
4,74
1,35
0,675
32
4,85
1,43
0,715
33
4,92
1,51
0,755
34
5,02
1,59
0,795
35
5,11
1,65
0,825
36
5,20
1,71
0,855
37
5,32
1,77
0,885
38
5,42
1,82
0,91
39
5,63
1,87
0,935
40
5,98
1,92
0,96
41
6,42
1,96
0,98
42
7,83
2
1
43
7,90
2,005
1,0025
44
8,04
2,015
1,0075
45
8,15
2,025
1,0125
46
8,22
2,035
1,0175
47
8,28
2,045
1,0225
48
8,38
2,065
1,0325
49
8,47
2,085
1,0425
50
8,57
3,005
1,5025
51
8,68
3,045
1,5225
52
8,78
3,085
1,5425
53
8,88
3,135
1,5675
54
8,97
3,185
1,5925
55
9,08
3,255
1,6275
56
9,27
3,355
1,6775
57
9,38
3,455
1,7275
58
9,51
3,605
1,8025
59
9,64
3,805
1,9025
60
9,83
4,005
2,0025
61
10,19
4,405
2,2025
62
10,97
4,805
2,4025
63
11,72
5,305
2,6525
64
11,93
5,805
2,9025
65
12,02
6,305
3,1525
Wykres 1- Kwas glutaminowy
Tabela 3- Miareczkowanie alaniny za pomocą HCl
pH
Vtitranta [ml]
Ntitranta/Na
0
6,57
0
0
1
6,18
0,01
0,0025
2
5,34
0,01
0,0025
3
5,03
0,02
0,005
4
4,7
0,03
0,0075
5
4,55
0,04
0,01
6
4,42
0,05
0,0125
7
4,33
0,06
0,015
8
4,2
0,08
0,02
9
4,1
0,1
0,025
10
3,92
0,15
0,0375
11
3,79
0,2
0,05
12
3,69
0,25
0,0625
13
3,54
0,35
0,0875
14
3,42
0,45
0,1125
15
3,1
0,85
0,2125
16
2,89
1,25
0,3125
17
2,72
1,65
0,4125
18
2,58
2,05
0,5125
19
2,39
2,65
0,6625
20
2,22
3,25
0,8125
21
2,07
3,85
0,9625
22
1,92
4,45
1,1125
Tabela 4- Miareczkowanie alaniny za pomocą NaOH
Lp
pH
Vtitranta [ml]
Ntitranta/Na
0
6,58
0
0
1
7,29
0,01
0,0025
2
7,51
0,02
0,005
3
7,67
0,02
0,005
4
7,78
0,03
0,0075
5
7,85
0,03
0,0075
6
7,95
0,04
0,01
7
8,04
0,05
0,0125
8
8,17
0,06
0,015
9
8,28
0,08
0,02
10
8,4
0,11
0,0275
11
8,54
0,16
0,04
12
8,66
0,21
0,0525
13
8,79
0,31
0,0775
14
8,91
0,41
0,1025
15
9,19
0,71
0,1775
16
9,41
1,01
0,2525
17
9,58
1,31
0,3275
18
9,81
1,81
0,4525
19
10,03
2,31
0,5775
20
10,28
2,81
0,7025
21
10,93
3,61
0,9025
22
11,84
4,41
1,1025
23
12,05
5,01
1,2525
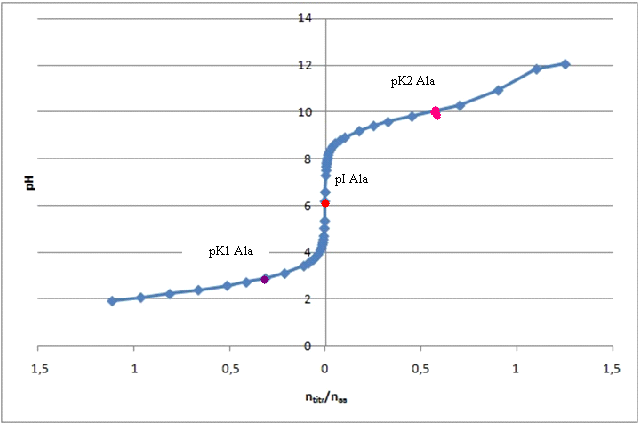
Wykres 2- Alanina
Tabela 5- Porównanie odczytanych wartości z wartościami literaturowymi Aminokwas
Wartość odczytana
Wartość literaturowa
Alanina
pI
6,0
6,0
pK1
2,6
2,4
pK2
10,0
9,8
Kwas
pI
3,5
3,22
glutaminowy
pK1
2,0
2,2
pK2
10,0
9,7
pK3
4,0
4,3
7.
Przykładowe obliczenia
Vaa/titranta =Vtitranta – VH2O/titranta
Vtitranta- objętość titranta dodanego do roztworu aminokwasu
VH2O/titranta- objętość titranta zużyta na zmiareczkowanie wody Vaa/titranta - objętość titranta zużyta na zmiareczkowanie aminokwasu Przykładowe wyliczenie :
Vaa/titranta =Vtitranta – VH2O/titranta
Vaa/titranta =0,11-0,03=0,08 [ml]
Na wykresach miareczkowania aminokwasów przedstawiona jest zależność pH od stosunku liczności titranta przeznaczonej na zmiareczkowanie aminokwasu do liczności tego aminokwasu.
Przykładowo:
ntitranta/naa = (Vaa/titranta * Ctitranta)/(Vaa*Caa)=(0,00008*1)/(0,04*0,05)=0,02
Wartości pK poszczególnych grup zostały odczytane z wykresu [i zestawione w tabeli 4.], natomiast wartości pI zostały wyliczone za pomocą wzorów:
pI alaniny= (pK1+ pK2)/2 = (2,6 + 10,0)/2 = 6,3
pI kwasu glutaminowego = (pK1 + pK3)/2 = (2,0 + 4,0)/2 = 3,0
Wnioski:
Na podstawie uzyskanych wyników możemy stwierdzić, że cel ćwiczenia został osiągnięty.
Otrzymane wartości pK dla alaniny i kwasu glutaminowego są zbliżone do wartości teoretycznych.
Wyniki potwierdziły właściwości amfoteryczne i buforujące aminokwasów.
Wyszukiwarka
Podobne podstrony:
Sprawozdanie F laboratorium Biochemia
Sprawozdanie C laboratorium Biochemia
Sprawozdanie G laboratorium Biochemia
Sprawozdanie A laboratorium Biochemia
Sprawozdanie F laboratorium Biochemia
SprawkoA B, biochemia laboratorium, Biochemia - sprawozdania inne
G, biochemia laboratorium, Biochemia - sprawozdania inne
Sprawozdanie nr 3 z zajęć laboratoryjnych z biochemii
Biochemia sprawozdanie O, biochemia laboratorium, Biochemia - sprawozdania inne
Biochemia Sprawozdanie A, biochemia laboratorium, Biochemia - sprawozdania inne
Biochemia Sprawozdanie K (topnienie DNA), biochemia laboratorium, Biochemia - sprawozdania inne
Sprawozdanie nr 2 z zajęć laboratoryjnych z biochemii
Sprawozdanie z laboratorium obróbki plastycznej, ZiIP, sem 1
06, Politechnika Lubelska, Studia, semestr 5, Sem V, Sprawozdania, sprawozdania, Sprawozdania, Labor
Sprawozdanie 000(po poprawie), AGH, i, Laborki, Laborki, Ćwiczenie 000
BIOCHEMIA poprawka
Biochemia poprawa zbiorczej I (1)
SPRAWOZDANIE Z LABORATORIUM ELEKTRONIKI
20'', Politechnika Lubelska, Studia, semestr 5, Sem V, Sprawozdania, sprawozdania, Sprawozdania, Lab
więcej podobnych podstron