Gaz doskonały - gaz, w którym nie istnieją siły przyciągania międzycząsteczkowego, a objętość cząsteczki Prawo Avogadra -przy jednakowej temperaturze i równa jest zeru.
ciśnieniu różne gazy doskonałe mają tę samą ilość cząsteczek w równych objętościach
PRAWA GAZÓW DOSKONAŁYCH
n = n
1
2
Określają zależności między parametrami czynnika termodynamicznego.
m
M
1
1
=
m
M
2
2
Prawo Boyle′a- Mariotte′a (przemiana izotermiczna) -
iloczyn ciśnień i objętości właściwej gazu przy stałej Mϑ = Φ = const
temperaturze jest wielkością stałą.
T = const (dla m = 1 kg gazu) Warunki normalne fizyczne
TN=273,15K
tN=0oC
p ϑ = p ϑ = const
1
1
2
2
pN=101325Pa
pN=760mmHg
p
ϑ
Φ
N=22,4136m3/kmol
1
2
=
p
ϑ
2
1
Przeliczanie jednostek ciśnienia
p V = p V = const (dla m kg gazu)
760Tr=101325Pa
1
1
2
2
1Tr=133,322Pa
1Tr=1mmHg
Prawo Gay - Lussaca (przemiana izobaryczna) - objętość 1atm=101325Pa (atmosfera fizyczna)
gazu ogrzewanego lub ochładzanego przy stałym ciśnieniu 1at=98066,5Pa≈105Pa (atmosfera techniczna)
zmienia się wprost proporcjonalnie do zmiany temperatury 1bar=105Pa=750Tr
bezwzględnej
1at=1kG/cm2
p = const
ϑ
ϑ
V
V
1
2
=
=
const
lub
1
2
=
= const
T
T
T
T
1
2
1
2
MIESZANIE GAZÓW PRZY STAŁYM CIŚNIENIU
Prawo Charlesa (przemiana izochoryczna) - ciśnienie p=const
gazu ogrzewanego lub chłodzonego przy stałej objętości zmienia się wprost proporcjonalnie do zmiany temperatury 1
bezwzględnej
ϑ = const
3
p
2
1 = p2 = const
T
T
1
2
Równanie stanu gazu (równanie Clapeyrona)
m ⋅ c ⋅ t + m ⋅ c
⋅ t = m ⋅ c ⋅ t
1
p1
1
2
p 2
2
3
p3
3
p V
p V
1
1
2
2
=
= mR = const
m + m = m
T
T
1
2
3
1
2
•
⋅
+
⋅
=
dla 1kg masy gazu
g
c
g
c
c
1
p1
2
p 2
p 3
pϑ = RT
cp - ciepło właściwe masowe przy stałym ciśnieniu,
• dla m kg masy gazu
J/(kg⋅K), kJ/(kg⋅K)
pV = mRT
υ
- objętość właściwa gazu, m3/kg
V - objętość gazu, m3
m - masa gazu, kg
R - stała gazowa, J/(kg⋅K)
• stała gazowa:
B
R =
M
B - uniwersalna stała gazowa, B=8314,3J/(kmol⋅K) M - masa molowa gazu, kg/kmol
• Inna postać równania:
pΦ = BT
Φ = M
ϑ
pV = nTB
Φ - objętość molowa gazu, m3/kmol
n - ilość kmol gazu
MIESZANINY GAZÓW
Ciepło właściwe może być odniesione do:
Prawo Daltona - w danej objętości V mieszaniny gazów o
• jednostki masy gazu
temperaturze T i ciśnieniu p każdy ze składników cp , cv , J/(kg⋅K), k J/(kg⋅K)
mieszaniny m1, m2, ...,mn zachowując się tak jakby nie było
• jednostki objętości
innego gazu w tej objętości, czyli zajmuje całą objętość V, Cp , Cv , J/(um3⋅K) k J/( um3⋅K)
przyjmuje temperaturę T i ciśnienie picz.
• jednostki masy molowej
p = p
. . .
M
M
1 + p
2 +
+p
cz
cz
czk
Cp , Cv , J/(kmol⋅K), kJ/(kmol⋅K)
m = m
. . .
Zależność pomiędzy cp i cv (równanie Mayera): 1 + m 2 +
+mk
c − c = R
Skład mieszaniny gazów określają udziały masowe lub p
v
objętościowe składników.
M ⋅ c − M ⋅ c = M ⋅ R
•
p
v
Udział masowy
m
CM − CM = B
g
i
=
p
v
i
m
M - masa molowa
mi - masa i-tego składnika mieszaniny
B - uniwersalna stała gazowa, B ≅ 8314 J/(kmol⋅K) m - masa mieszaniny
Molowe ciepło właściwe
m = m
. . .
1
1 + m 2 +
+mk
M
C
= ⋅B ⋅(i + 2)
p
g
. . .
1
2
1 + g 2 +
+g =
k
• Udział objętościowy
1
CM =
⋅B ⋅i
V
v
r
i
=
2
i
V
i - liczba stopni swobody dla danego gazu
V
• dla gazu jednoatomowego i=3
i - objętość i-tego składnika mieszaniny
V - objętość mieszaniny
• dla gazu dwuatomowego i=5
V = V
. . .
• dla gazu trójatomowego i o większej liczbie atomów w 1 + V2 +
Vk
cząsteczce i=7
r
. . .
1
1 + r2 +
r =
k
Zależności
• Udział molowy
CM
n
c =
, J / (kg ⋅ K )
z
i
=
M
i
n
C
n
= , / ( ⋅
i - ilość moli i-tego składnika
c
J
kg K )
n - ilość moli mieszaniny
ρ
n = n
. . .
M
1 + n 2 +
+nk
C
C =
, J / (um3 ⋅ K )
z
. . .
1
1 + z2 +
z =
k
Φ
Wielkości zastępcze
M - masa molowa, kg/kmol
• Pozorna względna masa cząsteczkowa składnika ρ - gęstość, kg/m3
mieszaniny gazowej
Ciepło właściwe dla mieszaniny gazów
k
k
k
M
= ∑r M
⋅
= ∑ z M
⋅
c = ∑ g c
⋅ , J / (kg ⋅K)
m
i
i
i
i
m
i
i
i =1
i =1
i =1
Mi - masa molowa i-tego składnika mieszaniny
k
M
M
z
= ∑ ⋅ , / (
⋅
i - udział molowy i-tego składnika mieszaniny
C
z C
J
kmol K )
m
i
i
ri - udział objętościowy i-tego składnika mieszaniny i =1
M
k
g = r
i
= ∑ ⋅
3
, / (
⋅
i
i
C =
r C
⋅
J
um
K )
M
m
i
i
m
i =1
• Zastępcza stała gazowa mieszaniny
gi - udział masowy
k
B
zi - udział molowy
R
= ∑ g R
⋅ =
m
i
i
r
M
i - udział objętościowy
i =1
m
Wzory na obliczanie ilości ciepła
gi - udział masowy i-tego składnika
Q
n CM
= ⋅
⋅ T
∆
Ri - stała gazowa i-tego składnika
Q = m ⋅ c ⋅ T
∆
CIEPŁO WŁAŚCIWE
Q = V ⋅ C ⋅ T
∆
Ciepło właściwe oznacza ilość ciepła potrzebną do Q - ilość ciepła, J
ogrzania jednostki masy substancji o 1K.
W zale
CM - ciepło właściwe molowe, J/(kmol⋅K)
żności od warunków w jakich następuje ogrzewanie lub chłodzenie gazu rozróżniamy:
c - ciepło właściwe masowe, J/(kg⋅K)
• ciepło właściwe przy stałym ciśnieniu
C - ciepło właściwe objętościowe, J/(um3⋅K)
∆
c
T - różnica temperatury, K
p , J/(kg⋅K), k J/(kg⋅K)
• ciepło wła
ściwe przy stałej objętości
cv , J/(kg⋅K), k J/(kg⋅K)


Termodynamika ćw 1,2
GAZ PÓŁDOSKONAŁY
Gaz półdoskonały - czynnik termodynamiczny spełniający Mieszanina gazów półdoskonałych
równania gazu doskonałego, ale jego ciepło właściwe jest
zmienne i zależy od temperatury.
k
t
t
2
2
= ∑ ⋅
, / (
⋅ ), kJ / ( ⋅
W obliczeniach technicznych przemian gazów rzeczywistych c
g c
J
kg K
kg K )
m t
i
mi t
1
1
i =1
traktuje się je przeważnie jako gazy półdoskonałe.
k
t
t
C
2
= ∑ r ⋅C 2 , J / (um3 ⋅K), kJ / (um3 ⋅K) m
i
mi
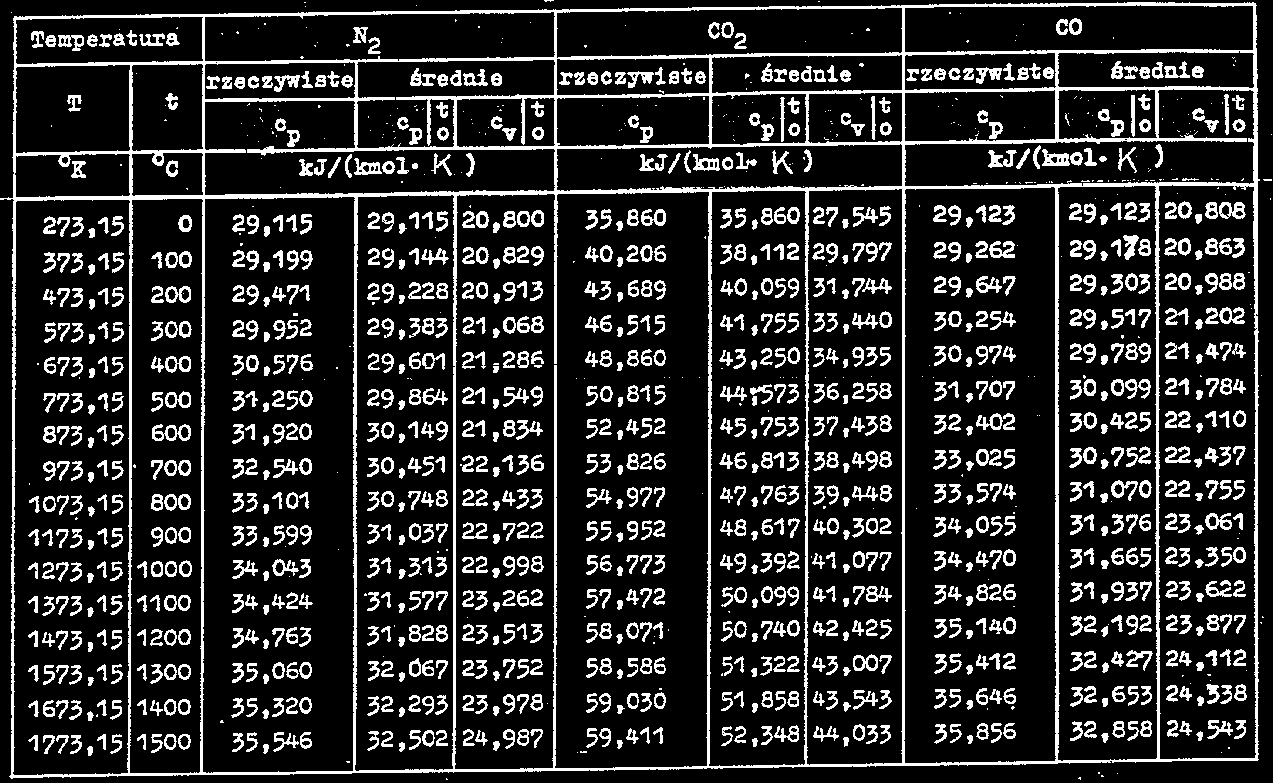
Średnie ciepło właściwe
t
t
1
1
i =1
t
t
2
1
⋅ −
⋅
k
t
c
t
c
t
t
t
M
2
M
2
c 2
0
2
0
1
=
C
= ∑ z ⋅C
, J / (kmol ⋅ K ), kJ / (kmol ⋅ K ) m
i
mi
t
t
t
1
1
1
t −
t
i =1
2
1
t
gi - udział masowy
1 , t2 - temperatura początkowa i końcowa przemiany, 0C
z
ct1
i - udział molowy
0 -średnie ciepło właściwe gazu od temp. 00C do temp. t1, 0
r
C
i - udział objętościowy
ct20 - średnie ciepło właściwe gazu od temp. 00C do temp. t2, 0C
Ciepło właściwe gazów półdoskonałych
Wyszukiwarka
Podobne podstrony:
Wzory TC TERM cw 6 7
Wzory TC TERM cw 8 9
ćw 4 Profil podłużny cieku
biofiza cw 31
Kinezyterapia ćw synergistyczne
Cw 1 ! komorki
Pedagogika ćw Dydaktyka
Cw 3 patologie wybrane aspekty
Cw 7 IMMUNOLOGIA TRANSPLANTACYJNA
Cw Ancyl strong
Cw 1 Zdrowie i choroba 2009
Rehabilitacja medyczna prezentacja ćw I
ćw 2b
Ćw 3 Elektorforeza Bzducha
więcej podobnych podstron