Rok akademicki 2010/2011 |
Chemia Fizyczna |
Data wykonania ćwiczenia:
13.10.2010 r. |
Kierunek studiów: Inżynieria Materiałowa |
Przewodnictwo elektryczne roztworów elektrolitów |
|
Nr grupy: 1 |
Sławosz Baran Grzegorz Cios |
Ocena: |
Nr zespołu: 12 |
|
|
Cel ćwiczenia:
Celem ćwiczenia jest poznanie podstawowych pojęć i zależności dotyczących przewodnictwa elektrycznego wodnych roztworów elektrolitów, metod pomiaru przewodnictwa oraz zastosowania wyników pomiarów przewodnictwa
Wykonanie ćwiczenia:
Wyznaczenie stopnia dysocjacji i stałej dysocjacji kwasu octowego.
Sporządzono po 5 roztworów HCl, NaCl, CH3COOH i CH3COONa , z których każdy następny jest dwukrotnie rozcieńczony w stosunku do poprzedniego. Mierzymy ich przewodnictwo za pomocą konduktometru
Zestawienie otrzymanych wyników:
Stężenie roztworu |
NaCl |
HCl |
CH3COOH |
CH3COONa |
[mol/dm3] |
mS/cm |
mS/cm |
mS/cm |
mS/cm |
0,1 |
10,214 |
37,8 |
0,571 |
7,064 |
0,05 |
5,688 |
18,648 |
0,423 |
4,114 |
0,025 |
2,682 |
9,296 |
0,289 |
2,212 |
0,0125 |
1,2716 |
4,094 |
0,2034 |
1,0614 |
0,0062 |
0,672 |
2,022 |
0,14624 |
0,498 |
Opracowanie wyników:
Stężenie roztworu |
Przewodnictwo właściwe HCl |
Λr |
√c |
|
[mol/dm3] |
mS/cm |
S/m |
S⋅m2/wal |
|
0,1 |
37,8 |
3,78 |
0,0378 |
0,3162 |
0,05 |
18,64 |
1,864 |
0,03728 |
0,2236 |
0,025 |
9,296 |
0,9296 |
0,037184 |
0,1581 |
0,0125 |
4,094 |
0,4094 |
0,032752 |
0,1118 |
0,00625 |
2,022 |
0,2022 |
0,032352 |
0,0787 |
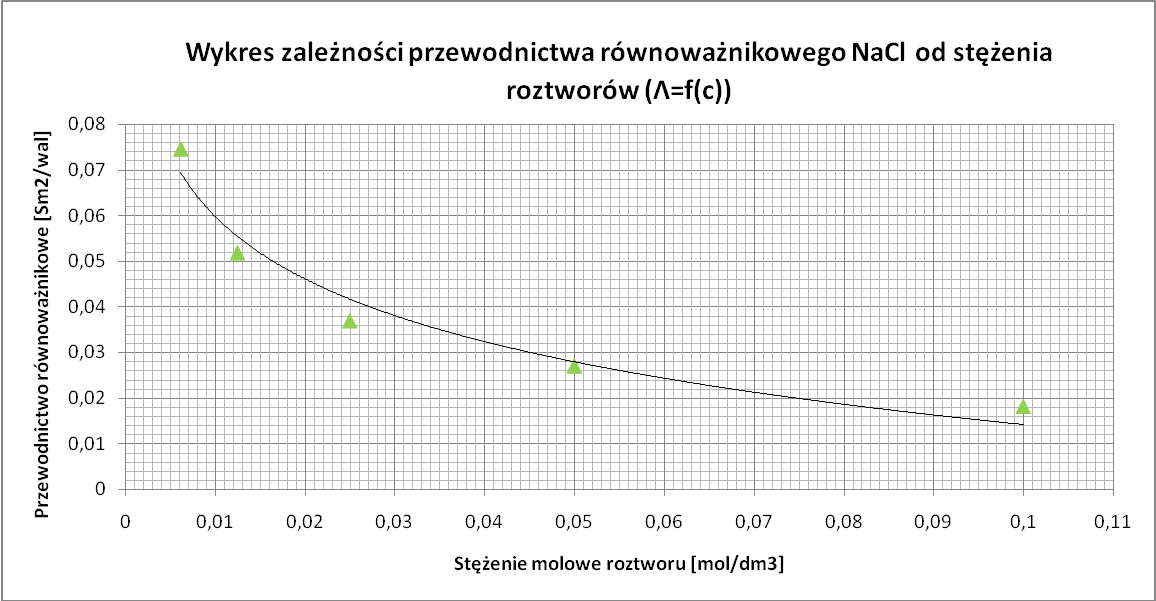
Stężenie roztworu |
Przewodnictwo właściwe NaCl |
Λr |
√c |
|
[mol/dm3] |
mS/cm |
S/m |
S⋅m2/wal |
|
0,1 |
10,214 |
1,0214 |
0,010214 |
0,3162 |
0,05 |
5,688 |
0,5688 |
0,011376 |
0,2236 |
0,025 |
2,682 |
0,2682 |
0,010728 |
0,1581 |
0,0125 |
1,2716 |
0,1271 |
0,010173 |
0,1118 |
0,00625 |
0,672 |
0,0672 |
0,010752 |
0,0787 |
Stężenie roztworu |
Przewodnictwo właściwe CH3COOH |
Λr |
√c |
|
[mol/dm3] |
mS/cm |
S/m |
S⋅m2/wal |
|
0,1 |
0,569 |
0,0569 |
0,000569 |
0,3162 |
0,05 |
0,423 |
0,0423 |
0,000846 |
0,2236 |
0,025 |
0,289 |
0,0289 |
0,001156 |
0,1581 |
0,0125 |
0,2034 |
0,02034 |
0,0016272 |
0,1118 |
0,00625 |
0,14624 |
0,014624 |
0,00233984 |
0,0787 |
Stężenie roztworu |
Przewodnictwo właściwe CH3COONa |
Λr |
√c |
|
[mol/dm3] |
mS/cm |
S/m |
S⋅m2/wal |
|
0,1 |
7,114 |
0,7114 |
0,007114 |
0,3162 |
0,05 |
4,114 |
0,4114 |
0,008228 |
0,2236 |
0,025 |
2,212 |
0,2212 |
0,008848 |
0,1581 |
0,0125 |
1,0614 |
0,10614 |
0,0084912 |
0,1118 |
0,00625 |
0,498 |
0,0498 |
0,007968 |
0,0787 |
![]()
Wyznaczanie metodą najmniejszych kwadratów równanie prostej dla roztworów: HCl, NaCl, CH3COONa.
|
a |
b |
HCl |
0,05371 |
0,033392 |
NaCl |
-0,00179 |
0,010717883 |
CH3COONa |
-0,01294 |
0,008631 |
Graniczne przewodnictwo równoważnikowe elektrolitu na podstawie danych pomiarowych:
|
|
NaCl |
HCl |
CH3COONa |
Λ ro= b |
S⋅m2/wal |
0,062 |
0,033392 |
0,008631 |
|
|
CH3COOH |
|
|
0,019977 |
Graniczne przewodnictwo równoważnikowe elektrolitu na podstawie danych tablicowych:
|
kation |
Λ+0 |
anion |
Λ-0 |
Λ ro |
|
|
S⋅m2/wal |
|
S⋅m2/wal |
S⋅m2/wal |
HCl |
H+ |
0,3498 |
Cl- |
0,007635 |
0,042615 |
NaCl |
Na+ |
0,00501 |
Cl- |
0,007635 |
0,012645 |
|
Na+ |
0,00501 |
|
0,004090 |
0,009100 |
|
H+ |
0,03498 |
|
0,004090 |
0,039070 |
Porównanie wartości granicznych przewodnictw równoważnikowych elektrolitów obliczonych na podstawie pomiarów i wartości tablicowych:
|
Dane z pomiarów |
Dane z tablic |
Różnica (błąd pomiaru) |
HCl |
0,033392 |
0,042615 |
0,009223 |
NaCl |
0,010717 |
0,012645 |
0,001928 |
CH3COONa |
0,008631 |
0,009100 |
0,000469 |
CH3COOH |
0,031305 |
0,039070 |
0,007765 |
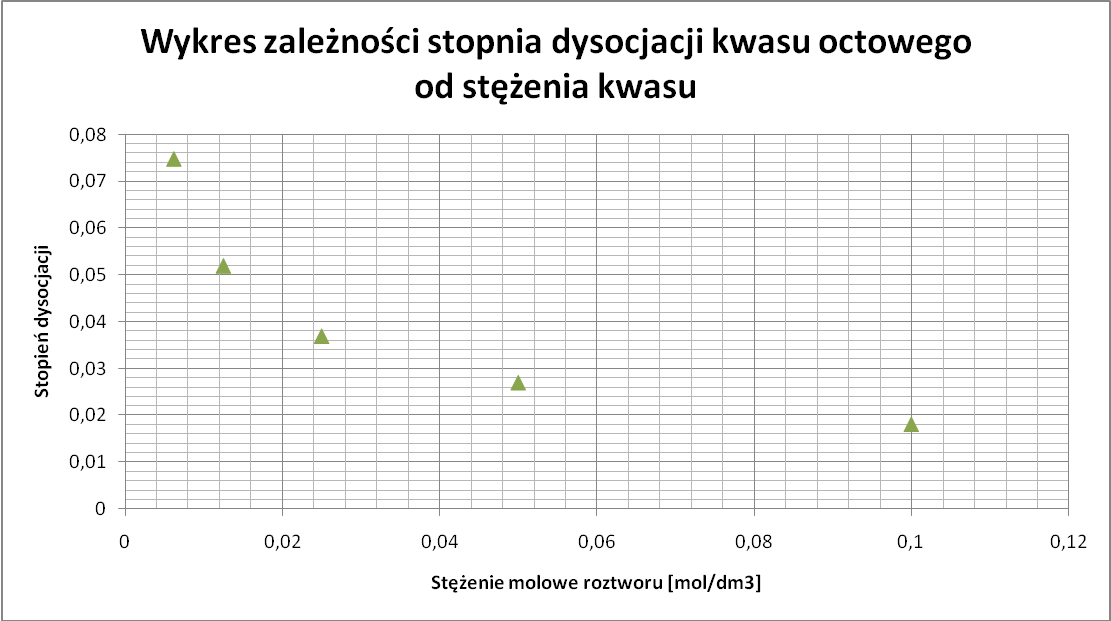
Stopień dysocjacji kwasu octowego:
Stężenie roztworu |
Stopień dysocjacji |
0,1 |
0,0181 |
0,05 |
0,0270 |
0,025 |
0,0369 |
0,0125 |
0,0519 |
0,0062 |
0,0747 |
Stała dysocjacji elektrolitycznej kwasu octowego:
Stężenie roztworu |
Stała dysocjacji elektrolitycznej |
0,1 |
0,000033364 |
0,05 |
0,000037461 |
0,025 |
0,000035344 |
0,0125 |
0,000034096 |
0,00625 |
0,000035094 |
Wnioski:
Wykonanie ćwiczenia pozwoliło nam na zapoznanie się z metodami pomiaru przewodnictwa elektrycznego wodnych roztworów elektrolitów. Bazując na wykresach wykonanych zgodnie z danymi w tabeli zauważamy, że przewodnictwo właściwe, a także przewodnictwo równoważnikowe zmieniają się wraz ze zmianą stężenia wodnego roztworu elektrolitu. Analizując dane uzyskane dla roztworu kwasu octowego możemy również stwierdzić, że wraz ze zmianą stężenia stopień dysocjacji ulega zmianie- wartości rosną wraz ze zmniejszaniem się stężenia. Obliczona na podstawie otrzymanych wartości stała dysocjacji, w wyniku błędów pomiarowych również ulega zmianie co jest zjawiskiem niepoprawnym. Jednak uzyskane wartości nieznacznie odbiegają od wartości 0,000035, dlatego tę wartość możemy uznać za wyliczoną stałą dysocjacji. Jedynie wykres zależności przewodnictwa równoważnikowego HCl od pierwiastka ze stężenia roztworów nie jest taki jak powinien gdyż przy wzroście pierwiastka ze stężenia przewodnictwo powinno maleć a na uzyskanym wykresie rośnie.
Wyszukiwarka
Podobne podstrony:
Wpływ AUN na przewód pokarmowy
3 Przewodnictwo elektryczne
Patologia przewodu pokarmowego CM UMK 2009
Wpływ stresu na motorykę przewodu pokarmowego ready
Krwawienie z przewodu pokarmowego lub zagrażające powikłania oraz dyskomfort pacjenta w zakresie hig
przewoz drogowy po nowelizacji adr
przewodnictwo synapsy
Choroby przewodu pokarmowego
Budowa przewodu pokarmowego
10 Przewody i kable
10 Patofizjologia przewodu pokarmowego
Choroby przewodu pokarmowego 4
warunki dz gospodarczej leczniczej hotele i przewozy
więcej podobnych podstron