Opracowała:
Małgorzata Rakicka
III „a”
Zad. 1.
W jakich odmianach występuje węgiel jako pierwiastek w przyrodzie?
Odp. 1
Węgiel w stanie wolnym występuje w przyrodzie w postaci trzech odmian, zwanych odmianami alotropowymi. Odmiany te różnią się między sobą właściwościami oraz aktywnością chemiczną. Różnice we właściwościach wynikają z różnej budowy wewnętrznej tych minerałów. Odmianami alotropowymi węgla są diament, grafit i fulereny.
Diament:
najtwardszy ze znanych minerałów
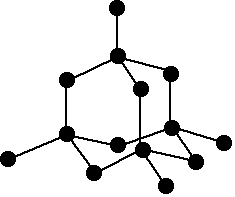
jest przezroczystym ciałem stałym, bezbarwny lub błękitny, niebieski, żółty, brunatny do czarnegogęstość około 3,5 g/cm
ma właściwości półprzewodnikowe
jest dobrym przewodnikiem ciepła
jest trudno topliwy i odporny na działanie kwasów i zasad
spala się w wysokiej temperaturze
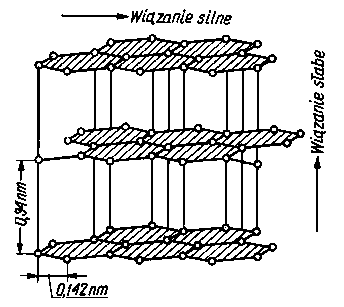
Grafit:
jest nieprzezroczystym, miękkim, łupliwym minerałem
o stalowoszarej barwie,
gęstość = 2,25 g/cm
dobrze przewodzi prąd elektryczny i ciepło
jest odporny na wysoką temperaturę.
Fulereny:
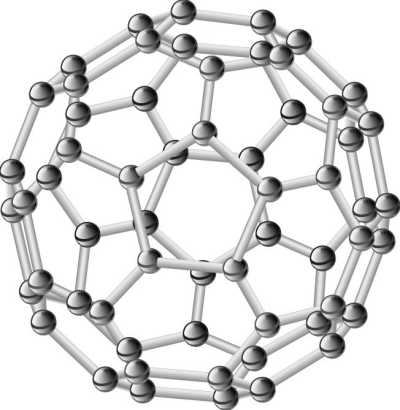
C60 jest półprzezroczystym, brązowym ciałem stałym o metalicznym połysku, fullereny w stanie stałym są barwy żółtejGęstość = 1,65 g/cm
Wykazują właściwości półprzewodnikowe i nadprzewodnikowe
C60 nie rozpuszcza się w wodzie ani eterze
C60 rozpuszcza się w węglowodorach i czterochlorku węgla
(fulereny rozpuszczone w benzynie przyjmują czerwone zabarwienie)
Zad.2
Co to jest szereg homologiczny związków organicznych?
Odp. 2
Szereg homologiczny to zbiór związków organicznych o zbliżonej strukturze, które różnią się między sobą tylko liczbą grup metylenowych ( -CH2- ) w ich łańcuchach węglowodorowych. Poszczególne związki z tego zbioru są nazywane homologami. Wzory sumaryczne wszystkich związków tworzących jeden szereg homologiczny daje się zapisać w formie ogólnej, w której występuje zmienna określająca liczbę grup metylenowych. Często w szeregach homologicznych węglowodorów nierozgałęzionych kilka pierwszych związków w szeregu ma nazwy zwyczajowe. W następnych rdzeń nazwy pochodzi od liczebników greckich lub łacińskich oznaczających liczbę atomów węgla w cząsteczce.
Zad. 3
Co to są węglowodory łańcuchowe nasycone i jakie mają właściwości?
Odp. 3
Węglowodory łańcuchowe nasycone to alkany. Ich cząsteczki
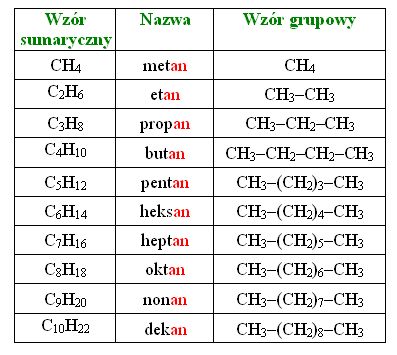
zawierają wiązania pojedyncze między atomami węgla.
Właściwości fizyczne węglowodorów nasyconych w szeregu
zmieniają się w sposób regularny ze wzrostem ich masy:
• Od 1-4 atomów C to gazy, od 5-16 atomów węgla to ciecze,
a 17 i więcej to ciała stałe
• Temperatury topnienia i wrzenia rosną wraz ze wzrostem
łańcucha
• Praktycznie nie rozpuszczalne w wodzie
• Między sobą mieszają się bez ograniczeń
• Dobre rozpuszczalniki tłuszczów i innych zw. Organicznych
• Gęstość ciekłych alkanów jest większa od gęstości wody
Wraz ze wzrostem długości łańcucha węglowego maleje lotność i palność związków.
Alkany są łatwopalne.
Zad. 4
Jakie są właściwości i zastosowanie metanu?
Odp. 4
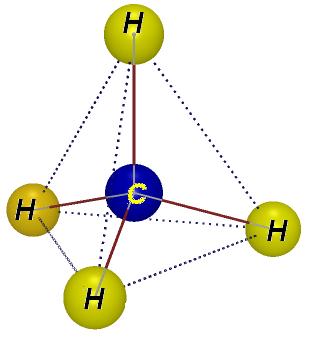
gazbezbarwny
bezwonny
lżejszy od powietrza
nierozpuszczalny w wodzie
d = 0,665 g/dm
mało aktywny chemicznie
ulega reakcji spalania:
całkowitego
półspalania
niecałkowitego
Zastosowanie metanu:
jako paliwo do silników
jako surowiec do otrzymywania tworzyw sztucznych
w przemyśle energetycznym
jest głównym składnikiem gazu ziemnego, którego używa się w sieci gazociągowej w gospodarstwie domowym.
Zad. 5 Co to są węglowodory łańcuchowe nienasycone i jakie mają właściwości?
Odp. 5
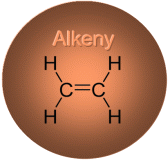
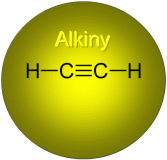
Wiązania podwójne i potrójne nazywane są wiązaniami wielokrotnymi. Węglowodory, których cząsteczki zawierają wiązania wielokrotne, nazywa się węglowodorami nienasyconymi. Najważniejsze z nich to alkeny ( z wiązaniem podwójnym między atomami węgla) i alkiny ( z wiązaniem potrójnym między atomami węgla).
Właściwości:
-bezbarwne
-łatwo palne
-słabo rozpuszczalne w wodzie
-reaktywne chemicznie (odbarwiają wodę bromową, ulegają reakcji: przyłączania, polimeryzacji)
-odczyn obojętny
-działanie narkotyczne
Zad. 6
Jakie są właściwości i zastosowanie etenu (etylenu)?
Odp. 6
gaz
bezbarwny
o przyjemnym, delikatnym zapachu
nierozpuszczalny w wodzie
aktywny chemicznie
ulega reakcji spalania:
całkowitego
półspalania
niecałkowitego
ulega reakcji przyłączania np. bromu, chloru, wodoru, chlorowodoru
ulega reakcji polimeryzacji
Etylen jest jednym z podstawowych surowców przemysłu petrochemicznego. Stosowany jest do produkcji polietylenu i wielu kopolimerów, etylobenzenu (do produkcji styrenu), tlenku etylenu, chloropochodnych (chlorek winylu, dichloroetan), etanolu i wyższych alkoholi alifatycznych.
Przedmioty codziennego użytku, np. kubek do mycia zębów, okładka na zeszyt, torebka śniadaniowa, są wykonane z tworzywa sztucznego zwanego polietylenem, który z kolei powstaje w wyniku polimeryzacji etylenu.
Zad. 7
Jakie są właściwości i zastosowanie etynu (acetylenu)?
![]()
Odp. 7
gaz
bezbarwny
bezwonny
nierozpuszczalny w wodzie
lżejszy od powietrza
d = 1,08 g/dm
bardzo aktywny chemicznie
ulega reakcji spalania:
całkowitego
półspalania
niecałkowitego
ulega reakcji przyłączania np. bromu, chloru, wodoru, chlorowodoru
ulega reakcji polimeryzacji
Acetylen stanowi surowiec do przemysłowego otrzymywania aldehydu octowego w tzw. reakcji Kuczerowa, katalizowanej przez siarczan rtęci. Znajduje także zastosowanie w produkcji m.in. chlorku winylu, chloroprenu i sadzy oraz używany jest do spawania i cięcia metali (palnik acetylenowo-tlenowy daje temperaturę 2700°C).
Zad. 8
Od czego zależą produkty spalania węglowodorów?
Odp. 8
Rodzaj produktów spalania zależy od warunków przeprowadzanego procesu, tj. od ilości dostarczonego tlenu.
Produktami spalania węglowodorów mogą być :
CO2 i H2O (w spalaniu całkowitym)
CO i H2O ( w półspalaniu)
C i H2O ( w spalaniu niecałkowitym)
Zad. 9
Na czym polega proces polimeryzacji?
Odp. 9
Polimeryzacja to reakcja tworzenia z pojedynczych cząsteczek, zwanych monomerami, związku chemicznego wielocząsteczkowego produktu- polimeru.
Polimeryzacji ulegają węglowodory nienasycone. W zależnością od rodzaju polimeru liczba cząsteczek połączonych może być różna i właściwości tworzywa w ten sposób utworzonego inne.
Polimeryzacja przebiega zasadniczo w trzech etapach:
zapoczątkowanie, czyli aktywacja monomeru (wytworzenie aktywnych cząsteczek),
wzrost, czyli przyłączanie następnych cząsteczek monomeru, przy czym rosnąca cząsteczka zachowuje stan aktywny, pozwalający na przyłączanie dalszych cząsteczek monomeru,
zakończenie procesu polimeryzacji z powodu wyczerpania się substratu.
Zad. 10
Jakie jest zastosowanie węglowodorów w życiu codziennym?
Odp. 10
Liczne węglowodory znajdują zastosowanie w życiu codziennym. Przykładami tego są:
metan; używany jako paliwo do silników, składnik gazu ziemnego
etan; otrzymywania alkoholi, estrów, benzyny, kauczuków syntetycznych i tworzyw syntetycznych
etylen; w atmosferze zawierającej etylen owoce szybciej dojrzewają, przedmioty codziennego użytku (kubek, torebka śniadaniowa itp.)
acetylen; w palnikach acetylenowo-tlenowych do spawania i cięcia metali (acetylen w dużej ilości tlenu spala się w temperaturze 2700°C)
w lampie acetylenowej do oświetlenia
w przemyśle chemicznym (m. in. do produkcji tworzyw sztucznych).
Sprawdź czy umiesz......
Wykryć obecność węgla i wodoru w substancjach organicznych?
Jeżeli w probówce umieścimy dowolną substancję organiczną i zaczniemy ogrzewać probówkę w płomieniach palnika, zauważymy, że na ścianach probówki pojawiają się kropelki wody, a użyta do doświadczenia substancja organiczna ulega zwęgleniu.
Jest to dowód na to, że w skład badanej substancji organicznej wchodzą wodór, tlen i węgiel.
Pisać wzory sumaryczne, strukturalne i półstrukturalne pierwszych czterech członów szeregów homologicznych alkanów, alkenów i alkinów?
Metan
Etan
Propan
Butan
Eten
Propen
Buten
Penten
Etyn
Propyn
Butyn
Pentyn
Wykryć produkty spalania całkowitego i niecałkowitego węglowodorów?
Należy zapalić palnik gazowy. Nad płomieniem ustawić skośnie dnem do góry zlewkę, której ścianki zwilżone są wodą wapienną. Następnie nad płomieniem palnika należy umieścić dnem do góry uchwyconą w łapkę probówkę.
Na ściankach zlewki pojawi się biały osad. Wynika stąd, że jednym z produktów spalania jest dwutlenek węgla. Ścianki probówki natomiast pokryją się czarnym nalotem- sadzą (czyli węglem), a wewnątrz pojawi się skroplona para wodna.
Pisać równania reakcji spalania węglowodorów przy pełnym i ograniczonym dostępie tlenu?
Spalanie niecałkowite:
2 C2H6 + 3 O2 4 C + 6 H2O
Spalanie całkowite:
2 C2H6 + 14 O2 4 CO2 + 6 H2O
Półspalanie:
2 C2H6 + 10 O2 4 CO + 6 H2O
Otrzymać eten (etylen)? Zbadać doświadczalnie jego właściwości?
Pierwszą probówkę należy umieścić w statywie. Następnie umieścić w niej pociętą folię polietylenową. Probówkę należy zatkać korkiem z rurką odprowadzającą. W krystalizatorze z wodą umieścić należy dnem do góry drugą probówkę, napełnioną wodą. Probówkę pierwszą należy ogrzewać, a wydzielający się gaz zbierać w probówce 2.
W ten sposób należy napełnić gazem trzy probówki.
Należy sprawdzić barwę i zapach otrzymanego gazu
Do wylotu probówki z etenem należy zbliżyć zapalone łuczywo. Nad płomieniem palącego się gazu należy umieścić w łapie probówkę, uchwyconą dnem do góry.
Do probówki z etenem należy wlać mała ilość wody bromowej lub rozcieńczonego roztworu manganianu (VII) potasu. Należy wstrząsnąć probówką.
Dla porównania do probówki z małą ilością wody bromowej lub rozcieńczonego roztworu manganianu (VII) potasu należy dodać benzyny lub wprowadzić rurką szklaną gaz z zapalniczki.
W probówce 1. folia topnieje i po chwili wydziela się bezbarwny gaz o delikatnym zapachu. Można zbierać go pod wodą, ponieważ jest w niej nierozpuszczalny.
Eten spala się jasnym, świecącym płomieniem. Na ściankach probówki umieszczonej nad płonącym etylenem skrapla się para wodna i powstaje czarny nalot- sadza. Zachodzi reakcja, którą przedstawia równanie:
C2H4 + O2 2 C + H2O
Podczas spalania był niepełny dostęp tlenu- zaszło spalanie niecałkowite. Eten może też ulec półspalaniu lub jeśli jest pełny dostęp tlenu- spaleniu całkowitemu.
Eten powoduje odbarwienie wody bromowej lub rozcieńczonego roztworu KmnO4, co świadczy o jego dużej aktywności chemicznej. Benzyna ani gaz z zapaliczki nie odbarwiają wody bromowej. Przyczyną zjawisk obserwowanych w doświadczeniach 3. i 4. jest różnica w budowie cząsteczek alkenów i alkinów. Różnica wynikają z faktu, że jedno wiązanie w wiązaniu podwójnym jest słabe. Podczas reakcji wiązanie to „pęka” i następuje reakcja przyłączania pierwiastka. Zachodzi następująca reakcja:
C2H4 + Br2 C2H4Br
Podobnie przebiega reakcja z innymi fluorowcami, wodorem i fluorowcowodorami.
Otrzymać etyn (acetylen) i zbadać doświadczalnie jego właściwości?
Należy zamontować zestaw jak w poprzednim doświadczeniu. W próbówce 1. należy umieści małą ilość świeżego karbidu (CaC2) i dodawać bardzo ostrożnie wodę z etanolem (zmieszane w stosunku 1:1) i z kroplą fenoloftaleiny. Probówkę należy zatkać korkiem z rurką odprowadzającą.
Wydzielający się gaz należy zbierać w probówce 2. W ten sposób napełnić dwie probówki i zatkać je korkami.
Korzystając z zebranego w probówce acetylenu, należy sprawdzić jego właściwości oraz działanie na wodę bromową.
Do wylotu probówki z zebranym gazem zbliżyć należy zapalone łuczywko.
Użyty w doświadczeniu karbid, czyli węglik wapnia CaC2, to biała, stała substancja krystaliczna. W czasie reakcji wydziela się bezbarwny, bezwonny, nierozpuszczalny w wodzie gaz- acetylen.
Równanie można zapisać następująco:
CaC2 + 2 H2O C2H2 + Ca(OH)2
Acetylen powoduje odbarwienie wody bromowej, podobnie jak etylen. Świadczy to o jego dużej aktywności chemicznej, związanej z obecnością potrójnego wiązania pomiędzy atomami węgla w cząsteczce. Równanie reakcji acetylenu z bromem ma następujący zapis:
C2H2 + 2 Br C2H2Br4
Acetylen jest łatwopalny, spala się kopcącym płomieniem. Zachodzi reakcja spalania niecałkowitego , którą przedstawia równanie:
2 C2H2 + O2 4 C + 2 H2O
Odróżnić doświadczalnie węglowodór nasycony i nienasycony?
Aby rozróżnić węglowodór nasycony i nienasycony należy przygotować dwie probówki. W jednej umieścić węglowodór nasycony (np. metan), a w drugiej- nienasycony (np. etyn).
Następnie do każdej z probówek należy dodać wody bromowej lub rozcieńczonego roztworu manganianu (VII) potasu.
W probówce pierwszej nie zajdą żadne zmiany. Natomiast w probówce drugiej- woda bromowa odbarwi się, co jest skutkiem posiadania wielokrotnego wiązania między atomami węgla.
Pisać równania reakcji węglowodorów nienasyconych z wodorem, fluorowcami i fluorowcowodorami?
C2H4 + H2 C2H6
C2H2 + 2 Br2 C2H2Br4
CH3-CH=CH2 + HCl CH3-CHCl-CH3
Obliczać procentową zawartość węgla w węglowodorach?
Np. dla C2H6
mC2H6= 2* mC + 6 * mH
mC2H6 = 2 * 12 u + 6 * 1u
mC2H6 = 30 u
%C = mC / mC2H6 * 100%
%C = 2 * 12 u / 30 u * 100%
%C = 80
Podać wzór i nazwę węglowodoru na podstawie znajomości masy cząsteczkowej?
Np. Masa cząsteczkowa = 26 u
CnH2n+2
12n + 2n + 2 = 26
14n= 24
n= 1, 7....
CnH2n
12n + 2n = 26
14n = 26
n= 1,9.....
CnH2n-2
12n+2n-2 = 26
14n= 28
n=2
CnH2n-2
C2H2*2-2
C2H2 - etin- acetylen
Obliczać stosunek mas węgla do wodoru w węglowodorach?
Np. propan - C3H8
mC3H8 = 3*mC + 8*mH
mC3H8 = 3*12u + 8*1u
mC3H8 = 44 u
mC3 = 3*12u
mC3 = 36 u
mH8= 8 * 1u
mH8 = 8 u
sprawdzenie:
mC3H8 = mC3 + mH8
mC3H8 = 36 u + 8 u
mC3H8 = 44 u
stosunek mas węgla do wodoru jest równy:
36u : 8 u
czyli
36:8
czyli
9:2
Wyszukiwarka
Podobne podstrony:
Fizyka praca nr 2
praca nr 3 TXYGXFZ32ONRPPIBBUA2TIDC44VATNCNRKCNFAY
Praca Nr 1 II sem BHP KOrdowski Prawna Ochrona Pracy (10), BHP Ula
praca nr 1 analiza zmian wielkosci podrozy
Praca Nr 2 Mikroklimat środowiska pracy wpływ na zdrowie pracownika i?zpieczeństwo pracy (2)
Praca nr 3
Praca nr 3 Analiza uslug nnoclegowych w Polsce
Fizyka praca nr 3
Leksykologia i Leksykografia - praca nr 1 o rodzajach definicji, Leksykologia
techniki bezpieczeństwa praca nr 2, BHP Ula
rachunkowość praca nr 2 analiza pionowa bilansu, Dokumenty(1)
Matematyka praca nr 1
parafiniuk praca nr 1na zaliczenie
Praca nR 2 techniki bezpieczeństwa, BHP Ula
Praca nr 1 Toksykologia, BHP Ula
Praca nr 6
Praca nr 32
Praca nr 3
Materiał ścierny - praca nr 2, BHP Ula
więcej podobnych podstron