Zestaw 54.
Błonowe receptory hormonów.
Wszystkie hydrofilowe i pewne lipofilowe hormony wiążą się z receptorami na powierzchni komórki (hormony sterydowe i hormony tarczycy mają receptory wewnątrz komórki). Receptory te są białkami zanurzonymi w błonie komórkowej. Wszystkie one mają dwie domeny czynnościowe: pierwsza wiąże ligand (hormon), a druga wytwarza sygnał, najczęściej poprzez przekaźniki drugiego rzędu albo poprzez regulację przepuszczalności kanałów jonowych. Powoduje to fizjologiczne zmiany, zazwyczaj prowadzące do zmiany aktywności jakiegoś enzymu.
Receptory błonowe można podzielić na:
metabotropowe:
- rec. sprzężone z białkiem G: muskarynowe rec. Ach; adrenoreceptory, rec. angiotensyny, kanabinoidów, opioidów, cholecystokininy, dopaminy, glukagonu, histaminy, serotoniny, glutaminianu, fotoreceptory, rec. węchu i wiele innych
- rec.o aktywności tyrozynowych kinaz białkowych: erytropoetyny, insuliny, czynników wzrostu
- rec. cyklazy guanylowe: przedsionkowy peptyd natriuretyczny (ANP)
jonotropowe: receptory neurotransmitterów: rec. nikotynowe Ach, rec. GABA, serotoniny, glutaminianu
Receptory sprzężone z białkiem G: rodzina białek receptorów transbłonowych. Są to integralne białka błonowe, mające 7 hydrofobowych domen spinających błonę cytoplazmatyczną. Związanie cząsteczki hormonu z receptorem wywołuje zmiany konformacyjne w białku receptorowym (te 7 domen), a to pobudza białka G. Białka G tworzą heterotrimer αβγ związany z GDP. Związanie hormonu powoduje wypieranie GDP i przyłączanie GTP do podjednostki α. Ta się następnie odczepia i wywołuje określony efekt, np.: (efekt ten zależy również od tego poprzez jakie białko G działa)
- aktywację cyklazy adenylanowej (poprzez białko Gs) - wówczas informacja jest przekazywana do wnętrza komórki za pośrednictwem cAMP. cAMP aktywuje kinazę białek A, łączy się z jej podjednostkami receptorowymi i umożliwia oddysocjowanie podjednostek katalitycznych. Te z kolei katalizują fosforylację reszt Ser białek. Enzymy aktywowane przez fosforylację to np. fosforylaza glikogenowa i lipaza triacyloglicerolowa, a deaktywowane przez fosforylację: syntaza glikogenowa, dehydrogenaza pirogronianowa oraz zmniejszenie ruchliwości nośnika glukozy i aminokwasów w błonie komórkowej. Wg tego mechanizmu działają m.in. hormony: glukagon, somatotropina (STH). tyreotropina (TSH), adrenokortykotropina (ACTH), parathormon (PTH), wazopresyna, adrenalina poprzez receptory β.
Reakcję przeciwstawną wywołują białka Gi - zachodzi hamowanie cyklazy adenylanowej - tak działa np. adrenalina poprzez rec. α2.
- poprzez białko Gq aktywację fosfolipazy C i hydrolizę fosfatydyloinozytoli z wytworzeniem inozytolo-1,4,5-trifosforanu (IP3) i diacylogliceroli (DAG). IP3 powoduje uwalnianie jonów Ca2+ z siateczki śródplazmatycznej, który jest wiązany przez kalmodulinę (w mięśniach przez troponinę). Kompleks ten aktywuje m.in. dehydrogenazę pirogronianową, α-ketoglutaranową i izocytrynianową w mitochondriach. DAG z kolei aktywuje kinazę białek C, a ta pobudza wymianę jonów H+ na Na+ - podwyższa to pH i sprawia, że powinowactwo kalmoduliny do Ca2+ rośnie. Krótko mówiąc, DAG wzmacnia działanie IP3.
- regulację przepuszczalności kanałów jonowych, poprzez białko Gi. W zależności od bodźca, efekt jest zróżnicowany (aktywacja kanałów potasowych, hamowanie kanałów wapniowych)
Receptory o aktywności tyrozynowych kinaz białkowych, na przykładzie rec. insulinowego. Jest on tetramerem α2β2. Tylko podj. α biorą udział w wiązaniu insuliny. Są zlokalizowane na zewnętrznej powierzchni błony kom., mają charakter hydrofilowy, są bogate w cysteinę i zawierają reszty cukrowe. Odcinki C-końcowe podj. α łączą się z odc. N-końcowym podj. β. Przyłączenie insuliny do podj. α, powoduje zmianę konformacji podj. β. Zmienione podj. β wykazują aktywność tyrozynowych kinaz białkowych, katalizują własną fosforylację i fosforylację białka IRS-1, które jest cytoplazmatycznym substratem receptora insulinowego. Jest ono białkiem adaptorowym, inaczej cumującym, gdyż na nim zakotwiczają się białka regulatorowe z domenami SH. Domeny SH2 mają dwie kieszenie hydrofobowe. Jedna z nich łączy się z ufosforylowaną tyrozyną na IRS-1, a druga rozpoznaje jeden z aminokwasów sąsiadujących z resztą fosfotyrozylową. Od pozycji tejże ufosforylowanej tyrozyny zależy sygnał przekazywany poprzez domeny SH na inne enzymy. Pobudzając receptor błonowy, insulina przekazuje informację, która wyzwala:
- defosforylację białek przez aktywację fosfataz białkowych, które aktywują syntazę glikogenową i dehydrogenazę pirogronianową, a hamują aktywność fosforylazy glikogenowej i lipazy triacyloglicerolowej
- hamowanie cyklazy adenylanowej
- aktywację fosfodieserazy cAMP
- inhibicję podjednostki katalitycznej kinazy białkowej A
- wpływa również na ekspresję niektórych genów i syntezę białek
Cyklaza guanylowa występuje w postaci rozpuszczalnej oraz związanej z błoną komórkową. Cyklaza guanylowa katalizuje powstawanie cGMP z GTP. Wiążąze się z nią peptydy natriuretyczne powodują wzrost wytwarzania cGMP i aktywację cGMP-zależnej kinazy białek, która katalizuje fosforylację szeregu białek miocytów naczyniowych -> relaksacja miocytów i rozszerzenie naczyń.
Czynniki wpływające na szybkość przemian szlaku pentozowego.
Pierwsza reakcja szlaku pentozofosforanowego - utlenienie glukozo-6-fosforanu do 6-fosfoglukono-δ-laktonu, katalizowana przez dehydrogenazę glukozo-6-fosforanową, jest nieodwracalna i stanowi główne miejsce kontroli. To ona ogranicza szybkość procesu. Najważniejszym czynnikiem tutaj jest poziom NADP+ (akceptora elektronów w tej reakcji). Gdy komórka zużywa NADPH, gromadzi się duże stężenie NADP+ i stymulowany jest szlak pentozofosforanowy (przebiega szybciej), powstające produkty są intermediatami glikolizy. Ponadto, NADPH współzawodniczy z NADP+ w wiązaniu enzymu.
Reakcje fazy nieutleniającej są kontrolowane przez stężenie substratów. Gdy jest duże zapotrzebowanie na rybozo-5-fosforan (substrat dla syntezy DNA, RNA, FAD, NAD, ATP, CoA), reakcje fazy nieutleniającej przebiegają w odwrotną stronę (reakcje transketolaz i transaldolaz są odwracalne) - F-6-P i aldehyd 3-fosfoglicerynowy są z powrotem przekształcane do rybozo-5-fosforanu.
Rybosomy - struktura, funkcja.
Są to organella syntetyzujące białka (tłumaczą mRNA na białko). Składają się z rRNA i białek rybosomalnych. Mogą występować jako rybosomy związane z błoną - w szorstkiej siateczce śródplazmatycznej ich zadaniem jest produkcja białek transportowancych przez siateczkę śródplazmatyczną (białka wydzielnicze, enzymy lizosomalne, białka wchodzące w skład błon) lub rybosomy wolne - odpowiedzialne za produkcję białek wędrujących do jądra, białka cytoplazmy i białka cytoszkieletu.
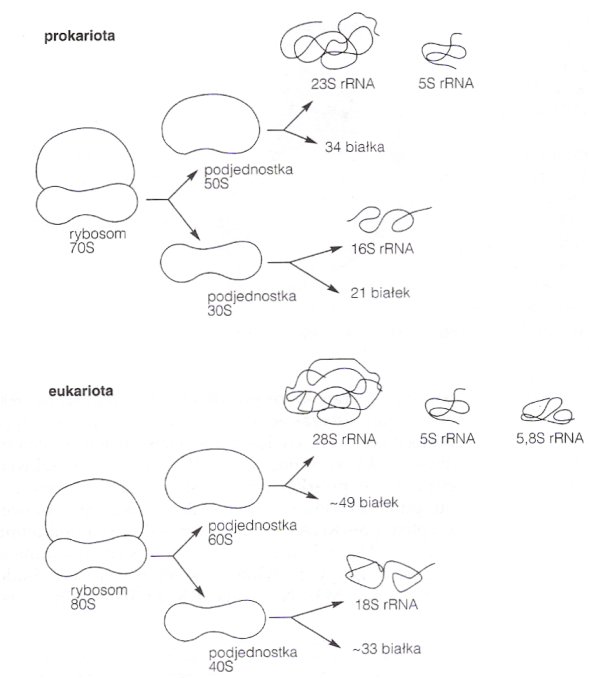
Dzielą się na podjednostki (zazwyczaj dwie - małą i dużą). Podjednostki różnią się stałymi sedymentacji i są różne u Prokaryota i Eucaryota. Rybosomy w mitochondriach i chloroplastach Eucaryotów przypominają prokariotyczne rybosomy.
Mała podjednostka wiąże się z czynnikami inicjującymi translację i dzięki nim wiązana jest do mRNA, następnie przyłącza się inicjujący tRNA - tworzy się kompleks inicjujący 30S (u Prokaryota) lub 40S (u Eucaryota). Kolejnym etapem jest wiązanie dużej podjednostki rybosomu (50S u Prok., 60S u Euc.). Razem tworzą kompleks inicjujący 70S (Proc.) lub 80S(Euc.). Wówczas może się rozpocząć proces translacji. Duża podjednostka ma trzy miejsca wiązania tRNA: m. wiązania aminoacylo-tRNA (miejsce A), peptydylo-tRNA (miejsce P) oraz miejsce wyjścia tRNA (miejsce E). Rybosomy mogą działać równolegle, kilka na jednej nici mRNA, tworzą wówczas tzw. polirybosomy (polisomy). Po wszystkim, rybosomy z powrotem dysocjują na podjednostki.
Wyszukiwarka
Podobne podstrony:
Zestaw 51 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 50 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 52 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 53 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 88 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
ZESTAW 5 Ania Piecuch, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowani
zestaw 97 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
zestaw 1 Ania Piecuch, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowani
zestaw 96 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 94 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 90 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 91 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
ZESTAW 47 Kasia Gawęda, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowan
Zestaw 89 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 93 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
zestaw 87 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
ZESTAW 39 Kasia Gaweda, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowan
Zestaw 2 Ania Piecuch, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowani
ZESTAW 40 Kasia Gaweda, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowan
więcej podobnych podstron