Zestaw 50.
Udział intermediatów cyklu Krebsa w metabolizmie.
Cykl kwasu cytrynowego jest procesem amfibolicznym, bo odgrywa rolę w procesach syntezy jak i w procesach oksydacyjnych. Intermediaty cyklu Krebsa biorą udział w glukoneogenezie, glikolizie, transaminacji, deaminacji, syntezie kwasów tłuszczowych, porfiryn, nukleotydów purynowych i pirymidynowych.
cukry:
- pirogronian (produkt glikolizy) jest metabolizowany na dwa sposoby:
1. kompleks dehydrogenazy pirogronianowej katalizuje jego oksydacyjną dekarboksylację do CO2 i acetylo-CoA (a ten wchodzi do cyklu Krebsa i tam jest degradowany do CO2)
2. może służyć za substrat w glukoneogenezie:
pirogronian + CO2 + H2O + ATP ----> szczawiooctan + ADP + Pi
katalizowana przez karboksylazę pirogronianową
a następnie:
szczawiooctan + GTP -----> fosfoenolopirogronian + CO2 + GDP
reakcja katalizowana przez karboksykinazę PEP
aminokwasy:
- poniższe reakcje katalizowane przez transaminazy dostarczają aminokwasów do cyklu Krebsa, ale także intermediaty cyklu Krebsa mogą służyć do syntezy aminokwasów (reakcje te są odwracalne!):
glutaminian + pirogronian <----> α-ketoglutaran + alanina
asparaginian + pirogronian <-------> szczawiooctan + alanina
- alanina, cysteina, glicyna, hydroksyprolina, seryna, treonina, tryptofan ulegają przekształceniu w pirogronian. Mogą ulec całkowitemu utlenieniu do CO2 jeśli będą przekształcone w acetylo-CoA (przez kompleks dehydrogenazy pirogronianowej) albo trafić do glukoneogenezy przez karboksylację do szczawiooctanu (karboksylaza pirogronianowa)
- arginina, histydyna, glutamina, prolina, poprzez glutaminian przechodzą w α-ketoglutaran (p.w.) i wspierają glukoneogenezę poprzez przejście cyklu Krebsa do szczawiooctanu
- izoleucyna, metionina, walina tworzą sukcynylo-CoA i wspierają glukoneogenezę j.w.
- tyrozyna, fenyloalanina tworzą fumaran i wspierają glukoneogenezę j.w.
tłuszcze:
- acetylo-CoA powstały w degradacji tłuszczów wchodzi do cyklu Krebsa
- propionylo-CoA powstały w degradacji tłuszczów o nieparzystej liczbie węgli jest karboksylowany przez karboksylazę propionylo-CoA (koenzym biotyna, zużywa ATP) do metylomalonylo-CoA, a ten jest przekształcany przez mutazę metylomalonylo-CoA do sukcynylo-CoA i wchodzi do cyklu Krebsa
- kwasy tłuszczowe mogą być syntetyzowane z acetylo-CoA powstającego z pirogronianu. Jednak kompleks dehydrogenazy pirogronianowej jest enzymem mitochondrialnym, a synteza zachodzi w cytoplazmie. Transport odbywa się na drodze cytrynianu. Na zewnątrz błony mitochondrialnej cytrynian jest rozszczepiany przez liazę ATP:cytrynianową do acetylo-CoA i szczawiooctanu (enzym zużywa ATP).
mleczan, ważny substrat glukoneogenezy, jest przekształcany w pirogronian (dehydrogenaza mleczanowa), a następnie w szczawiooctan.
syntezę porfiryn zasila sukcynylo-CoA w reakcji kondensacji z glicyną katalizowanej przez syntazę kwasu aminolewulinowego
fumaran jest produktem (ubocznym) w biosyntezie puryn (dwie cząsteczki) oraz w cyklu mocznikowym (argininobursztynian ---> arginina + fumaran <liaza argininobursztynianowa>)
Biosynteza kwasów żółciowych.
Kwasy żółciowe syntetyzowane są w wątrobie z cholesterolu. Pierwszą reakcją jest 7α-hydroksylacja, katalizowana przez 7α-hydroksylazę, enzym mikrosomalny. Enzym wymaga tlenu, NADPH i cytochromu P-450; jest monooksygenazą Ten etap podlega regulacji (cholesterol pobudza syntezę, kwasy żółciowe ją hamują). Powstaje 7α-hydroksycholesterol. Ten następnie w kilku etapach przekształca się do choloilo-CoA lub chenodeoksycholoilo-CoA - następuje hydroksylacja, skracanie łańcucha bocznego i redukcja wiązania podwójnego. Te pierwotne kwasy żółciowe przechodzą do żółci w postaci połączenia z glicyną (kwas glikocholowy, glikochenodeoksycholowy) i tauryną (kwas taurocholowy, taurochenodeoksycholowy) <tauro- jest 3 razy wiecej niż gliko->. Odczyn żółci jest zasadowy i występuje w niej dużo Na+ i K+, toteż przyjmuje się, że kwasy żółciowe występuję w postaci soli.
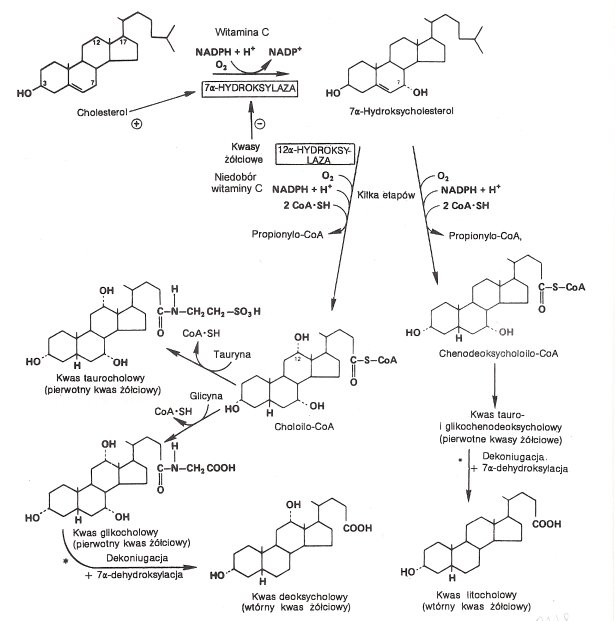
Część pierwotnych kwasów żółciowych ulega przekształceniu w jelicie dzięki bakteriom jelitowym do wtórnych kwasów żółciowych. Proces ten obejmuje 7α-dehydroksylację. Tworzą się kwasy: deoksycholowy z cholowego i litocholowy z chenodeoksycholowego.
Polimerazy RNA u Eucaryota.
Jądro komórkowe Eucaryota zawiera trzy typy polimeraz RNA. Różnią się umiejscowieniem, wrażliwością na inhibitory (α-ammanitynę) i specyficznością w stosunku do matrycy:
Typ |
Umiejscowienie |
Transkrypty komórkowe |
Wpływ inhibitora |
I |
jąderko |
rRNA 18S, 5,8S, 28S |
niewrażliwa |
II |
nukleoplazma |
pre-mRNA, snRNA |
bardzo wrażliwa |
III |
nukleoplazma |
tRNA, 5S rRNA |
wrażliwa przy dużym stężeniu |
Działają podobnie jak polimerazy prokariotyczne. tzn katalizują nukleofilowy atak grupy 3'-OH nowego łańcucha na atom fosforu α wchodzącego nukleotydu. Do transkrypcji niepotrzebny jest starter, zaś synteza zachodzi w kierunku 5'->3'. Enzymy te nie posiadają aktywności nukleazowej, więc błędy w nowotworzonym łańcuchu nie są poprawiane.
Mają trzy konserwatywne cechy:
są zbudowane z 8-12 jednostek, np. polimeraza rna II u drożdży składa się z 11 podjednostek.
zawierają dwie duże podjednostki (220kDa i 140kDa) zwane RPB1 i RPB2 - odpowiadają one jednostkom β i β' w polimerazie RNA u Prokaryota.
wszystkie polimerazy RNA II mają wspólne trzy podjednostki RPB5, 6 i 8. W istocie te podjednostki występują również w polimerazach I i III.
Sama polimeraza II nie jest w stanie rozpocząć transkrypcji, wymaga obecności czynników transkrypcyjnych (TFII), które nakierowują ją na miejsce startu.
2
Wyszukiwarka
Podobne podstrony:
Zestaw 54 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 51 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 52 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 53 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 88 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
ZESTAW 5 Ania Piecuch, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowani
zestaw 97 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
zestaw 1 Ania Piecuch, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowani
zestaw 96 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 94 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 90 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 91 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
ZESTAW 47 Kasia Gawęda, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowan
Zestaw 89 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 93 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
zestaw 87 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
ZESTAW 39 Kasia Gaweda, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowan
Zestaw 2 Ania Piecuch, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowani
ZESTAW 40 Kasia Gaweda, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowan
więcej podobnych podstron