Prawo Nenrsta - prawo równowagi fazowej, prawo głoszące, że dla dwu niemieszających się, będących w kontakcie i pozostających ze sobą w równowadze cieczy, stosunek stężeń trzeciego składnika, rozpuszczonego w każdej z tych cieczy, jest stały w danych warunkach temperatury i ciśnienia. Stosunek ów nazywa się współczynnikiem podziału.
„Zastosowanie reguły faz Gibbsa do układu trójskładnikowego
Reguła faz Gibbsa znajduje zastosowanie min. w układzie trójskładnikowym ( woda, ciecz organiczna, rozpuszczalnik organiczny ). Pozwala ona obliczyć liczbę stopni swobody (z) , tzn. liczbę parametrów układu, które można dowolnie dobrać nie naruszając tym stanu równowagi fazowej .
(Wszystkie parametry układu , uwzględniając wielkości p,T , wynoszą α∗β+2 ,gdzie α -liczba składników , β - liczba faz ).
Liczba stopni swobody ( reguła faz Gibbsa ) wynosi więc z=α∗β+2-α(β-1) -β=α−β+2
Gdzie α(β-1) liczba ułamków dla α składników , ściśle określonych zależnościami:
μi(1)= μi(2) = μi(3)=......= μi(β) (potencjał chemiczny dowolnego składnika „i” jest taki sam we wszystkich fazach ).
Dla układu trójskładnikowego, gdzie dwie ciecze nie mieszają się , natomiast trzecia rozpuszcza się dobrze w każdej z nich , liczba stopni swobody wynosi : z=3 - 2 + 2=3 (powstaną dwa trójskładnikowe roztwory sprzężone ) , a więc , gdy p,T=const mamy f(xA',xB', xA”, xB”)=0.
Graficznym przedstawieniem tej zależności jest trójkąt równoboczny , zwany trójkątem Gibbsa-Roosebooma.
Trójkąt taki powstaje w następujący sposób :
w wierzchołki trójkąta wpisujemy np. % wagowe czystego składnika , następnie na każdym boku odkładamy skład odpowiednich układów dwuskładnikowych , a punkt wewnętrzny odpowiada układowi trójskładnikowemu.
Linia równoległa do boku odpowiada układowi , w którym zawartość danego składnika jest stała .Skład układu trójskładnikowego znajduję prowadząc przez odpowiedni punkt proste równoległe do boków AB i BC , przy czym ułamki Xa,Xb,Xc można odczytać na boku AB . Punkt w trójkącie odpowiadający danemu układowi znajduję odmierzając ułamki na podstawie trójkąta i prowadząc proste równoległe do pozostałych dwóch boków . Dowolna prosta przechodząca przez wierzchołek reprezentuje układy , w których stosunek ułamków dwóch odpowiednich składników jest stały.
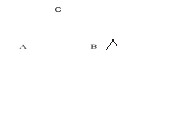
Xa
Rys. : Trójkąt Gibbsa-Roosebooma ( jeden z etapów nanoszenia punktów na izotermę mieszania).
Reguła faz Gibbsa określa zachowanie się układu pod wpływem narzuconej mu zmiany jednej lub kilku zmiennych intensywnych. Stwierdza ona, że liczba zmiennych intensywnych, których wartości można zmieniać nie powodując przez to zmniejszenia liczby faz w układzie, czyli tzw. liczba stopni swobody układu s jest o dwa większa od różnicy liczby składników niezależnych(α) i liczby faz (β) w tym układzie
s= α - β + 2
Liczba składników niezależnych wyraża najmniejsza liczbę substancji(związków, pierwiastków, jonów), jaka jest potrzebna dla sprecyzowania składu chemicznego danego układu.
Wykresy fazowe układów trójskładnikowych przedstawia się zazwyczaj w trójkątnym układzie współrzędnych (trójkąt Gibbsa-Roozebooma), w którym wierzchołki trójkąta równobocznego odpowiadają czystym składnikom, boki-układom dwuskładnikowym, pole-układom trójskładnikowym.
Bok trójkąta leżący np. naprzeciw wierzchołka A odpowiada nieobecności składnika A. Natomiast przechodząca przez trójkąt linie poziome określają wzrastające zawartości procentowe składnika A od zera przy podstawie do 100% przy wierzchołku A. Podobnie zawartości procentowe składników B i C wyznaczone są przez odległości między dwoma bokami trójkąta a odpowiednimi wierzchołkami.
Korzystając z tych trzech skal można określić skład odpowiadający dowolnemu punktowi wewnątrz trójkąta. Przykładowo punkt K zaznaczony na wykresie ma następujące zawartości procentowe składników A=20%, B=40% i C=40%.
Dla roztworów niezbyt stężonych matematycznym wyrazem zależności f(xcI, xcII) = 0 jest równanie zwane prawem podziału:
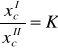
![]()
gdzie:
c1, c2 - stężenia molowe odpowiadające ułamkom molowym xcI i xcII
K - stała podziału zależna od parametrów p i T.
Prawo podziału ma zastosowanie w układach zawierających dwie ciecze A i B, które nie mieszają się ze sobą oraz trzeci składnik rozpuszczający się w obu tych cieczach. Po ustaleniu się równowagi w układzie istnieją dwa roztwory dwuskładnikowe: C w A i C w B. Stężenie c0 w fazie C+A maleje do c1, a w fazie C+B osiąga wartość c2. A zatem liczba moli składnika C, których ubyło z roztworu C w A wynosi (c0 - c1)v1.
Stała podziału K można wyznaczyć mierząc stężenia w obu fazach będących ze sobą w równowadze. Stężenia c0 i c1 mierzy się metodą refraktometryczną.
Prawo podziału Nernsta - stosunek aktywności substancji rozpuszczonej w dwu niemieszających się fazach jest w danej temperaturze stały i nie zależy od stężeń w obu fazach. wyrazić tą zależność można wzorem:
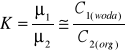
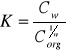
W przypadku gdy substancja rozpuszczana w jednej z faz dysocjuje lub asocjuje zależność ta nie wygląda tak prosto, należy przedstawić ją wzorem:
gdzie n oznacza ile razy zmieniła się masa cząsteczkowa substancji rozpuszczonej w drugim rozpuszczalniku do masy w pierwszym. ![]()
Po zlogarytmowaniu otrzymujemy:
Część teoretyczna
Reguła faz Gibbsa, zależność pomiędzy liczbą faz w układzie wielofazowym, a liczbą stopni swobody tego układu:
f = k - s + 2,
gdzie: f - liczba faz, k - liczba niezależnych składników, s - liczba stopni swobody.
Liczba stopni swobody - liczba niezależnych intensywnych parametrów stanu koniecznych do pełnego opisu danego układu. Liczba stopni swobody rośnie ze wzrostem liczby składników i faz, a maleje ze wzrostem liczby równowag międzyfazowych i reakcji chemicznych zachodzących w opisywanym układzie.
Faza - w termodynamice: część układu termodynamicznego jednakowa pod względem właściwości fizycznych i chemicznych. Przejście pomiędzy fazami współistniejącymi w danym układzie wiąże się ze skokową zmianą, co najmniej jednego parametru termodynamicznego.
W ćwiczeniu nr 31, zajmę się układem trójskładnikowym. Skład układu trójskładnikowego przedstawia się zazwyczaj posługując się trójkątnym układem współrzędnych, zaproponowanym przez Gibbsa i Roosebooma. Wykres ma postać trójkąta równobocznego, którego wierzchołki reprezentują czyste składniki, boki - układy dwuskładnikowe, a pole trójkąta układy trójskładnikowe. Układy o jednakowej zawartości określonego składnika znajdą się na takim wykresie na linii prostej, poprowadzonej równolegle do boku trójkąta, leżącego naprzeciw wierzchołka reprezentującego dany składnik i odpowiedniej od niej odległości. Z własności tej korzystamy dla lokalizacji punktu odpowiadającego danemu układowi na wykresie. Drugą, często wykorzystywaną własnością takiego wykresu jest, że linia prosta wychodząca z danego wierzchołka w kierunku przeciwległego mu boku reprezentuje układy charakteryzujące się stałą wartością stosunku stężeń obu pozostałych składników. Stosunek stężeń (wyrażonych w procentach wagowych lub w ułamkach czy procentach molowych, zależnie od skali stężeń przyjętej przy sporządzaniu wykresu) jest taki, jak stosunek długości odcinków, na jakie dzieli ta prosta bok przeciwległy danemu wierzchołkowi.
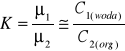
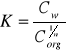
![]()
Wyszukiwarka
Podobne podstrony:
Wstęp teoretyczny 38, MATERIAŁY NA STUDIA, różne cosie
Chemia fizyczna 24, MATERIAŁY NA STUDIA, różne cosie
Sprawozdanie z fizyki W3a, MATERIAŁY NA STUDIA, różne cosie
Wnikanie ciepła, MATERIAŁY NA STUDIA, różne cosie
54 całość, MATERIAŁY NA STUDIA, różne cosie
Wykonanie ćwiczenia 23, MATERIAŁY NA STUDIA, różne cosie
Cyklon poprawiony, MATERIAŁY NA STUDIA, różne cosie
Fizyczna ściąga 1, MATERIAŁY NA STUDIA, różne cosie
OTŻ uzupełnienie, MATERIAŁY NA STUDIA, różne cosie
fizyczna 54, MATERIAŁY NA STUDIA, różne cosie
Kwas oleinowy z olejów roślinnych, MATERIAŁY NA STUDIA, różne cosie
Chemia fizyczna 24, MATERIAŁY NA STUDIA, różne cosie
test z urologiii, Pielęgniarstwo - materiały na studia, REU
powiklania po znieczuleniu ogolnym, Pielęgniarstwo - materiały na studia, IT
FUNKCJE WYCHOWAWCZE GRUPY RÓWIEŚNICZEJ, materiały na studia, I rok studiów, Psychologia
stadiarozw, materiały na studia, I rok studiów, Psychologia
więcej podobnych podstron