Nr ćwicz.: 5 |
Politechnika Radomska im. Kazimierza Pułaskiego |
Wydział MiTO |
|
Data ćwicz: .02.04.2001 |
|
|
|
Nazwisko Imię: |
Temat ćwiczenia: Wyznaczanie współczynnika podziału Nernsta i przybliżonej stałej równowagi. |
|
2000/2001 |
Zasada Sobiesław |
|
|
|
Numer grupy ćwiczeniowej |
Sprawozdanie oddano dnia |
OCENA |
Prowadzący |
X |
|
|
|
1. Cel ćwiczenia:
Celem ćwiczenia jest wyznaczenie współczynnika podziału Nernsta i przybliżonej stałej równowagi.
2. Część teoretyczna:
Ekstrakcja polega na przeprowadzeniu substancji z jednej fazy, w której jest ona zawieszona lub rozpuszczona do drugiej fazy ciekłej. Podczas kontaktu roztworu lub zawiesiny substancji w jakimś rozpuszczalniku z innym nie mieszającym się z nim rozpuszczalnikiem substancja ta dyfunduje przez granicę faz. Po ustaleniu się stanu równowagi stężenia substancji w obu fazach ( ca i cb ) są w przybliżeniu wprost proporcjonalne do stosunku rozpuszczalności substancji w tych rozpuszczalnikach ( odpowiednio ra i rb ). Współczynnikiem proporcjonalności jest tu współczynnik podziału k.
![]()
Aby ekstrakcja była jak najskuteczniejsza, korzystniej jest przeprowadzić ją wielokrotnie przy użyciu mniejszych porcji rozpuszczalnika niż jednorazowo większą jego porcją. Dobry rozpuszczalnik do ekstrakcji z roztworów wodnych powinien wykazywać duży współczynnik podziału w układzie z wodą, żle rozpuszczać się w wodzie oraz istotnie różnić się temperaturą wrzenia od substancji ekstrahowanej. Najkorzystniejsze są rozpuszczalniki o dość niskiej temperaturze wrzenia, można je wówczas bowiem łatwo oddzielić od substancji ekstrahowanej przez odparowanie lub destylację. Ponadto rozpuszczalnik taki powinien roztwory różniące się znacznie gęstością od roztworu ekstrahowanego i nie wykazywać tendencji do tworzenia emulsji, utrudniając rozdzielenie faz w rozdzielaczu. Ponieważ dyfuzja zachodzi na granicy faz, należy stosować energiczne wstrząsanie powodujące rozwinięcie powierzchni tej granicy.
Jeżeli w danym układzie temperatura jest stała (T=const.), a reakcja przebiega zgodnie z równaniem:
aA + bB ![]()
cC + dD
to po osiągnięciu stanu równowagi stężenia reagentów wyrażone w stężeniach molowych spełniają zależność:
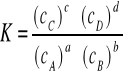
![]()
W równaniu tym stałą K nazywamy stałą równowagi reakcji. Stałej tej najczęściej używa się w przypadku rozpatrywania równowag w roztworach, a więc w układach, które najczęściej znajdują się pod stałym ciśnieniem atmosferycznym, a równocześnie zachowują stałą objętość. Zatem można stąd wysnuć wniosek, że im większa jest stała równowagi tym większe są stężenia produktów reakcji w stanie równowagi.
III. Wykonanie ćwiczenia:
Do pierwszego rozdzielacza wlewam 5 cm3 nasyconego roztworu jodu w czterochlorku węgla i 75 cm3 wody destylowanej, do drugiego 10 cm3 roztworu jodu i 50 cm3 0,1 molowego roztworu jodku potasu (KJ). Przeprowadzam ekstrakcję wstrząsając rozdzielaczami przez kilka minut i odstawiam do rozdzielenia się faz.
Następnie po rozdzieleniu się warstw z pierwszego rozdzielacza przelewam do kolbki stożkowej warstwę czterochlorkową. Stąd pobieram 2 cm3 roztworu, przelewając do zlewki dodaję 10 cm3 0,1 molowego roztworu KJ, całość wstrząsam i miareczkuję 0,1 molowym roztworem Na2S2O3 aż obie warstwy staną się całkowicie bezbarwne.
Miareczkuję także warstwę wodną z pierwszego rozdzielacza, biorąc do tego celu 50 cm3 roztworu, a pod koniec miareczkowania dodaję 1 cm3 roztworu skrobi.
Z drugiego rozdzielacza również zlewam warstwę czterochlorkową do kolbki i miareczkuję ją oraz warstwę wodną biorąc do tego celu po 5 cm3 odpowiednich roztworów przy czym podczas tego miareczkowania postępuję tak, jak w przypadku pierwszego.
IV. Wyniki:
Reakcja odbarwienia roztworu jodu przez roztwór tiosiarczanu (Na2S2O3) przebiega następująco:
![]()
![]()
Rozdzielacz pierwszy:
- do zmiareczkowania warstwy czterochlorkowej zużyłem 2,2 cm3 0,1 molowego roztworu Na2S2O3
- do zmiareczkowania warstwy wodnej zużyłem 2 cm3 0,1 molowego roztworu Na2S2O3.
Z reakcji podanej powyżej wynika, że na zmiareczkowanie jednego mola jodu potrzeba dwa mole tiosiarczanu sodu. Stąd wynika zatem, że: skoro w 1000 cm3 roztworu Na2S2O3 znajduje się 0,1 mola jonów S2O32-, to w 2,2 cm3 musi znajdować się 2,2·10-4 mola tych jonów. Zatem stężenie jodu w warstwie czterochlorkowej po ekstrakcji wynosiło dwa razy mniej tj. 1,1·10-4 mola.
Analogiczne rozumowanie przeprowadzam dla warstwy wodnej i otrzymuję, że stężenie jodu w warstwie wodnej po ekstrakcji wynosiło: 10-4 mola.
Zatem współczynnik podziału jodu pomiędzy czterochlorek węgla i wodę wynosi:
![]()
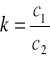
![]()
Rozdzielacz drugi:
- do zmiareczkowania warstwy czterochlorkowej zużyłem 3,8 cm3 0,1 molowego roztworu Na2S2O3
- do zmiareczkowania warstwy wodnej zużyłem 0,8 cm3 0,1 molowego roztworu Na2S2O3
W drugim rozdzielaczu będziemy mieć po ekstrakcji - 1,9·10-4 moli jonów jodkowych w warstwie czterochlorkowej
- 4·10-5 moli jonów jodkowych w warstwie wodnej.
A więc współczynnik podziału będzie wynosił:
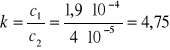
W roztworze wodnym zaszła reakcja zgodnie z równaniem:
KJ + J2 = KJ3
Reakcja ta ustaliła się na pewnym stałym poziomie i przebiegała w stałej temperaturze, a zatem możemy obliczyć dla niej stałą równowagi według wzoru podanego w części teoretycznej modyfikując go nieco. I tak oznaczając za:
![]()
- sumaryczne stężenie J2+KJ3 w warstwie wodnej
![]()
- stężenie J2 w warstwie wodnej
![]()
- początkowe stężenie jodku potasu
![]()
- współczynnik podziału jodu między wodę i czterochlorek węgla.
Jeżeli teraz podstawimy te dane do wzoru głównego będziemy mieć:
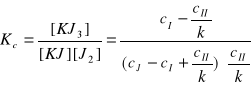
W naszym przypadku wartości te wynoszą odpowiednio:
cI = 1,6ּ10-4
cII = 1,9ּ10-4
cJ = 0,1 mol/l
k = 4,75
a więc:
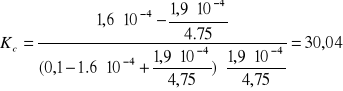
Szukasz gotowej pracy ?
To pewna droga do poważnych kłopotów.
Plagiat jest przestępstwem !
Nie ryzykuj ! Nie warto !
Powierz swoje sprawy profesjonalistom.
Wyszukiwarka
Podobne podstrony:
Bezrobocie i inflacja jako główne problemy nurtujące współczesną gospodarkę, Dokumenty, studia, nota
Wyznaczanie wspolczynnika OST, Dokumenty(1)
Współczynnik lepkości (4), Dokumenty(2)
IMRESJE WSPÓLCZESNE III, ###---DOKUMENTY---###
Współczesna typologia rodziny na podstawie, Dokumenty(1)
chazarowie - korzenie wspolczesnego zydostwa, ► Ojczyzna, Dokumenty
WSPOŁCZESNY POLSKI FILM DOKUMENTALNY, Filologia polska, polonistyka, rok III, specjalizacja filmozna
pytania+odpowiedzi, moje dokumenty, współczesne społeczeństwo polskie
Archiwistyka Rodzaje dokumentacji współczesnej
9 Ustawodawstwo polskie dot handlu ludźmi, Praca magisterska - Europeistyka - Współczesne niewolni
7. Współczynnik podziału Nernsta - zbiorcze, Zespół 1
Zadania dorosłych w procesie przygotowania człowieka do sprostania wymaganiom współczesności, Dokume
Współczynnik podziału Nernsta
Współczesne systemy polityczne - Ukraina, Dokumenty(2)
jezyk polski, DOKUMENT I PARABOLA JAKO RÓŻNE SPOSOBY MÓWIENIA O WSPÓŁCZESN, DOKUMENT I PARABOLA JAKO
Współczesna biurowość 08.11.2014 Drzewiecka, Zarządzanie dokumentacją, archiwistyka i infobrokerstwo
29. Wyznaczanie współczynnika podziału Nernsta metodą potencjometryczną, chemia fizyczna
Wyznaczanie współczynnika lepkosci cieczy, dokumenty, Fizyka
więcej podobnych podstron