Sprawozdanie z ćwiczenia nr 28: Jonity.
1. Wstęp teoretyczny:
Jako wymianę jonową możemy traktować każdą reakcję typu
A1+A2-- + B1+B2--
A1+B2-- + B1+A2--
Taka definicja obejmuje zarówno przypadki, w których oba substraty znajdują się w tej samej fazie, jak i takie, w których występują w różnych fazach. Znaczenie praktyczne ma wymiana heterogeniczna, a w szczególności na granicy faz ciało stałe - roztwór. Związek zdolny do wymiany jonowej, nierozpuszczalny w roztworze nazywamy wymieniaczem jonowym lub jonitem. Jeżeli wymieniane są kationy, wymieniacz nazywamy kationitem, jeżeli zaś aniony - anionitem. Przydatność wymieniaczy w praktyce jest uzależniona od spełnienia trzech podstawowych warunków:
1) określona masa wymieniacza winna posiadać zdolność wiązania stosunkowo dużej ilości jonów, tzn. pojemność wymieniacza winna być dostatecznie duża,
2) proces wymiany winien przebiegać dostatecznie szybko; ponieważ w procesie uczestniczy cała objętość wymieniacza, oznacza to, że szybkość dyfuzji jonów musi być znaczna,
3) wymieniacz powinien wykazywać znaczną odporność na działanie chemiczne, nie może się rozpuszczać w roztworze, w którym wymieniane są jony.
Z procesami wymiany jonowej na jonitach wiąże się szereg istotnych zjawisk i efektów:
1. Wymiana jonowa jest procesem równowagowym. Stan równowagi odpowiada wyrównaniu potencjału termodynamicznego jonów w fazie wymieniacza i w roztworze. Dla reakcji wymiany zapisanej równaniem:
A+ + BR
AR + B+ gdzie A+ i B+ oznaczają kationy wymieniane, zaś R - grupy jonowe związane ze szkieletem wymieniacza, termodynamiczna stała równowagi wyniesie
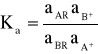
gdzie a są aktywnościami.
2. Szczególnie silnie wychwytywane są przez wymieniacz jony o wyższej wartościowości i o mniejszym efektywnym promieniu. Świadczy to, że jony związane są głównie siłami oddziaływań kulombowskich.
3. Maksymalna liczba jonów, która może być związana, uwarunkowana jest pojemnością wymieniacza. Podawana jest ona zazwyczaj w milirównoważnikach ( mval ) danych jonów na jeden gram suchego jonitu.
Proces wymiany jonowej można prowadzić bądź w warunkach statycznych, bądź dynamicznych. Proces w warunkach statycznych polega na tym, że porcję wymieniacza zadaje się określoną ilością roztworu i doprowadza się do osiągnięcia równowagi. Można przy tym stosować intensywne mieszanie.
Kinetykę reakcji wymiany jonowej można wówczas opisać równaniem kinetycznym, które przypomina kinetykę prostych reakcji II rzędu.
k = 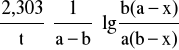
gdzie x - ubytek stężenia jonu A lub B po czasie t w roztworze, a - początkowe stężenie jonów A, b - stężenie jonów B w stanie równowagi.
W procesie dynamicznym wymieniacz umieszcza się w kolumnie jako fazę nieruchomą, natomiast roztwór przepuszcza się przez kolumnę z określoną szybkością. Ilościowy opis procesu jest analogiczny do chromatografii kolumnowej, procesów ciągłej ekstrakcji. Szybkość wymiany można opisać równaniem kinetycznym
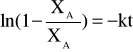
gdzie XA oznacza ułamek molowy wymienionych w wymieniaczu jonów, a XA![]()
odnosi się do stanu równowagi.
Wzór powyższy jest uzasadniony dla przypadku, gdy o szybkości procesu decyduje dyfuzja jonów, a skład roztworu, jako fazy ruchomej, nie ulega zmianie.
2. Opracowanie wyników:
nr |
Objętość wykieku V [cm3] |
pH wycieku |
nr |
Objętość wykieku V [cm3] |
pH wycieku |
1 |
0 |
5,67 |
9 |
160 |
5,25 |
2 |
20 |
5,02 |
10 |
180 |
5,52 |
3 |
40 |
3,33 |
11 |
200 |
5,73 |
4 |
60 |
3,14 |
12 |
220 |
6,17 |
5 |
80 |
3,04 |
13 |
240 |
6,38 |
6 |
100 |
2,92 |
14 |
260 |
6,42 |
7 |
120 |
3,50 |
15 |
280 |
6,43 |
8 |
140 |
4,95 |
16 |
|
|
Z powyższej tabeli wyznaczam wykres zależności pH = f(V). Krzywa wymiany jonowej przypominająca miareczkowanie alkacydymetryczne jest symetryczna względem punktu odpowiadającego pochodnej 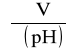
. Odczytując położenie tego punktu na osi objętości otrzymuję objętość Vn roztworu do osiągnięcia „inwersji” (maksimum pochodnej; Vn = 134,62 [cm3]).
Obliczam maksymalny błąd bezwzględny wyznaczania Vn:
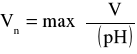
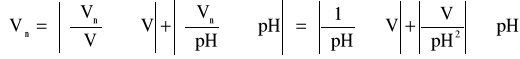
gdzie: ∂V = 20 cm3; ∂pH = 1,45; ∂V = 1 cm3; ∂pH = 0,01
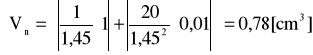
![]()
Wyznaczam pojemność jonitu oraz obliczam maksymalny błąd bezwzględny wyznaczania pojemności jonitu:
Aby obliczyć pojemność jonitu należy stężenie molowe przeliczyć na stężenie wyrażone w val/dm3
![]()
z tej zależności wynika, że stężenie molowe 0,5 molowego roztworu soli K2SO4 wyrażone w val/dm3 wynosi 1.
Pojemność jonitu:
![]()
Maksymalny błąd pojemności jonitu:
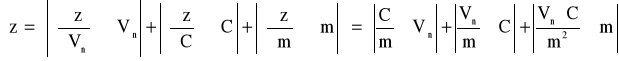
gdzie: C = 1 [val/dm3]; m = 30 [g]; Vn = 0,13462 [dm3]; C = 0,1 [val/dm3]; m = 1 [g]; Vn = 0,78*10-3 [dm3]
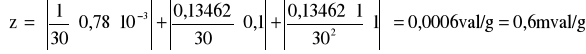
![]()
Pojemność literaturowa jonitu „Zerolit” wynosi 4,5 [mval/g] (według J. Minczewski, Z. Marczenko - „Chemia analityczna”) z tego wynika, że wartość wyznaczona pokrywa się z wartością literaturową.
4. Wnioski:
Cel ćwiczenia (wyznaczenie pojemności jonitu metodą dynamiczną) został osiągnięty. Wartość pojemności jonitu wyznaczona przeze mnie nie obarczona jest błędem.
3
Wyszukiwarka
Podobne podstrony:
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
HCOOH, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Diagram fazowy Gibbsa, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Entropia mieszania, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Badanie lepkości cieczy metodą Hopplera, studia, chemia, chemia fizyczna, sprawozdania, sprawka
izoterma adsorbcji, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Stała szybkości reakcji jodowania acetonu, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Energia aktywacji przepływu lepkiego, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Ciepło rozpuszczania soli jonowej, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Kinetyka reakcji elektroutlenienia 1-propanolu, studia, chemia, chemia fizyczna, sprawozdania, spraw
Elektronowe widma absorpcyjne, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Dyspersja współczynnika załamania światła, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HCl i HJ, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Izoterma adsorpcji 1, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HCl, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HJ, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Grupy symetrii, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Entalpia parowania, studia, chemia, chemia fizyczna, sprawozdania, sprawka
ester KK, studia, chemia, chemia fizyczna, sprawozdania, sprawka
więcej podobnych podstron