Ćwiczenie nr 22
WYZNACZANIE SZYBKOŚCI HYDRATACJI BEZWODNIKA OCTOWEGO Z POMIARÓW PRZEWODNICTWA
Aparatura i szkło: Odczynniki:
Konduktometr, termostat, stoper, bezwodnik kwasu octowego
Kolbka miarowa o poj. 100 cm3,
Probówka o poj. 100 cm3
WYKONANIE ĆWICZENIA:
Ustawić termostat na temperaturę 20 oC (± 0,2 oC).
Przygotować zestaw do pomiaru przewodnictwa.
Do kolby miarowej wlać 12 cm3 bezwodnika octowego i uzupełnić wodą destylowaną do kreski. W momencie dodawania wody włączyć stoper i nie wyłączać aż do końca pomiarów (do ustalenia się wartości przewodnictwa). Rozpuszczać bezwodnik octowy w wodzie, silnie mieszając.
Wyznaczyć stoperem czas początku i końca rozcieńczania ( podczas dodawania wody pojawia się granica rozdziału dwóch faz, a po wstrząśnięciu, zmętnienie - - moment zniknięcia zmętnienia uznać za koniec rozcieńczania). Czas średni przyjąć za moment początku reakcji.
Naczynie (probówkę) z elektrodą umieścić w termostacie, wlać otrzymany roztwór i mierzyć przewodnictwo, początkowo częściej (trzy pomiary co 30 s, ok. 10 co 1 min), następnie jeden pomiar po upływie 5 min i jeden po 1 godz. (od początku reakcji). Stałość wskazań konduktometru oznacza koniec reakcji.
Wykonać analogiczne pomiary (punkty 2 - 5) w temperaturze 40 oC.
Wyniki zestawić w tabeli:
Nr |
T
[oC] |
Czas od początku reakcji, τ [s] |
|
|
log( |
log |
K |
|
|
|
|
|
|
|
|
OPRACOWANIE WYNIKÓW:
Reakcja hydratacji bezwodnika octowego jest reakcją pierwszego rzędu, dlatego obliczenia należy przeprowadzić w oparciu o równanie:
k = ![]()
ln ![]()
= ![]()
ln ![]()
(1)
gdzie: co - początkowe stężenie bezwodnika octowego,
cx - stężenie powstającego kwasu octowego,
τ - czas.
Wzrost przewodnictwa w czasie jest proporcjonalny do stężenie powstającego kwasu octowego. Ilość powstającego kwasu octowego proporcjonalna jest do ilości użytego bezwodnika octowego:
(CH3CO)2O + H2O = 2CH3COOH,
dlatego wzrost przewodnictwa w czasie trwania reakcji będzie proporcjonalny do początkowego stężenia kwasu octowego. Znając przewodnictwo roztworu w momencie początkowym κo , w danym momencie κτ i po czasie κ∞ mamy:
co = const (κ∞ - κo) (2)
(co - cx) = const(κ∞ - κo) - const(κτ - κo) = const(κ∞ - κo - κ∞ + κo) = const(κ∞ - κτ),
gdzie: κo - przewodnictwo właściwe roztworu w momencie zainicjowania reakcji,
κo - przewodnictwo właściwe roztworu po upływie czasu τ,
κ∞ - przewodnictwo właściwe po zakończeniu reakcji.
Z równań (1) i (2) wynika, że:
k = ![]()
ln![]()
= ![]()
ln 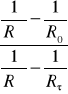
(3)
Przewodnictwo roztworu 1/R, w momencie rozpoczęcia reakcji, wyznacza się z ekstrapolacji zależności: ln(1/R∞ - 1/Rτ) = f(τ). Dla reakcji pierwszego rzędu wykres takiej zależności jest linią prostą. Wyliczyć stałe szybkości dla każdego τ oraz obliczyć kśr. i porównać jej wartość z wartością otrzymaną z wykresu (tangens kąta nachylenia prostej).
Znając wartości stałej szybkości w dwóch temperaturach, z równania:
ln ![]()
= ![]()
(![]()
) (4)
obliczyć energię aktywacji E tej reakcji, a z równania:
k = A e-E/RT (5)
obliczyć wartość stałej A.
Wyszukiwarka
Podobne podstrony:
Ćw. 17, chemia fizyczna, Nowy folder
Ćw. 20, chemia fizyczna, Nowy folder
Ćw. 29, chemia fizyczna, Nowy folder
Ćw. 16, chemia fizyczna, Nowy folder
Ćw. 14, chemia fizyczna, Nowy folder
Ćw. 13, chemia fizyczna, Nowy folder
Ćw. 21, chemia fizyczna, Nowy folder
Ćw. 31, chemia fizyczna, Nowy folder
Ćw. 30, chemia fizyczna, Nowy folder
Ćw. 25, chemia fizyczna, Nowy folder
Ćw. 11, chemia fizyczna, Nowy folder
Ćw. 12, chemia fizyczna, Nowy folder
Ćw. 27, chemia fizyczna, Nowy folder
Ćw. 18, chemia fizyczna, Nowy folder
Ćw. 23, chemia fizyczna, Nowy folder
Ćw. 28, chemia fizyczna, Nowy folder
Ćw. 10, chemia fizyczna, Nowy folder
Ćw. 5, chemia fizyczna, Nowy folder
Ćw. 6, chemia fizyczna, Nowy folder
więcej podobnych podstron