+Badanie aktywności wybranych oksydoreduktaz
Łańcuch oddechowy jest jednym z głównych źródeł reaktywnych form tlenu (jak anionorodnik ponadtlenkowy - O2-Ⴗ, nadtlenek wodoru - H2O2, czy rodnik hydroksylowy - OHႷ ). Ponieważ powstawanie reaktywnych form tlenu jest procesem nieuniknionym i zachodzącym w warunkach fizjologicznych we wszystkich komórkach aerobowych, organizmy aerobowe wykształciły system obrony, aby uniknąć toksycznych skutków metabolizmu tlenowego. W skład tego systemu wchodzi zarówno układ enzymatyczny, jak i cały szereg niskocząsteczkowych związków o działaniu antyoksydacyjnym (jak glutation - GSH, witaminy A, C, E, melatonina itd.). Enzymatyczny układ antyoksydacyjny człowieka składa się z kilku enzymów współdziałających ze sobą w celu zneutralizowania reaktywnych form tlenu, zanim dojdzie do uszkodzenia ważnych struktur komórkowych. Do enzymów tych należą:
dysmutaza ponadtlenkowa (SOD; EC 1.15.1.1):
O2-Ⴗ + O2-Ⴗ + 2 H+ H2O2 + O2
katalaza (CAT; EC 1.11.1.6):
H2O2 + H2O2 2H2O + O2
peroksydaza glutationowa (GSH-Px; EC 1.11.1.9):
H2O2 + 2GSH H2O + H2O + GSSG
lub
ROOH + 2GSH ROH + H2O + GSSG
reduktaza glutationowa (GR; EC 1.6.4.2):
GSSG + NADPH + H+ 2GSH + NADP+
Pierwszym enzymem obrony antyoksydacyjnej organizmu jest dysmutaza ponadtlenkowa, przekształcająca w reakcji dysmutacji anionorodnik ponadtlenkowy w mniej toksyczny dla komórki nadtlenek wodoru i cząsteczkę O2. W organizmie człowieka znajdują się trzy rodzaje SOD: dwa enzymy zawierające w cząsteczce miedź i cynk: cytozolowy (Cu,ZnSOD) i pozakomórkowy (EC-SOD), oraz enzym zawierający w cząsteczce mangan (MnSOD), występujący w matrix mitochondrialnym. SOD, współpracując z CAT i GSH-Px, które z kolei rozkładają H2O2, zapobiega powstawaniu najgroźniejszego dla organizmu rodnika hydroksylowego - OHႷ.
Katalaza przeprowadza reakcję dysmutacji nadtlenku wodoru do cząsteczki H2O i O2. Enzym ten jest obecny we wszystkich tkankach i narządach; jest metaloproteiną, zawierającą w swojej cząsteczce żelazo - w centrum aktywnym posiada ugrupowanie hemowe.
Peroksydazy glutationowe katalizują redukcję nadtlenku wodoru, a także ponadtlenków organicznych (ROOH) przy udziale zredukowanego glutationu (GSH), który w reakcji ulega utlenieniu do diglutationu (GSSG). Peroksydazy glutationowe są selenobiałkami, zawierają bowiem w swoim centrum aktywnym aminokwas - selenocysteinę.
Reduktaza glutationowa katalizuje redukcję utlenionego glutationu, który powstaje w wielu różnych reakcjach enzymatycznych. Enzym zawiera silnie związaną cząsteczkę FAD w centrum aktywnym - GR jest flawoenzymem, zużywającym NADPH do redukcji GSSG.
Laboratorium 11 Ł A Ń C U C H O D D E C H O W Y I
U K Ł A D A N T Y O K S Y D A C Y J N Y
Ćwiczenie 1: Wykrywanie aktywności oksydazy cytochromowej
Zasada:
Występowanie oksydazy cytochromowej w tkankach można wykazać przy pomocy reakcji z odczynnikiem NADI (p-fenylenodiamina z α-naftolem, zmieszane w stosunku 1:1). W obecności oksydazy cytochromowej zachodzi utlenienie p-fenylenodiaminy - powstaje fioletowa barwa roztworu.
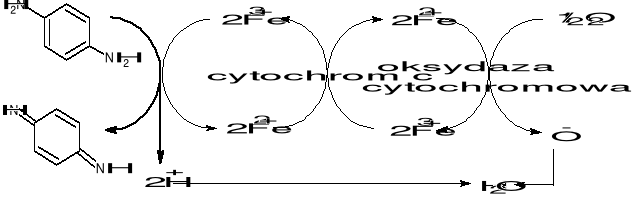
Wykonanie:
Bezpośrednio przed użyciem przygotuj odczynnik NADI, mieszając p-fenylenodiaminę z α-naftolem w stosunku 1:1 (1 mL + 1 mL).
Do 4 probówek odmierz podane w tabelce objętości poszczególnych roztworów.
Zawartość probówki nr 4 przed dodaniem NADI należy zagotować (wstawić na 5 min. do wrzącej łaźni wodnej), a następnie ostudzić!
probówka nr |
wyciąg z ziemniaka [mL] |
0,1 M bufor fosforanowy pH 7,4 [mL] |
woda dest. [mL] |
roztwór NaCN |
NADI [mL] |
1 |
2,0 |
2,0 |
0 |
0 |
0,2 |
2 |
2,0 |
2,0 |
0 |
3 krople |
0,2 |
3 |
2,0 |
2,0 |
0,2 |
0 |
0 |
4 |
2,0 |
2,0 |
0 |
0 |
0,2 |
|
zagotuj i ostudź |
|
|
|
|
UWAGA: NaCN to silna trucizna!
Zawartość probówek wymieszaj starannie i zostaw w temperaturze pokojowej na 20 min.
Zaobserwuj i zanotuj wyniki doświadczenia oraz sformułuj wnioski.
Ćwiczenie 2: Wykrywanie aktywności katalazy
Zasada:
Tlen, powstający w wyniku rozkładu nadtlenku wodoru przez katalazę, wydziela się z roztworu powodując jego silne pienienie.
Wykonanie:
Do 3 probówek dodaj podane w tabelce objętości poszczególnych roztworów.
Zawartość probówki nr 3 przed dodaniem H2O2 należy zagotować (wstawić na 5 min. do wrzącej łaźni wodnej), a następnie ostudzić!
probówka nr |
hemolizat [mL] |
0,1 M bufor fosforanowy pH 7,4 [mL] |
roztwór NaCN |
3% roztwór nadtlenku wodoru |
1 |
0,1 |
2,0 |
0 |
10 kropli |
2 |
0,1 |
2,0 |
3 krople |
10 kropli |
3 |
0,1 |
2,0 |
0 |
10 kropli |
|
zagotuj i ostudź |
|
|
|
UWAGA! NaCN to silna trucizna!
Zaobserwuj i zanotuj wyniki doświadczenia oraz sformułuj wnioski.
Ćwiczenie 3: Oznaczanie aktywności peroksydazy glutationowej
Zasada:
Metoda jest oparta na reakcji przebiegającej w dwóch etapach. W etapie I peroksydaza glutationowa (GSH-Px) reaguje z nadtlenkiem tert-butylu (t-BOOH) i zredukowanym glutationem (GSH), w wyniku czego GSH ulega utlenieniu do formy GSSG. Etap drugi polega na redukcji GSSG do GSH przez enzym - reduktazę glutationową (GR) - przy udziale NADPH+H+ jako reduktora. Utlenianie NADPH+H+ powoduje spadek absorbancji przy długości fali 340 nm, co jest mierzone spektrofotometrycznie. Aktywność GSH-Px oblicza się na podstawie ubytku zredukowanej formy koenzymu w czasie (sprzężony test Warburga).
reakcja 1: t-BOOH + 2 GSH t-BOH + GSSG
reakcja 2: GSSG + NADPH + H+ 2 GSH + NADP+
Wykonanie:
1. Wykonaj próbę odczynnikową - do kuwety dodaj kolejno:
1200 μL buforu fosforanowego o pH 7,0, zawierającego 5 mM EDTA
50 μL wody dest.
100 μL roztworu GSH
100 μL roztworu NADPH
5 μL roztworu GR
Po wymieszaniu próbę inkubuj przez 5 min. w temp. pokojowej. Następnie dodaj 50 μL roztworu t-BOOH, znowu wymieszaj i mierz zmiany absorbancji co minutę przez 5 min. przy długości fali λ = 340 nm. Pomiary wykonuj względem buforu fosforanowego (próba ślepa).
2. Wykonaj próbę badaną - do kuwety dodaj kolejno:
1200 μL buforu fosforanowego o pH 7,0, zawierającego 5 mM EDTA
50 μL osocza
100 μL roztworu GSH
100 μL roztworu NADPH
5 μL roztworu GR
Po wymieszaniu próbę inkubuj przez 5 min. w temp. pokojowej. Następnie dodaj 50 μL roztworu t-BOOH, znowu wymieszaj i mierz zmiany absorbancji co minutę przez 5 min. przy długości fali λ = 340 nm. Pomiary wykonuj względem buforu fosforanowego (próba ślepa).
3. Oblicz aktywność peroksydazy glutationowej w osoczu, korzystając z poniższego wzoru:
GSH-Px [U/L] = (Δ A - Δ Aodcz) × 4839
Δ A - średnia zmiana absorbancji próby badanej na minutę
Δ Aodcz - średnia zmiana absorbancji próby odczynnikowej na minutę
4839 - współczynnik kalibracji, uwzględniający objętość mieszaniny inkubacyjnej, molowy współczynnik absorbancji i przeliczenie jednostek na wymagane w międzynarodowej jednostce enzymatycznej
ĆWICZENIE 4. Oznaczanie aktywności ceruloplazminy metodą Ravina.
Ceruloplazmina (Cp) jest miedzioproteiną wykazującą aktywność oksydoreduktazy żelazo (II): O2. Enzym ten katalizuje przenoszenie 4 elektronów na cząsteczkę O2, przy czym powstaje bezpośrednio cząsteczka H2O. Cp jest główną oksydazą występującą w osoczu krwi i jej fizjologicznymi substratami w organizmie są adrenalina, noradrenalina, dihydroksyfenyloalanina i kwas askorbinowy. Cp wykazuje aktywność ferrooksydazy, katalizującej utlenianie żelaza w organizmie.
Zasada:
Dobrym substratem dla ceruloplazminy jest p-fenylenodiamina (PPD). W pierwszym etapie reakcji powstaje kompleks enzym-substrat dzięki połączeniu miedzi enzymu z elektonami π pierścienia aromatycznego PPD. Następnie dochodzi do przeniesienia elektronów z substratu na enzym, przy czym Cu (II) zostaje zredukowana do Cu (I), a z PPD powstaje wolny rodnik. Cu (I) w Cp jest utleniana przez tlen, a rodnik powstały z PPD ulega dalszym przemianom, tworząc barwny fioletowy produkt, utworzony z 3 cząsteczek substratu (zasada Bandrowskiego).
Wykonanie:
1. Przygotuj 2 ponumerowane probówki i postępuj zgodnie z poniższą tabelą:
|
próba badana |
próba kontrolna |
1. |
dodaj po 4 mL buforu octanowego o pH 5,5 |
|
2. |
preinkubuj przez 15 min. w łaźni wodnej o temp. 37°C |
|
3. |
- |
dodaj 0,5 mL 0,5% azydku sodu (NaN2) |
4. |
dodaj po 50 μL surowicy |
|
5. |
dodaj po 0,5 mL 0,5% roztworu PPD, dokładnie wymieszaj |
|
6. |
inkubuj przez 60 min. w łaźni wodnej o temp. 37°C |
|
7. |
dodaj 0,5 mL 0,5% azydku sodu, dokładnie wymieszaj |
- |
2. Zmierz absorbancję próby badanej przy długości fali λ = 530 nm względem próby kontrolnej (próba ślepa).
3. Oblicz aktywność ceruloplazminy według wzoru:
Cp [U/L] = A530nm ×2644
2644 - współczynnik kalibracji, uwzględniający objętość mieszaniny inkubacyjnej, molowy współczynnik absorbancji i przeliczenie jednostek na wymagane w międzynarodowej jednostce enzymatycznej
GR
GSH-Px
GSH-Px
CAT
SOD
peroksydaza
glutationowa
reduktaza
glutationowa
Wyszukiwarka
Podobne podstrony:
Laboratorium 9 DISACHARYDY, II rok, II rok CM UMK, Biochemia
Laboratorium 8 MONOSACHARYDY, II rok, II rok CM UMK, Biochemia
Laboratorium 12 LIPIDY, II rok, II rok CM UMK, Biochemia
Seminarium 2 dr Czuczejko, II rok, II rok CM UMK, Biochemia
Kwas hialuronowy, II rok, II rok CM UMK, Biochemia
Chromatografia-zelowa, II rok, II rok CM UMK, Biochemia
Ustny - zbiór, II rok, II rok CM UMK, Biochemia
Pierwiastki śladowe, II rok, II rok CM UMK, Biochemia
Rozkład kolokwiów, II rok, II rok CM UMK, Biochemia
Koenzymy[1], II rok, II rok CM UMK, Biochemia
Seminarium 2 dr Czuczejko, II rok, II rok CM UMK, Biochemia
Laboratorium 11 OKSYDOREDUKTAZY, II rok, II rok CM UMK, Giełdy, od Joe, biochemia
Laboratorium 18, II rok, II rok CM UMK, Giełdy, od Joe, biochemia
iii rok lekarski 11 12, II rok, II rok CM UMK, Giełdy, od Joe, FIZJOLOGIA, EGZAMIN
Laboratorium 4 CHROMATOGRAFIAI, II rok, II rok CM UMK, Giełdy, 2 rok, II rok, biochemia
Laboratorium 2 BIALKA, II rok, II rok CM UMK, Giełdy, 2 rok, biochemia, koło 1
więcej podobnych podstron