1. Posługując się energią dysocjacji wiązań oblicz, która z poniższych reakcji jest endo, a która egzotermiczna (energia dysocjacji wiązań w kJ/mol: C-OH = 380, C-F = 451,
C-Cl = 340, H-F = 568, H-OH = 497, H-Cl = 431). (3)
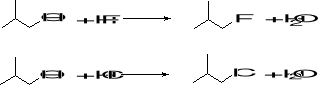
2. Oblicz, która ze stron jest faworyzowana w poniższej reakcji (3):
BDE (wkJ/mol): C-C 347 C=C 610 C-O 357 C-H 414 O-H 462
3. Która ze stron uprzywilejowana jest w hydratacji poniższego aldehydu? (3)
BDE w kJ/mol: C=O 736 C-O 376 O-H (H2O) 491 O-H (C) 462
4. Oblicz Ho dla poniższych reakcji i określ czy są one egzo- czy endotermiczne (energia dysocjacji wiązań w kJ/mol: C=C 265 H-H 435 C-H 410 O-H 464 C=O 377. (4)
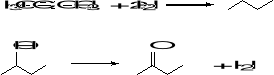
5. Która ze stron jest uprzywilejowana w hydratacji poniższego ketonu (3):
BDE w kJ/mol: C=O 748 C-O 376 O-H(H2O) 491 O-H (C) 462
6. Na podstawie reakcji fluoru z propenem wyjaśnij dlaczego reakcja przyłączania fluoru do alkenów nie jest wykorzystywana do syntezy fluorowęglowodorów. (3)
BDE w kJ/mol: C=C 610 C-C 347 F-F 150 C-F 448
Reakcja zbyt silnie egzotermiczna.
7. Wykorzystując energię dysocjacji wiązań oblicz Ho dla następujących reakcji (energia dysocjacji wiązań w kJ/mol: C=C = 265, C-C = 356, H-H = 435, C-Hetan/propan = 410,
C-Hmetan = 435). Mimo podobnego znaku Ho jedna z tych reakcji praktycznie nie ma zastosowania. Podaj możliwą przyczynę. (4)
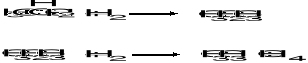
Zbyt wysoka energia aktywacji. Nie zachodzi nawet z katalizatorem.
8. Poniższa reakcja nie zachodzi mimo korzystnej Ho (oblicz ile ona wynosi; BDE w kJ/mol: Car-H 460 Car-C 420 C-Cl 351 H-Cl 431). (2) Wyjaśnij dlaczego. (1) Co można zrobić, aby przebiegła w kierunku produktu. (1)
Zbyt wysoka energia aktywacji. Trzeba dodać katalizator.
9. Jakie będą główne produkty wolnorodnikowego bromowania następujących związków: (3)
a. etylobenzen
b. 2,2,3-trimetylobutan
c. heksan
Pamiętaj, że ta reakcja jest selektywna: w jej przebiegu związkiem przejściowym jest zawsze najbardziej trwały rodnik.
11. Dlaczego energia dysocjacji wiązania PhCH2-H (322 kJ/mol) jest znacząco niższa od energii dysocjacji wiązania CH3-H (426 kJ/mol). (2)
Bo powstaje silnie zdelokalizowany rodnik.
12. Narysuj wykres energetyczny dwuetapowej reakcji endotermicznej, w której etap drugi decyduje o szybkości reakcji. Zaznacz na wykresie stan przejściowy i związek przejściowy. (3) Co to jest energia aktywacji? (1)
13. Dlaczego reakcje, w których związkiem przejściowym jest karbokation prowadzą do mieszanin racemicznych, mimo że substratem jest związek chiralny (wskazówka: weź pod uwagę strukturę karbokationu). (3)
Karbokation ma płaską strukturę i istnieje jednakowe prawdopodobieństwo przyłączenia się reagenta z każdej strony karbokationu.
14. Wyjaśnij, który z poniższych karbokationów jest bardziej trwały. (2)
Drugi, bo trzeciorzędowy.
15. Mechanizm SN1 dla syntezy chlorku tert-butylu z alkoholu tert-butylowego przedstawiono poniżej. Narysuj wykres energetyczny tej reakcji wskazując gdzie na wykresie znajdują się stany przejściowe i związki przejściowe tworzące się podczas tej reakcji. (3) Uwaga: reakcja jest egzotermiczna!
Wyszukiwarka
Podobne podstrony:
semquiz 09-4 answers, 1
semquiz 09 3 196, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
eim2 09 answers
eim3 09 answer
semquiz 09-6a, 1
semquiz 09-6a, 1
semquiz 09 2 130, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
semquiz 09-6, 1
semquiz 09-3, 1
semquiz 09 3 196, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
eim2 09 answers
eim3 09 answer
EF3e int filetest 09 answerkey
09 COMPARE GROUPS answers
25)21 09 To? questions and short answers Va
22)20 09 Present continuous questions and answers IVa
więcej podobnych podstron