1. Dlaczego etery są silniejszymi zasadami od ketonów? (2)
Bo w eterach wolna para elektronowa na orbitalu sp3 tlenu, dalej od jądra (łatwiej dostępna), a w ketonach na sp2, trudniej dostępna dla elektrofili.
2. Dlaczego trifluorek boru (BF3) jest silniejszym kwasem Lewisa od trimetyloboranu [(CH3O)3B]? (3)
Fluor silnie elektroujemny, znacząco mocniej pogłębia deficyt gęstości elektronowej na borze od CH3O.
3. Dlaczego piperydyna jest znacznie silniejszą zasadą od pirydyny? (3)
W piperydynie wolna para elektronowa na azocie na orbitalu sp3, dalej od jądra, łatwiej dostępna.
4. Wyjaśnij dlaczego tetrametyloguanidyna jest znacznie silniejszą zasadą (pKaH ≈ 12) od N,N-dimetyloacetamidu (pKaH ≈ -0.5). (3)
5. Dlaczego kwas pikrynowy (2,4,6-trinitrofenol) powoduje uwolnienie CO2 z wodnego roztworu Na2CO3, a fenol nie? (2)
Ponieważ grupy nitrowe w pozycjach orto i para uczestniczą w delokalizacji gęstości elektronowej w efekcie indukcyjnym i rezonansowym, co zwiększa trwałość (obniża zasadowość) sprzężonej z kwasem pikrynowym zasady.
6. Uszereguj poniższe związki według wzrastającej kwasowości, biorąc pod uwagę zaznaczone protony w poniższych związkach (3):
C < B < A < D
7. Który, bądź które, z protonów są najbardziej kwasowe w poniższych strukturach: (3)
8. Dlaczego o-chloroanilina jest słabszą zasadą od p-chloroaniliny? (2)
Bo chlor w pozycji orto odciąga silniej w efekcie indukcyjnym wolną parę elektronową azotu niż chlor w pozycji para.
9. Ustaw poniższe związki w kolejności od najsłabszego do najsilniejszego kwasu biorąc pod uwagę zaznaczone atomy wodoru. Podaj uzasadnienie. (3)
A < C < B < D
10. Dlaczego kwas p-toluenosulfonowy (pKa ≈ -6) jest znacznie silniejszym kwasem od kwasu p-metylobenzoesowego (pKa ≈ 5)? (2)
Z powodu lepszej delokalizacji elektronów w sprzężonej zasadzie kwasu p- toluenosulfonowego.
11. W każdej z poniższych cząsteczek określ, który z wodorów jest najbardziej kwasowy. (2)
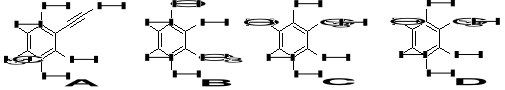
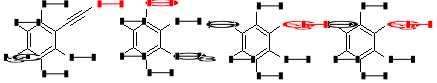
12. Ustaw w kolejności od najsłabszego do najsilniejszego kwasu poniższe związki, biorąc pod uwagę zaznaczone atomy wodoru. Podaj uzasadnienie. (3)
D < A < B < C
Przyczyną efekt indukcyjny halogenów.
13. Wartości pKa dla aminokwasu cysteiny wynoszą 1.8, 8.3 i 10.8. Przypisz te wartości grupom funkcyjnym cysteiny. (3)
14. Zidentyfikuj najbardziej kwasowy proton w poniższych związkach. (3)
a. 3-pentanon
b. 1,1,1-trifluoropropan
c. 4-chlorobutanol
15. W jaki sposób rozdzielisz naftalen, N,N-dimetyloanilinę [PhN(CH3)2] i kwas benzoesowy (PhCOOH) wykorzystując ich właściwości kwasowo-zasadowe? (2)
N,N-dimetyloanilinę wyekstrahować rozcieńczonym roztworem kwasu, kwas benzoesowy roztworem zasady; pozostaje nierozpuszczalny w tych solwentach naftalen.
16. Wskaż i uzasadnij który ze związków w parach jest słabszą zasadą. (3)
a. p-Nitroanilina bo grupa nitrowa odciąga parę elektronową z azotu aminowego e efekcie indukcyjnym i mezomerycznym.
b. Pierwszy, bo ładunek silniej zdelokalizowany.
c. Jon hydroksylowy, bo para elektronowa bliżej jądra silniej elektroujemnego tlenu (gorzej dostępna dla elektrofili).
Wyszukiwarka
Podobne podstrony:
semquiz 09-5 answers, 1
semquiz 09 3 196, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
eim2 09 answers
eim3 09 answer
semquiz 09-6a, 1
semquiz 09-6a, 1
semquiz 09 2 130, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
semquiz 09-6, 1
semquiz 09-3, 1
semquiz 09 3 196, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
eim2 09 answers
eim3 09 answer
EF3e int filetest 09 answerkey
09 COMPARE GROUPS answers
25)21 09 To? questions and short answers Va
22)20 09 Present continuous questions and answers IVa
więcej podobnych podstron