Michał Kwiatkowski
RÓWNOWAGI FAZOWE W UKŁADACH TRÓJSKŁADNIKOWYCH TYPU CIECZ-CIECZ
Celem ćwiczenia jest wyznaczenie krzywej binodalnej (izotermy) rozpuszczalności układu trójskładnikowego: woda-toluen-aceton i woda-toluen-propanol.
APARATURA:
Biureta cyfrowa o pojemności 25 cm3
Pipety miarowe o pojemności 10 cm3 - 3 sztuki
Pipety miarowe o pojemności 2 cm3 - 3 sztuki
Probówki z doszlifowanymi korkami - 16 sztuk
Pompka
ODCZYNNIKI:
toluen
aceton
propanol
woda destylowana
Skład mieszanin trójskładnikowych podajemy za pomocą trójkąta Gibbsa. Trójkąt ten jest
trójkątem równobocznym ,którego trzy wierzchołki odpowiadają czystym składnikom A,B,C, boki układom dwuskładnikowym A-B,B-C,A-C, natomiast cała powierzchnia układowi trójskładnikowemu A-B-C. Aby znaleźć zawartość poszczególnych składników w układzie ,którego skład odpowiada punktowi D wewnątrz trójkąta ,kreślimy z tego punktu odcinki aD,bD,cD ,które są równoległe do każdego z boków.
Znając te odcinki i długość boku trójkąta można określić zawartość poszczególnych składników za pomocą zależności: A=aD/AB ,B=bD/AB ,C=cD/AB.
D
Na wzajemną mieszlność cieczy ma wpływ temperatura. Na ogół wzajemna mieszalność cieczy rośnie wraz ze wzrostem temperatury jednak zdarzają się takie układy ,których mieszalność maleje ze wzrostem temperatury.
Diagram równowagi ciecz-ciecz układu zawierającego jedną parę częściowo
mieszalną tworzy trójkąt ,który podzielony jest na dwa obszary przez krzywą binodalną. Krzywa ta cały układ rozkłada na dwa obszary -I ,który odpowiada układowi jednofazowemu i obszar -II odpowiadający układowi dwufazowemu.
I
II
PRZEBIEG DOŚWIADCZENIA:
Sporządzamy dwuskładnikowe roztwory toluen-aceton i toluen-propanol o różnych stężeniach, odmierzając pipetami do probówek toluen, aceton i propanol w ilościach podanych w poniższych tabelach.
Następnie miareczkujemy otrzymane roztwory wodą destylowaną do pierwszego trwałego zmętnienia przy pomocy biurety cyfrowej. Tym sposobem otrzymujemy po 7 trójskładnikowych mieszanin dla acetonu i propanolu leżących na izotermie rozpuszczalności to znaczy izotermie przejścia z układu jednofazowego do dwufazowego.
Stężenia poszczególnych składników wyrażam w procentach objętościowych
korzystając ze wzoru:
V1 = V1. 100% / (Vc) gdzie: Vc = V1+V2+V3 (objętość mieszaniny)
V1-zawartość 1 składnika
V2-zawartość 2 składnika
V3-zawartość 3 składnika
Wykonam przykładowe obliczenia dla:
V(toluenu)=9cm3 V(aceton)=1cm3 V(wody)=0,16cm3
V(toluenu)= (9cm3 /10,16cm3) . 100% =88,6%
Pozostałe wyniki umieszczam w poniższych tabelach:
Nr probówki |
Toluen |
Aceton |
Woda |
|||
|
ml |
% v/v |
ml |
% v/v |
ml |
% v/v |
I |
9 |
88,6 |
1 |
9,8 |
0,16 |
1,6 |
II |
8 |
79,6 |
2 |
19,6 |
0,18 |
1,8 |
III |
6 |
58,8 |
4 |
39,2 |
0,20 |
2,0 |
IV |
4 |
38,5 |
6 |
57,8 |
0,38 |
3,7 |
V |
2 |
17,1 |
8 |
68,5 |
1,68 |
14,4 |
VI |
1 |
6,9 |
9 |
61,7 |
4,58 |
31,4 |
VII |
0,5 |
2,9 |
9,5 |
53,8 |
7,65 |
43,3 |
Nr probówki |
Toluen |
Propanol |
Woda |
|||
|
ml |
% v/v |
ml |
% v/v |
ml |
% v/v |
I |
9 |
88,5 |
1 |
9,8 |
0,17 |
1,7 |
II |
8 |
78,2 |
2 |
19,6 |
0,23 |
2,2 |
III |
6 |
56,8 |
4 |
37,8 |
0,57 |
5,4 |
IV |
4 |
35,5 |
6 |
53,2 |
1,28 |
11,3 |
V |
2 |
14,8 |
8 |
59,1 |
3,54 |
26,1 |
VI |
1 |
4,5 |
9 |
40,3 |
12,33 |
55,2 |
VII |
0,5 |
1,5 |
9,5 |
30,4 |
21,3 |
68,1 |
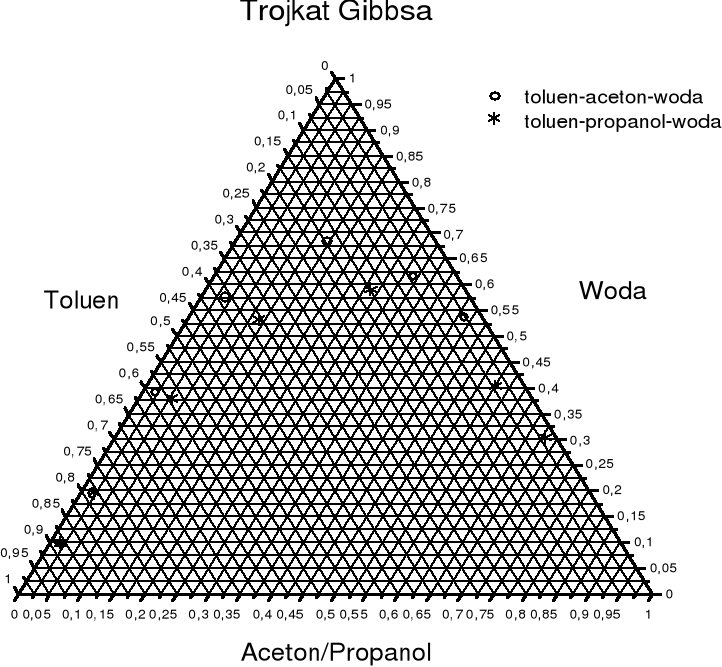
WNIOSKI:
Z ekstrapolacji binody do podstawy trójkąta (sytuacja w której udział trzeciego składnika: propanolu lub acetonu; w roztworze jest zerowy) wynika, że wzajemna rozpuszczalność wody w toluenie i toluenu w wodzie jest rzędu 0,5% objętości. Oznacza to, że jeżeli do wody dodamy toluenu w ilości nie przekraczającej 0,5% objętości całego roztworu, czyli:
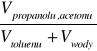
·100%<0,5%; to otrzymamy układ jednofazowy o dwóch stopniach swobody.
Przekroczenie tej objętości spowoduje powstania dwóch faz ciekłych i układ będzie miał jeden stopień swobody (skład jednej fazy będzie decydował o składzie drugiej fazy). Jedną z faz będzie stanowił nasycony roztwór toluenu w wodzie, a drugą nasycony roztwór wody w toluenie, powstają roztwory sprzężone.
Wzajemną mieszalność wody i toluenu zwiększamy dodając trzeciego składnika, który miesza się zarówno z wodą jak i z toluenem (propanol lub aceton). Z diagramu krzywej binodalnej w trójkącie Gibbsa wynika, że jeżeli w układzie propanol stanowi więcej niż 68% objętość całego układu to może istnieć tylko jedna faza ciekła nie zależnie od wzajemnego stosunku objętości wody i toluenu (powierzchnia nad krzywą binodalną). Podobną sytuację osiągamy dla układu toluen -woda -aceton, jeżeli aceton przekracza 68% objętości całego układu.
Z różnego przebiegu krzywych binodalnych dla dwóch układów: toluen - woda - propanol toluen - woda - aceton wnioskujemy, że propanol powoduje bardziej równomierny podział składników między dwie fazy (krzywa jest symetryczna) natomiast krzywa binodalna w układzie z propanolem jest nie symetryczna i nachylona w kierunku większej zawartości wody, co wskazuje na to, że faza bogata w wodę zawiera mniejszy ułamek toluenu niż powstająca z nią druga faza, która zawiera większy ułamek wody w porównaniu z ułamkiem toluenu w poprzedniej.
c
b
a
A
C
B
Wyszukiwarka
Podobne podstrony:
Trójkąt Gibbsa 2 (ćw. 21), Chemia fizyczna
Ćw. 21, chemia fizyczna, Nowy folder
Ćw. 17, chemia fizyczna, Nowy folder
chemia fizyczna 21, CHEMIA FIZYCZNA SPRAWKA 4 SEM
Ćw. 20, chemia fizyczna, Nowy folder
Ćw. 29, chemia fizyczna, Nowy folder
Ćw. 16, chemia fizyczna, Nowy folder
Ćw. 14, chemia fizyczna, Nowy folder
Ćw. 13, chemia fizyczna, Nowy folder
Ćw. 31, chemia fizyczna, Nowy folder
Ćw. 30, chemia fizyczna, Nowy folder
Ćw. 25, chemia fizyczna, Nowy folder
Ćw. 11, chemia fizyczna, Nowy folder
Ćw. 12, chemia fizyczna, Nowy folder
Ćw. 27, chemia fizyczna, Nowy folder
Ćw. 18, chemia fizyczna, Nowy folder
Ćw. 23, chemia fizyczna, Nowy folder
Ćw. 28, chemia fizyczna, Nowy folder
więcej podobnych podstron