Ewelina Zielińska, Agnieszka Magiera
Kalorymetria
Ciepło reakcji
W ćwiczeniu trzecim wykonałyśmy czynności umożliwiające nam pomiar ciepła reakcji w stałej objętości z użyciem bomby kalorymetrycznej. Skorzystałyśmy z ……………………. opisanej w instrukcji. Poniżej zamieszczamy kolejne czynności i obliczenia (wraz ze wzorami), które wykonywałyśmy.
Obliczenia
Dane:
a) dokładne określenie masy (przygotowanie próbki organicznej do reakcji)
dla kwasu benzoesowego:
dla pierwszej próbki naftalenu
dla drugiej próbki naftalenu
pierwsza próbka naftalenu
druga próbka naftalenu
pierwsza próbka naftalenu
druga próbka naftalenu
pierwsza próbka naftalenu
druga próbka naftalenu
Porównanie ……………………….. z wartością z literatury - wnioski
Kwas benzoesowy |
||
m proszku |
1,02 |
g |
m tabletki |
0,999 |
g |
m pojemniczka |
16,62 |
g |
m poj. z proszkiem |
17,64 |
g |
Naftalen I |
||
m proszku |
0,46 |
g |
m tabletki |
0,434 |
g |
m pojemniczka |
20,97 |
g |
m poj. z proszkiem |
21,43 |
g |
Naftalen II |
||
m proszku |
0,53 |
g |
m tabletki |
0,527 |
g |
m pojemniczka |
19,78 |
g |
m poj. z proszkiem |
20,3 |
g |
b) określenie dokładnego przyrostu temperatury określonej masy wody ∆T (tzw. bieg termometru).
Na podstawie danych możemy obliczyć ∆T dla kwasu benzoesowego i dwóch próbek naftalenu:
WYKRESY
c) obliczanie stałej układu kalorymetrycznego (pojemność cieplną, K) za pomocą substancji cechującej (kwasu benzoesowego).
Skorzystałyśmy ze wzoru:
![]()
gdzie:
Qv - ciepło spalania kwasu benzoesowego (![]()
)
m - masa spalanej substancji
∆T - przyrost temperatury w kalorymetrze
M - masa molowa substancji wzorcowej (kwas benzoesowy M=122,12 g/mol)
Po podstawieniu odpowiednich wartości otrzymałyśmy:
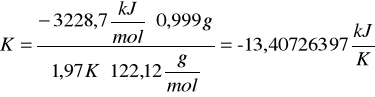
d) obliczanie ciepła spalania badanej substancji (naftalen)
Przekształciłyśmy wzór powyżej i otrzymałyśmy:
![]()
Oznaczenia zostały zachowane tak jak powyżej, za wyjątkiem Qv, które oznacza ciepło spalania naftalenu.
Po wstawieniu wartości liczbowych otrzymałyśmy wyniki:
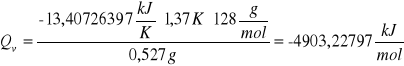

e) obliczanie molowej entalpii spalania naftalenu
Wiedząc, że zachodzi podana reakcja:
C10H8 (s) + 12O2 = 10CO2(g)+4H2O(c)
oraz, że:
![]()
![]()
możemy obliczyć![]()
. Po podstawieniu do wzoru wartości otrzymujemy:
![]()
-4908180,73 J/mol
![]()
-4466238,93 J/mol
f) obliczanie molowej entalpii tworzenia naftalenu z pierwiastków
A 10C(s) + 4H2 --- C10H8(s) +![]()
B C(s) + O2(g) --- CO2(g) + 393,8 kJ
C H2(g) + 0,5 O2(g) --- H2O(c) + 286,0 kJ
D C10H8(s) + 12O2(g) --- 10CO2(g) + 4H2O(c)+ ![]()
=9990,18073 kJ
=9548,23893kJ
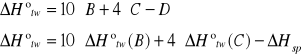
TO OSTATNIE DELTA H SPALANIA JEST OBLICZONE PRZEZ NAS
g) rachunek błędu: błąd bezwzględny i względny
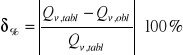
Błąd bezwzględny obliczamy ze wzoru:
gdzie:
Wartość tablicowa
Wynika z tego, że błąd bezwzględny obliczonej przez nas wartości wynosi:
Błąd względny obliczamy ze wzoru:
gdzie:
Po podstawieniu otrzymujemy:
Wyszukiwarka
Podobne podstrony:
kalorymetria2, fizyczna, chemia fizyczna, Fizyczna, laborki
kalorymetria wstęp, fizyczna, chemia fizyczna, Fizyczna, laborki
kalorymetria2 (2), fizyczna, chemia fizyczna, Fizyczna, laborki
kalorymetria do wydrukowania, fizyczna, chemia fizyczna, Fizyczna, laborki
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Korelacja liniowa, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Fizyczna ćw 4, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
ogniwa galwaniczne, fizyczna, chemia fizyczna, Fizyczna, laborki
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Chemia a ochrona środowiska - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Dane, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
teoria 1, fizyczna, chemia fizyczna, Fizyczna, laborki
więcej podobnych podstron