Obliczenia
Dane:
Kwas benzoesowy
nr. |
t [s] |
T [C] |
1 |
30 |
21,94 |
2 |
60 |
21,94 |
3 |
90 |
21,94 |
4 |
120 |
21,94 |
5 |
150 |
21,94 |
6 |
180 |
21,94 |
7 |
210 |
21,94 |
8 |
240 |
21,95 |
9 |
270 |
21,95 |
10 |
300 |
21,95 |
11 |
330 |
21,98 |
12 |
360 |
22,15 |
13 |
390 |
22,3 |
14 |
420 |
22,36 |
15 |
450 |
22,55 |
16 |
480 |
22,7 |
17 |
510 |
22,86 |
18 |
540 |
22,97 |
19 |
570 |
23,08 |
20 |
600 |
23,18 |
21 |
630 |
23,27 |
22 |
660 |
23,35 |
23 |
690 |
23,44 |
24 |
720 |
23,51 |
25 |
750 |
23,58 |
26 |
780 |
23,63 |
27 |
810 |
23,68 |
28 |
840 |
23,73 |
29 |
870 |
23,77 |
30 |
900 |
23,8 |
31 |
930 |
23,82 |
32 |
960 |
23,84 |
33 |
990 |
23,86 |
34 |
1020 |
23,87 |
35 |
1050 |
23,88 |
36 |
1080 |
23,89 |
37 |
1110 |
23,89 |
38 |
1140 |
23,9 |
39 |
1170 |
23,9 |
40 |
1200 |
23,9 |
41 |
1230 |
23,91 |
42 |
1260 |
23,91 |
43 |
1290 |
23,91 |
44 |
1320 |
23,91 |
45 |
1350 |
23,91 |
46 |
1380 |
23,91 |
47 |
1410 |
23,91 |
Naftalen 1
nr |
t [s] |
T [C] |
1 |
30 |
23,8 |
2 |
60 |
23,8 |
3 |
90 |
23,8 |
4 |
120 |
23,8 |
5 |
150 |
23,8 |
6 |
180 |
23,8 |
7 |
210 |
23,8 |
8 |
240 |
23,79 |
9 |
270 |
23,79 |
10 |
300 |
23,79 |
11 |
330 |
23,54 |
12 |
360 |
24,03 |
13 |
390 |
24,25 |
14 |
420 |
24,42 |
15 |
450 |
24,56 |
16 |
480 |
24,65 |
17 |
510 |
24,78 |
18 |
540 |
24,85 |
19 |
570 |
24,91 |
20 |
600 |
24,95 |
21 |
630 |
24,97 |
22 |
660 |
24,99 |
23 |
690 |
25,01 |
24 |
720 |
25,02 |
25 |
750 |
25,03 |
26 |
780 |
25,04 |
27 |
810 |
25,04 |
28 |
840 |
25,04 |
29 |
870 |
25,04 |
30 |
900 |
25,04 |
31 |
930 |
25,04 |
32 |
960 |
25,04 |
33 |
990 |
25,04 |
34 |
1020 |
25,04 |
35 |
1050 |
25,04 |
36 |
1080 |
25,04 |
Naftalen 2
nr |
t [s] |
T [C] |
1 |
30 |
24,93 |
2 |
60 |
24,93 |
3 |
90 |
24,93 |
4 |
120 |
24,93 |
5 |
150 |
24,93 |
6 |
180 |
24,93 |
7 |
210 |
24,93 |
8 |
240 |
24,92 |
9 |
270 |
24,92 |
10 |
300 |
24,92 |
11 |
330 |
24,92 |
12 |
360 |
24,95 |
13 |
390 |
25,01 |
14 |
420 |
25,1 |
15 |
450 |
25,19 |
16 |
480 |
25,29 |
17 |
510 |
25,37 |
18 |
540 |
25,45 |
19 |
570 |
25,51 |
20 |
600 |
25,56 |
21 |
630 |
25,63 |
22 |
660 |
25,67 |
23 |
690 |
25,73 |
24 |
720 |
25,78 |
25 |
750 |
25,82 |
26 |
780 |
25,86 |
27 |
810 |
25,89 |
28 |
840 |
25,93 |
29 |
870 |
25,97 |
30 |
900 |
25,99 |
31 |
930 |
26,01 |
32 |
960 |
26,04 |
33 |
990 |
26,06 |
34 |
1020 |
26,09 |
35 |
1050 |
26,11 |
36 |
1080 |
26,13 |
37 |
1110 |
26,15 |
38 |
1140 |
26,17 |
39 |
1170 |
26,18 |
40 |
1200 |
26,21 |
41 |
1230 |
26,22 |
42 |
1260 |
26,24 |
43 |
1290 |
26,25 |
44 |
1320 |
26,26 |
45 |
1350 |
26,27 |
46 |
1380 |
26,28 |
47 |
1410 |
26,29 |
48 |
1440 |
26,29 |
49 |
1470 |
26,3 |
50 |
1500 |
26,3 |
51 |
1530 |
26,3 |
52 |
1560 |
26,3 |
53 |
1590 |
26,3 |
54 |
1620 |
26,3 |
55 |
1650 |
26,3 |
56 |
1680 |
26,3 |
57 |
1710 |
26,3 |
58 |
1740 |
26,3 |
a) dokładne określenie masy (przygotowanie próbki organicznej do reakcji)
dla kwasu benzoesowego:
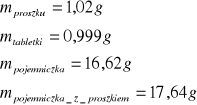
dla pierwszej próbki naftalenu
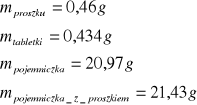
dla drugiej próbki naftalenu
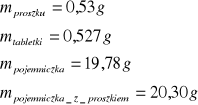
∆T dla kwasu benzoesowego i dwóch próbek naftalenu:
dla kwasu benzoesowego:
∆T=1,97K
dla pierwszej próbki naftalenu
∆T=1,37K
dla drugiej próbki naftalenu
∆T=1,24K
c) obliczanie stałej układu kalorymetrycznego (pojemność cieplną, K)
![]()
gdzie:
Qv - ciepło spalania kwasu benzoesowego (![]()
)
m - masa spalanej substancji
∆T - przyrost temperatury w kalorymetrze
M - masa molowa substancji wzorcowej (kwas benzoesowy M=122,12 g/mol)
Po podstawieniu odpowiednich wartości otrzymałyśmy:
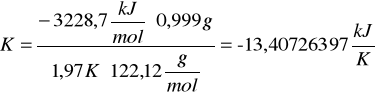
d) obliczanie ciepła spalania badanej substancji (naftalen)
![]()
pierwsza próbka naftalenu
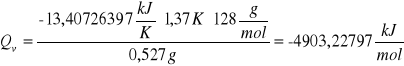
druga próbka naftalenu

Obliczanie molowej entalpii spalania naftalenu pod stałym ciśnieniem
Wiedząc, że zachodzi podana reakcja:
C10H8 (s) + 12O2 = 10CO2(g)+4H2O(c)
oraz, że:
![]()
i
![]()
Obliczamy![]()
pierwsza próbka naftalenu
![]()
druga próbka naftalenu
![]()
Obliczanie molowej entalpii tworzenia naftalenu z pierwiastków.
A 10C(s) + 4H2 --- C10H8(s) +![]()
B C(s) + O2(g) --- CO2(g) + 393,8 kJ
C H2(g) + 0,5 O2(g) --- H2O(c) + 286,0 kJ
D C10H8(s) + 12O2(g) --- 10CO2(g) + 4H2O(c)+ ![]()
-5033kJ/mol
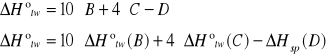
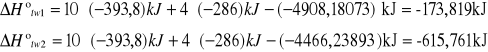
Wartość tablicowa wynosi -69,9kJ.
Porównanie entalpii tworzenia z wartością z literatury
Wartości entalpii tworzenia naftalenu różnią się mocno od podanych w tablicach. Pierwsza próbka naftalenu jest dokładniejsza, druga miała mniejszą dokładność. Możliwe różnice w otrzymanych wynikach odnośnie literatury związane są z pominiętymi przez nas w obliczeniach substancjami, które wytwarzały ciepło, np. drucik wolframowy lub reakcje pośrednie.
W pierwszej próbce naftalenu, w pomiarze 11 następuje nagły spadek temperatury. Wartość pomiaru odbiega od reszty i znajduje się poza funkcja.Mogło byc to spodowodane złym odczytaniem wyniku lub zapisaniem.
Kwas Benzoesowy
Naftalen I
Naftalen II
Wyszukiwarka
Podobne podstrony:
kalorymetria2, fizyczna, chemia fizyczna, Fizyczna, laborki
kalorymetria wstęp, fizyczna, chemia fizyczna, Fizyczna, laborki
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Ściąga do metali z hutnictwa i nie tylko, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
kalorymetria, fizyczna, chemia fizyczna, Fizyczna, laborki
kalorymetria2 (2), fizyczna, chemia fizyczna, Fizyczna, laborki
Do druku impulsy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
Do druku octowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
Wprowadzenie do 44 ch fiz, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Ch f, bon
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
do wydruku, Dokumenty AWF Wychowanie Fizyczne
Korelacja liniowa, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Fizyczna ćw 4, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
ogniwa galwaniczne, fizyczna, chemia fizyczna, Fizyczna, laborki
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
więcej podobnych podstron