Ewelina Zielińska, Agnieszka Magiera
Kalorymetria
Ciepło reakcji
Kalorymetr jest przyrządem laboratoryjnym służącym do pomiaru ilości ciepła zaabsorbowanego lub wydzielonego przez substancję wydzielanego podczas procesów chemicznych i fizycznych. Głównym elementem kalorymetru pozwalającym na bezpieczne spalanie próbek jest specjalistyczne naczynie wykonane ze stali kwasoodpornej
nazywane bomba kalorymetryczna. Przy zachowaniu stałej objętości spala się w niej znaną ilość substancji za pomocą czystego tlenu, rejestrując jednocześnie zmiany temperatury.
W oparciu o zmierzone kalorymetrem wartości ciepła właściwego, jako funkcji temperatury, można wyliczyć funkcje termodynamiczne (entalpia, entropia, energia swobodna itp.) badanych substancji w szerokim przedziale temperatur.
Schemat budowy kalorymetru
W ćwiczeniu trzecim wykonałyśmy czynności umożliwiające nam pomiar ciepła reakcji w stałej objętości z użyciem bomby kalorymetrycznej. Skorzystałyśmy z metody opisanej w instrukcji. Poniżej zamieszczamy kolejne czynności i obliczenia (wraz ze wzorami), które wykonywałyśmy.
Obliczenia
Dane:
Kwas benzoesowy
nr. |
t [s] |
T [C] |
1 |
30 |
21,94 |
2 |
60 |
21,94 |
3 |
90 |
21,94 |
4 |
120 |
21,94 |
5 |
150 |
21,94 |
6 |
180 |
21,94 |
7 |
210 |
21,94 |
8 |
240 |
21,95 |
9 |
270 |
21,95 |
10 |
300 |
21,95 |
11 |
330 |
21,98 |
12 |
360 |
22,15 |
13 |
390 |
22,3 |
14 |
420 |
22,36 |
15 |
450 |
22,55 |
16 |
480 |
22,7 |
17 |
510 |
22,86 |
18 |
540 |
22,97 |
19 |
570 |
23,08 |
20 |
600 |
23,18 |
21 |
630 |
23,27 |
22 |
660 |
23,35 |
23 |
690 |
23,44 |
24 |
720 |
23,51 |
25 |
750 |
23,58 |
26 |
780 |
23,63 |
27 |
810 |
23,68 |
28 |
840 |
23,73 |
29 |
870 |
23,77 |
30 |
900 |
23,8 |
31 |
930 |
23,82 |
32 |
960 |
23,84 |
33 |
990 |
23,86 |
34 |
1020 |
23,87 |
35 |
1050 |
23,88 |
36 |
1080 |
23,89 |
37 |
1110 |
23,89 |
38 |
1140 |
23,9 |
39 |
1170 |
23,9 |
40 |
1200 |
23,9 |
41 |
1230 |
23,91 |
42 |
1260 |
23,91 |
43 |
1290 |
23,91 |
44 |
1320 |
23,91 |
45 |
1350 |
23,91 |
46 |
1380 |
23,91 |
47 |
1410 |
23,91 |
Naftalen 1
nr |
t [s] |
T [C] |
1 |
30 |
23,8 |
2 |
60 |
23,8 |
3 |
90 |
23,8 |
4 |
120 |
23,8 |
5 |
150 |
23,8 |
6 |
180 |
23,8 |
7 |
210 |
23,8 |
8 |
240 |
23,79 |
9 |
270 |
23,79 |
10 |
300 |
23,79 |
11 |
330 |
23,54 |
12 |
360 |
24,03 |
13 |
390 |
24,25 |
14 |
420 |
24,42 |
15 |
450 |
24,56 |
16 |
480 |
24,65 |
17 |
510 |
24,78 |
18 |
540 |
24,85 |
19 |
570 |
24,91 |
20 |
600 |
24,95 |
21 |
630 |
24,97 |
22 |
660 |
24,99 |
23 |
690 |
25,01 |
24 |
720 |
25,02 |
25 |
750 |
25,03 |
26 |
780 |
25,04 |
27 |
810 |
25,04 |
28 |
840 |
25,04 |
29 |
870 |
25,04 |
30 |
900 |
25,04 |
31 |
930 |
25,04 |
32 |
960 |
25,04 |
33 |
990 |
25,04 |
34 |
1020 |
25,04 |
35 |
1050 |
25,04 |
36 |
1080 |
25,04 |
Naftalen 2
nr |
t [s] |
T [C] |
1 |
30 |
24,93 |
2 |
60 |
24,93 |
3 |
90 |
24,93 |
4 |
120 |
24,93 |
5 |
150 |
24,93 |
6 |
180 |
24,93 |
7 |
210 |
24,93 |
8 |
240 |
24,92 |
9 |
270 |
24,92 |
10 |
300 |
24,92 |
11 |
330 |
24,92 |
12 |
360 |
24,95 |
13 |
390 |
25,01 |
14 |
420 |
25,1 |
15 |
450 |
25,19 |
16 |
480 |
25,29 |
17 |
510 |
25,37 |
18 |
540 |
25,45 |
19 |
570 |
25,51 |
20 |
600 |
25,56 |
21 |
630 |
25,63 |
22 |
660 |
25,67 |
23 |
690 |
25,73 |
24 |
720 |
25,78 |
25 |
750 |
25,82 |
26 |
780 |
25,86 |
27 |
810 |
25,89 |
28 |
840 |
25,93 |
29 |
870 |
25,97 |
30 |
900 |
25,99 |
31 |
930 |
26,01 |
32 |
960 |
26,04 |
33 |
990 |
26,06 |
34 |
1020 |
26,09 |
35 |
1050 |
26,11 |
36 |
1080 |
26,13 |
37 |
1110 |
26,15 |
38 |
1140 |
26,17 |
39 |
1170 |
26,18 |
40 |
1200 |
26,21 |
41 |
1230 |
26,22 |
42 |
1260 |
26,24 |
43 |
1290 |
26,25 |
44 |
1320 |
26,26 |
45 |
1350 |
26,27 |
46 |
1380 |
26,28 |
47 |
1410 |
26,29 |
48 |
1440 |
26,29 |
49 |
1470 |
26,3 |
50 |
1500 |
26,3 |
51 |
1530 |
26,3 |
52 |
1560 |
26,3 |
53 |
1590 |
26,3 |
54 |
1620 |
26,3 |
55 |
1650 |
26,3 |
56 |
1680 |
26,3 |
57 |
1710 |
26,3 |
58 |
1740 |
26,3 |
a) dokładne określenie masy (przygotowanie próbki organicznej do reakcji)
dla kwasu benzoesowego:
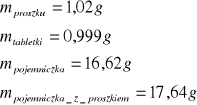
dla pierwszej próbki naftalenu
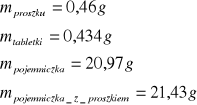
dla drugiej próbki naftalenu
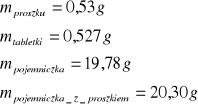
b) określenie dokładnego przyrostu temperatury określonej masy wody ∆T (tzw. bieg termometru).
Na podstawie danych możemy obliczyć ∆T dla kwasu benzoesowego i dwóch próbek naftalenu:
dla kwasu benzoesowego:
∆T=1,97K
dla pierwszej próbki naftalenu
∆T=1,37K
dla drugiej próbki naftalenu
∆T=1,24K
Wykresy dołączamy do sprawozdania (zostały wykonane na papierze milimetrowym).
c) obliczanie stałej układu kalorymetrycznego (pojemność cieplną, K) za pomocą substancji cechującej (kwasu benzoesowego).
Skorzystałyśmy ze wzoru:
![]()
gdzie:
Qv - ciepło spalania kwasu benzoesowego (![]()
)
m - masa spalanej substancji
∆T - przyrost temperatury w kalorymetrze
M - masa molowa substancji wzorcowej (kwas benzoesowy M=122,12 g/mol)
Po podstawieniu odpowiednich wartości otrzymałyśmy:
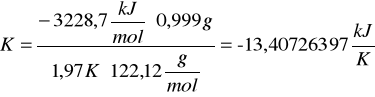
d) obliczanie ciepła spalania badanej substancji (naftalen)
Przekształciłyśmy wzór powyżej i otrzymałyśmy:
![]()
Oznaczenia zostały zachowane tak jak powyżej, za wyjątkiem Qv, które oznacza ciepło spalania naftalenu.
Po wstawieniu wartości liczbowych otrzymałyśmy wyniki:
pierwsza próbka naftalenu
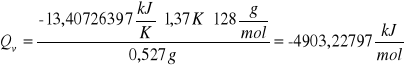
druga próbka naftalenu

Błąd względny obliczonego przez nas ciepła spalania wynosi dla:
pierwszej próbki naftalenu
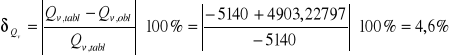
drugiej próbki naftalenu
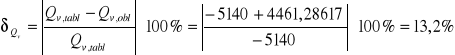
e) obliczanie molowej entalpii spalania naftalenu pod stałym ciśnieniem
Wiedząc, że zachodzi podana reakcja:
C10H8 (s) + 12O2 = 10CO2(g)+4H2O(c)
oraz, że:
![]()
i
![]()
możemy obliczyć![]()
. Po podstawieniu do wzoru wartości otrzymujemy:
pierwsza próbka naftalenu
![]()
druga próbka naftalenu
![]()
f) obliczanie molowej entalpii tworzenia naftalenu z pierwiastków.
Mając do dyspozycji reakcje B, C i D, przekształciłyśmy je w taki sposób, by móc otrzymać reakcję A.
A 10C(s) + 4H2 --- C10H8(s) +![]()
B C(s) + O2(g) --- CO2(g) + 393,8 kJ
C H2(g) + 0,5 O2(g) --- H2O(c) + 286,0 kJ
D C10H8(s) + 12O2(g) --- 10CO2(g) + 4H2O(c)+ ![]()
-5033kJ/mol
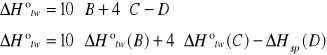
Otrzymujemy takie wartości dla próbki pierwszej i drugiej naftalenu:
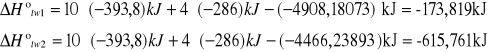
g) rachunek błędu: błąd bezwzględny i względny
Korzystamy przy obliczenia ze wzoru:
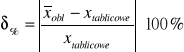
Po podstawieniu otrzymujemy:
Dla naftalenu 1:
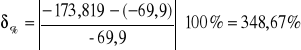
Dla naftalenu 2:
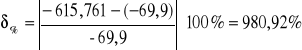
Wartość tablicowa wynosi -69,9kJ.
Porównanie entalpii tworzenia z wartością z literatury - wnioski
Wartości entalpii tworzenia naftalenu różnią się mocno od podanych w tablicach. Pierwsza próbka naftalenu jest dokładniejsza, druga miała mniejszą dokładność. Możliwe różnice w otrzymanych wynikach odnośnie literatury związane są z pominiętymi przez nas w obliczeniach substancjami, które wytwarzały ciepło, np. drucik wolframowy lub reakcje pośrednie.
W pierwszej próbce naftalenu, w pomiarze 11 następuje nagły spadek temperatury. Wartość pomiaru odbiega od reszty i znajduje się poza funkcją wykresu. Odchylenie to może wynikać z faktu spięcia w obwodach elektrycznych laboratorium, poprzez które to kalorymetr przestał na chwilę działać ( zatrzymał mieszadło i pomiar) co spowodowało zaburzenie wyników.
termometr
pojemnik wewnętrzny kalorymetru = bomba kalorymetryczna
mieszadło
pojemnik zewnętrzny
Warstwa izolacyjna
Wyszukiwarka
Podobne podstrony:
kalorymetria2, fizyczna, chemia fizyczna, Fizyczna, laborki
kalorymetria wstęp, fizyczna, chemia fizyczna, Fizyczna, laborki
kalorymetria, fizyczna, chemia fizyczna, Fizyczna, laborki
kalorymetria do wydrukowania, fizyczna, chemia fizyczna, Fizyczna, laborki
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Korelacja liniowa, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Fizyczna ćw 4, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
ogniwa galwaniczne, fizyczna, chemia fizyczna, Fizyczna, laborki
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Chemia a ochrona środowiska - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Dane, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
teoria 1, fizyczna, chemia fizyczna, Fizyczna, laborki
więcej podobnych podstron