EKSPERYMENTALNE WYZNACZANIE MASY MOLOWEJ METALU |
ĆW.7. |
Cel ćwiczenia
Celem ćwiczenia jest eksperymentalne wyznaczenie masy molowej metalu na podstawie oznaczenia objętości wodoru wypartego przez ten metal w reakcji z kwasem według reakcji:
M + nHCl = MCln + n/2H2
Masa molowa jest to masa 1 mola cząstek (atomów, jonów, cząsteczek)substancji wyrażona w gramach. Masa molowa węgla w gramach jest liczbowo równa jego masie atomowej wyrażonej w atomowych jednostkach masy, u. Jeden mol atomów węgla waży dokładnie 12 gramów. Podobnie masa atomowa sodu wynosi 22,99 u, a jego masa molowa wynosi 22,99 g. Jeśli znamy masę atomową pierwiastka, to jednocześnie znamy jego masę molową. Według Międzynarodowego Układu Jednostek miar (SI) mol jest to taka ilość substancji, która zawiera dokładnie tyle cząstek (atomów, jonów, cząsteczek), ile atomów jest w 12 gramach izotopu węgla C-12. Liczba ta nosi nazwę liczby Avogadro, NA. Aktualnie obowiązująca wartość, rekomendowana w r. 2006 przez Komitet ds. Danych dla Nauki i Techniki (CODATA) wynosi NA = 6,02214179(30)⋅1023.
Odczynniki:
► próbki metali (Zn, Al, Mn, Mg)
► 6,0 M kwas solny, HCl
Sprzęt laboratoryjny:
► cylinder miarowy o pojemności 10 cm3
►barometr
►termometr
► aparat pomiarowy
Wykonanie ćwiczenia:
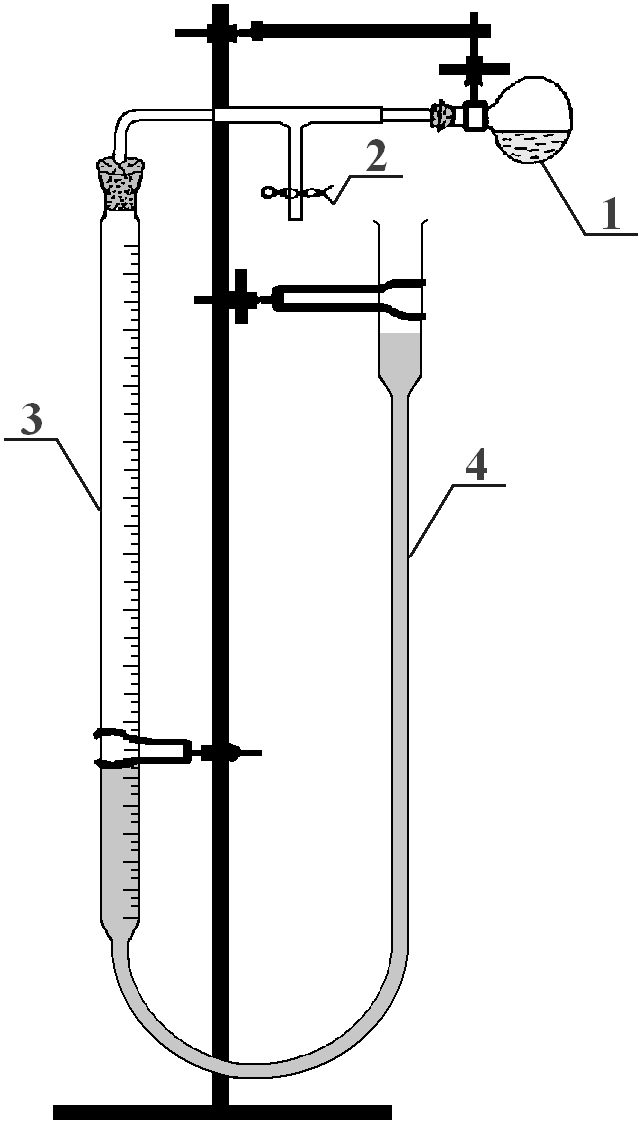
Przed przystąpieniem do wykonywania ćwiczenia należy sprawdzić szczelność aparatu. W tym celu:
♦otwórz ściskacz (2);
♦doprowadź poziom wody w biurecie do zera przez podnoszenie i opuszczanie naczynia (4);
♦zamknij ściskacz (2);
♦obniż naczynie poziomujące tak, aby poziom wody był niższy niż w biurecie (3);
♦poczekaj 2-3 minuty; jeżeli poziom wody w biurecie nie zmieni się, to znaczy, że aparat jest szczelny i można zaczynać pomiar.
Zważ próbkę metalu na wadze analitycznej.
Do kolby kulistej okrągłodennej (1) wprowadź 12 cm3 6 M kwasu solnego, tak aby szyjka kolby była sucha.
Kolbę (1) umieść poziomo, jak pokazano na rysunku.
Próbkę metalu umieść w szyjce kolby tak, aby nie wpadła do kwasu, lecz leżała w szyjce kolby.
Poziom wody w biurecie doprowadź do zera.
Przy zamkniętym ściskaczu (2) wprowadź metal do kwasu. Wodór wydzielający się w reakcji wypiera wodę z biurety do naczynia poziomującego (4). Poziomy wody w biurecie (3) i naczyniu (4) powinny być jednakowe.
Po zakończeniu reakcji poczekaj około 5 minut.
Wyrównaj poziomy w rurkach (3) i (4).
Odczytaj objętość wydzielonego wodoru i temperaturę otoczenia.
Na podstawie uzyskanych wyników oblicz masę molową metalu.
Obliczenia:
Ilość wydzielonego wodoru zależy od masy próbki metalu oraz jego wartościowości zgodnie z równaniem reakcji: M + nHCl = MCln + 0,5 n H2
Objętość wydzielonego wodoru w warunkach normalnych obliczamy z równania gazu doskonałego:
![]()
stąd: ![]()
gdzie
vo, po, To - objętość, ciśnienie, temperatura w normalnych warunkach
v, p, T - objętość, ciśnienie, temperatura w warunkach pomiaru
Ciśnienie (p) jest równe różnicy pomiędzy ciśnieniem atmosferycznym (pat) a ciśnieniem pary wodnej w biurecie (pw). Prężność pary wodnej w danej temperaturze należy odczytać z tablic chemicznych.
Znając masę próbki metalu (m), jego wartościowość (n) oraz objętość wodoru w warunkach normalnych (Vo) można obliczyć masę molową metalu (M):
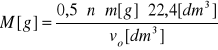
Znając rzeczywistą masę molową metalu można obliczyć błąd bezwzględny i względny pomiaru:
♦błąd bezwzględny (ε) jest to różnica pomiędzy wartością eksperymentalną (A) a rzeczywistą (X): ![]()
♦błąd względny (σ) jest to stosunek błędu bezwzględnego do wartości rzeczywistej wyrażony w procentach: ![]()
Wyniki:
Wyniki doświadczenia umieść w tabeli:
Odważka metalu [g] |
Objętość wodoru, v [dm³] |
Ciśnienie atmosferyczne, pat [hPa] |
Temperatura, T [K] |
Prężność pary wodnej, pw [hPa] |
Objętość wodoru w war. norm., vo [dm³] |
Masa molowa metalu, M [g]
|
|
|
|
|
|
|
|
Dyskusja:
1. Ile atomów zawierała próbka metalu, której użyłeś w doświadczeniu?
2. Populacja ludzi na Ziemi wynosi około 6 miliardów. Ile moli ludzi żyje na Ziemi?
3. Korzystając z podręczników podaj przykłady innych metod służących do wyznaczania mas molowych pierwiastków chemicznych.
4. Obecnie jedną z najdokładniejszych metod wyznaczania mas atomowych jest spektrometria masowa. Na podstawie wiadomości zawartych w podręcznikach opisz w skrócie zasadę działania spektrometru masowego.
Wyszukiwarka
Podobne podstrony:
WYZNACZANIE MASY MOLOWEJ METODTŁ KRIOSKOPOWTŁ2
8 wyznaczanie masy molowej gazu
WYZNACZANIE ŚREDNIEJ MOLOWEJ MASY POLIMERU NA PODSTAWIE POMIARU LEPKOŚCI, NAUKA, WIEDZA
WYZNACZANIE WSPÓŁCZYNNIKÓW IZOTONICZNYCH MASY MOLOWEJ I STOPNIA DYSOCJACJI Z POMIARÓW CIŚNIENIA 2
WYZNACZANIE CIEP A MOLOWEGO, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
Wyznaczanie masy cząsteczkowej makromolekuł na podstawie pomiarów wiskozymetrycznych
teoretyczne i doswiadczalne wyznaczanie refrakcji molowej wody i glice XW53GBRV4RDPBNU4DEQ43NREVKKNT
Wyznaczanie stosunku molowego ciepła właściwego gazu przy stałym ciśnieniu do molowego ciepła właści
Wyznaczanie masy Ziemi
Podstawy chemii Cw 1 Wyznaczanie masy atomowej magnezu
Cechowanie termopary i wyznaczanie temperatury krzepnięcia metalu, Szkoła, penek, Przedmioty, Fizyka
Wyznaczanie masy Słońca
ćw # Wyznaczanie nadmiaru molowej objętości mieszania dla układu dwuskładnikowego
Wyznaczanie masy cząsteczkowej metodą ebuliometryczną, Studia, Politechnika
Wyznaczanie masy cząsteczkowej związków wielkocząsteczkowych, Studia, Politechnika
Wyznaczanie masy cząsteczkowej makromolekuł na podstwie pomiarów wiskozymetrycznych, Medycyna 1 rok
5.5, 5.5Lllllll, Wyznaczanie refrakcji molowej cieczy organicznej
więcej podobnych podstron