WYZNACZANIE MASY MOLOWEJ GAZU |
ĆW.8. |
Cel ćwiczenia
Jeden atom pierwiastka chemicznego lub jedna cząsteczka dowolnego związku chemicznego są tak małe, że makroskopowe próbki substancji używane w laboratoriach chemicznych zawierają ogromne liczby cząstek, najczęściej rzędu 1023 drobin. Z tego powodu chemicy stosują do wyrażania ogromnych liczb cząstek jednostkę zwaną molem. Jeden mol dowolnych cząstek to w przybliżeniu 6,022·1023. Masa jednej drobiny wyrażona w gramach jest niewyobrażalnie mała. Na przykład jedna cząsteczka tlenu, O2, ma masę 5,3122·10-23 g, ale 1 mol tych cząsteczek, czyli 6,022·1023 cząsteczek tlenu, to już masa wynosząca 31,99 g. Masę 1 mola dowolnych cząsteczek nazywamy masą molową danego związku chemicznego i wyrażamy w gramach. Zgodnie z prawem Avogadro 1 mol dowolnej substancji gazowej w jednakowych warunkach ciśnienia i temperatury zajmuje taką samą objętość. W warunkach normalnych objętość molowa gazu wynosi 22,4 dm3.
Celem ćwiczenia jest wyznaczenie masy molowej gazu w oparciu o prawo Avogadro.
Odczynniki
► badany gaz
Sprzęt laboratoryjny
► kolba kulista płaskodenna z korkiem
► cylinder miarowy o pojemności 1000 cm3
► waga analityczna
► barometr
► termometr 0-50 ºC
Wykonanie ćwiczenia:
⇒ Suchą płaskodenną kolbę kulistą, zawierającą powietrze i zamkniętą korkiem, zważ na wadze analitycznej.
⇒ Zaznacz markerem na szyjce kolby poziom, do którego sięga dolna krawędź korka.
⇒ Napełnij kolbę badanym gazem i zważ ją ponownie.
⇒ W celu wyznaczenia objętości kolby napełnij ją wodą do zaznaczonego poziomu, przelej wodę do cylindra miarowego i odczytaj objętość.
⇒ Odczytaj temperaturę i ciśnienie otoczenia.
Obliczenia
⇒ Oblicz, jaką objętość w warunkach normalnych zajęłoby powietrze zawarte w kolbie:
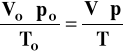
stąd: 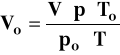
Vo, po, To - objętość, ciśnienie i temperatura w warunkach normalnych (273K, 1013 hPa)
p, T - ciśnienie i temperatura w warunkach doświadczalnych
V - objętość wody = objętość gazu
⇒ Oblicz masę powietrza zawartego w kolbie, wiedząc, że 1 dm3 powietrza w warunkach normalnych waży 1,293g.
⇒ Oblicz masę pustej kolby odejmując od masy kolby z powietrzem masę powietrza.
⇒ Oblicz masę badanego gazu odejmując od masy kolby z gazem masę pustej kolby.
⇒ Oblicz masę molową gazu (Mr) znając masę gazu (m), jego objętość w warunkach normalnych (Vo) oraz zależność wynikającą z prawa Avogadro:
![]()
czyli: ![]()
⇒ Oblicz błąd względny i błąd bezwzględny oznaczenia.
Wyniki
Masa kolby z powie-trzem (m1) |
Masa kolby z gazem (m2) |
Ciśnie-nie (p) |
Temp. (T) |
Objętość kolby (V) |
Objętość powietrza w war. norm. (Vo) |
Masa powie-trza (mp) |
Masa gazu (m)
|
Masa molowa gazu (Mr) |
|
|
|
|
|
|
|
|
|
Wyszukiwarka
Podobne podstrony:
WYZNACZANIE MASY MOLOWEJ METODTŁ KRIOSKOPOWTŁ2
7 wyznaczanie masy molowej metalu
Wyznaczanie stosunku molowego ciepła właściwego gazu przy stałym ciśnieniu do molowego ciepła właści
WYZNACZANIE ŚREDNIEJ MOLOWEJ MASY POLIMERU NA PODSTAWIE POMIARU LEPKOŚCI, NAUKA, WIEDZA
WYZNACZANIE WSPÓŁCZYNNIKÓW IZOTONICZNYCH MASY MOLOWEJ I STOPNIA DYSOCJACJI Z POMIARÓW CIŚNIENIA 2
WYZNACZANIE CIEP A MOLOWEGO, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
Wyznaczanie masy cząsteczkowej makromolekuł na podstawie pomiarów wiskozymetrycznych
teoretyczne i doswiadczalne wyznaczanie refrakcji molowej wody i glice XW53GBRV4RDPBNU4DEQ43NREVKKNT
Wyznaczanie masy Ziemi
Podstawy chemii Cw 1 Wyznaczanie masy atomowej magnezu
Wyznaczanie masy Słońca
ćw # Wyznaczanie nadmiaru molowej objętości mieszania dla układu dwuskładnikowego
Wyznaczanie masy cząsteczkowej metodą ebuliometryczną, Studia, Politechnika
Wyznaczanie masy cząsteczkowej związków wielkocząsteczkowych, Studia, Politechnika
Wyznaczanie masy cząsteczkowej makromolekuł na podstwie pomiarów wiskozymetrycznych, Medycyna 1 rok
5.5, 5.5Lllllll, Wyznaczanie refrakcji molowej cieczy organicznej
5.5, 5.5L, Wyznaczanie refrakcji molowej cieczy organicznej
więcej podobnych podstron