Politechnika Śląska
Wydział Transportu
Katowice
Rok akademicki 2009/2010
Ćwiczenie laboratoryjne z fizyki
Sprawozdanie z ćwiczenia
Temat ćwiczenia:
„BADANIE ATOMOWYCH WIDM EMISYJNYCH GAZÓW I METALI.”
Grupa dziekańska: T11
Sekcja laboratoryjna: XI
Michał Kudela
Konrad Łysiak
Jaromir Bracki
Wstęp teoretyczny:
Analiza widmowa opiera się na zjawisku dyspersji fali elektromagnetycznej, czyli rozszczepieniu światła niejednobarwnego na barwy składowe. Fala elektromagnetyczna, jaką poddaje się analizie jest widmem wyemitowanym lub zaabsorbowanym przez pierwiastek.
Widmo to zbiór wszystkich częstotliwości fali elektromagnetycznej emitowanej przez pierwiastek. Ze względu na sposób powstawania rozróżniamy widma:
Emisyjne - powstaje przy wzbudzeniu (elektrycznym bądź termicznym) pierwiastka (najczęściej gazu lub pary metalu). Wskutek takiego pobudzenia elektron przechodzi ze stanu stacjonarnego na wyższy poziom energetyczny (nietrwały) i wracając do poziomu podstawowego emituje kwant promieniowania (foton) o energii
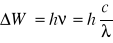
(gdzie h - stała Plancka, c - pr. światła, * - częstotliwość fali, * - długość fali, *W - energia wypromieniowana),Absorpcyjne - światło białe przechodząc przez gazy lub pary metali jest częściowo pochłaniane. Pochłaniane są przezeń dokładnie te same długości fal, które emituje dane ciało świecąc. W wyniku tego światło białe po przejściu przez pary jakiegoś pierwiastka nie daje już widma ciągłego. W miejscach, gdzie występują linie emisyjne pierwiastka tworzącego pary, w widmie ciągłym powstają przerwy.
Luminescencyjne.
Widma emisyjne i absorpcyjne mogą być wykorzystywane do analizy widmowej.
Zjawisko dyspersji fali elektromagnetycznej wynika z faktu, że współczynnik załamania dla określonego środowiska zależy od długości światła (fali elektromagnetycznej).
Rozszczepienia światła dokonuje się za pomocą odpowiednich układów optycznych (pryzmatu, soczewki). Światło białe (jako mieszanina wszystkich długości fal widzialnych o częstotliwościach 400-710nm) przechodząc przez pryzmat - bryłę ograniczoną dwoma płaszczyznami tworzącymi ze sobą kąt * (inne płaszczyzny są dowolne) - ulega rozszczepieniu na barwy: czerwoną, pomarańczową, żółtą zieloną, niebieską i fioletową. Światło o poszczególnych barwach różni się długością fali. Obraz powstały na wskutek rozszczepienia światła białego nazywamy widmem ciągłym, ponieważ kolejne barwy przechodzą w sposób ciągły jedna w drugą. Widmo ciągłe możemy otrzymać poddając rozszczepieniu światło wysyłane przez ciała stałe i ciekłe podgrzane do wysokiej temperatury.
Gdy jako źródło światła wykorzystujemy gazy jednoatomowe, widmo składa się z pojedynczych prążków barwnych, których ilość i położenie jest inne i niepowtarzalne dla każdego gazu. Widmo takie pozwala nam na zidentyfikowanie atomów będących źródłem fali. Pomiarów położenia linii widmowych dokonuje się za pomocą spektrometru.
Chcąc wykonać analizę widmową musimy znać dokładnie długości fal poszczególnych linii. Długość fal możemy określić z położenia poszczególnych długości fal, znając tzw. krzywą cechowania monochromatora. Krzywa cechowania, jest to zależność długości fali od położenia linii (położenie jest mierzone w sposób umowny, ważne jest tylko, aby był to ten sam sposób dla wyznaczania krzywej oraz dla właściwych pomiarów przy badaniu nieznanego pierwiastka). Aby wyznaczyć przebieg krzywej cechowania monochromatora określamy położenie linii pierwiastka o znanym widmie i możliwie największym zakresie długości emitowanych fal (jeśli zachodzi taka potrzeba, można użyć więcej niż jednego pierwiastka).
Gazy o cząsteczkach dwu- i wieloatomowych dają widma pasmowe, w których nie występują pojedyncze linie o jednej tylko długości fali, lecz pasma na przemian jasne i ciemne.
Do identyfikacji pierwiastków nadaje się zarówno widmo emisyjne jak i widmo absorpcyjne.
Schemat stanowiska pomiarowego:
M - monochromator
Z - zasilacz
S - badane źródło promieniowania.
Opracowanie wyników:
Korzystając z danych tablicowych oraz wyników badań widma emisyjnego rtęci sporządzić wykres zależności długości fali obserwowanego w monochromatorze promieniowania od wskazania na skali monochromatora.
Wykorzystując sporządzoną krzywą cechowania monochromatora znaleźć długości fal promieniowania emitowanego przez badaną lampę spektralna.
Porównując długości fal zaobserwowanych linii widmowych z danymi tablicowymi identyfikujemy pierwiastki w przebadanych lampach spektralnych.
Dla każdej z linii Hα, Hβ, Hγ widma wodoru obliczamy wartość stałej Rydberga ze wzoru
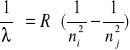
, gdzie 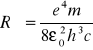
Następnie obliczyć wartość średnia i odpowiadające jej odchylenie standardowe.
Wyniki pomiarów i obliczenia:
Położenie, barwa linii widmowych dla lampy rtęciowej - zastosowanej do wykreślenia krzywej dyspersji.
Lampa rtęciowa |
|||
L.p. |
Barwa |
Długość fali pików λ [nm] |
wskazanie monochromatora [o] |
1 |
fioletowa |
404,7 |
1324 |
2 |
fioletowa |
407,8 |
1388 |
3 |
fioletowa |
435,8 |
1880 |
4 |
zielononiebieska |
491,0 |
2550 |
5 |
zielona |
546,0 |
2980 |
6 |
żółta |
577,0 |
3150 |
7 |
żółta |
579,1 |
3160 |
8 |
czerwona |
623,4 |
3350 |
Położenie, intensywność i kolor linii widmowych dla lampy X.
Lampa X |
|||
L.p. |
Barwa |
wskazanie monochromatora [o] |
Długość fali λ odczytana z krzywej dyspersji [nm] |
1 |
pomarańczowy |
3325 |
618 ± 2 |
2 |
pomarańczowy |
3220 |
592 ± 2 |
3 |
żółty |
3175 |
582 ± 2 |
4 |
żółtozielony |
3115 |
570 ± 2 |
5 |
zielony |
2880 |
534 ± 2 |
6 |
zielononiebieski |
2715 |
512 ± 2 |
7 |
zielononiebieski |
2575 |
494 ± 2 |
8 |
fioletowy |
2260 |
462 ± 2 |
9 |
fioletowy |
2150 |
454 ± 2 |
10 |
fioletowy |
1330 |
406 ± 2 |
Obliczanie wartości średniej dla n=10:
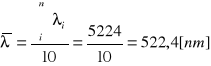
Obliczanie odchylenia standardowego:
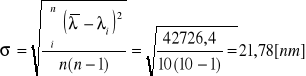
Po porównaniu otrzymanych wartości długości fal z wartościami tablicowymi, możemy wnioskować, że badaną lampą X była lampa sodowa.Obliczenie stałej Rydberga
Do obliczenia stałej Rydberga korzystamy ze wzoru:
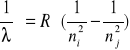
gdzie 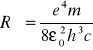
εo - przenikalność elektryczna próżni = 8,854*10-12[Fm-1]
m - masa elektronu = 9,109*10 -31[kg]
h - stała Plancka = 6,626*10-34 [J*s]
c - prędkość światła w próżni =299*106 [m/s]
n - liczba kwantowa
Seria Lymana
ni=1
nj=2
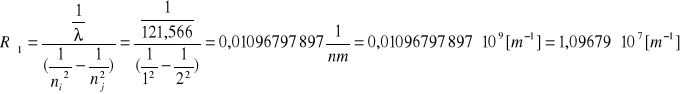
Seria Lymana
ni=1
nj=3
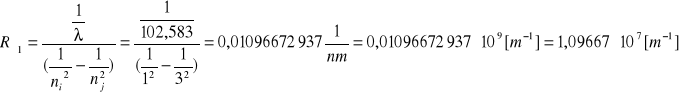
Seria Lymana
ni=1
nj=4
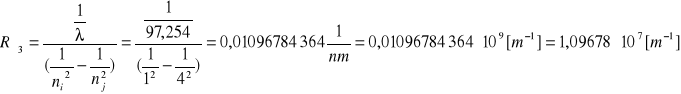
Seria Lymana
ni=1
nj=5
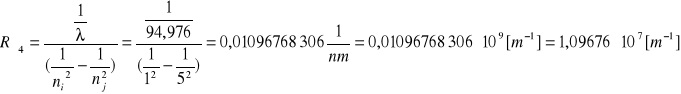
Seria Lymana
ni=1
nj=6
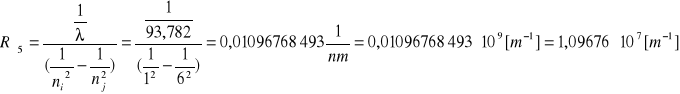
Obliczenie wartości średniej dla n=5:
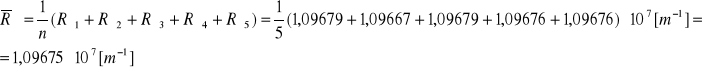
Obliczenie odchylenia standardowego:
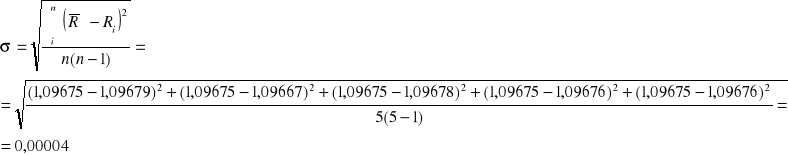
Wartość obliczonej średniej stałej Rydberga:
![]()
Wartość tablicowa stałej Rydberga:
![]()
Porównanie obliczonej i tablicowej stałej Rydberga:
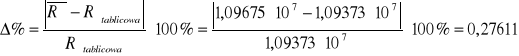
%
Wnioski:
Dzięki danym tablicowym oraz krzywej cechowania monochromatora, można określić pierwiastkową zawartość danej próbki. Cechowanie przeprowadzono na podstawie linii widmowych emitowanych przez lampę rtęciową .
Lampa spektralna X to lampa sodowa.
Wyszukiwarka
Podobne podstrony:
wahadło torsyjne moje sanpopr2, Transport Polsl Katowice, 2 semestr, Fizyka, Fizyka Ja
defektoskop, Transport Polsl Katowice, 2 semestr, Fizyka, Fizyka Ja
elipsoida, Transport Polsl Katowice, 2 semestr, Fizyka, Fizyka Ja
elipsoida2, Transport Polsl Katowice, 2 semestr, Fizyka, Fizyka Ja
fizykawyklad 001ukladyodniesienia, Transport Polsl Katowice, 2 semestr, Fizyka, FIZA, fizyka
fizykawyklad 005rezonanselektro, Transport Polsl Katowice, 2 semestr, Fizyka, FIZA, fizyka
fizyka 2 termin, Transport Polsl Katowice, 2 semestr, Dobrodziejstwa
Ja, Transport Polsl Katowice, 2 semestr, Infrastruktura Transportu, Sprawozdanie
transport zywnosci, Transport Polsl Katowice, 5 semestr, TPD, Komplet
IM 9, Transport Polsl Katowice, 2 semestr, Inżynieria materiałowa, IM
UPN projekt, Transport Polsl Katowice, 6 semestr, Studia 6, MOje, UPN Projekt
wytrzymałośc projekt III i, Transport Polsl Katowice, 3 semestr, Rok2 TR
Projekt3 darek staryword, Transport Polsl Katowice, 5 semestr, 5 semestr, PKM3
projekt ze środków nr2, Transport Polsl Katowice, 6 semestr, Studia 6, Materiały Jacek, Środki trans
więcej podobnych podstron