WYKŁAD 7
Antybiotyki. Wrażliwość drobnoustrojów na leki. Problem lekooporności.
Definicja antybiotyku.
substancja wytwarzana przez drobnoustroje, której niewielkie ilości mogą hamować rozwój innych drobnoustrojów. Określenie używane do związków pochodzących bezpośrednio od drobnoustrojów
Lek przeciwbakteryjny
związek naturalny, syntetyczny lub półsyntetyczny przydatny klinicznie w leczeniu zakażeń bakteryjnych.
Podział antybiotyków ze względu na mechanizmy działania na drobnoustroje.
a)Leki bakteryjne hamujące syntezę ściany komórkowej
-beta-laktamowe leki p/bakteryjne; działają bakteriobójczo
klasyczne: penicyliny, cefalosporyny
nieklasyczne: karbapenemy, monobaktamy, oksapenemy
Mechanizm działania - miejscami docelowymi dzialania penicylin na bakterie są białka wiążące penicyliny PBP
Wiążą i unieczynniaja transpeptydazę oraz karboksypeptydazę i tym samym hamują syntezę ściany komórkowej bakterii tj. krzyżowe wiązanie peptydoglikanu
aktywują enzymy autolityczne (autolizyny) które biora udział w prawidłowym przetwarzaniu materiału budulcowego sciany komórkowej bakterii i rozdzieleniu komórek po podziale
-inne inhibitory syntezy ściany komórkowej bakterii
antybiotyki glikopeptydowe - wankomycyna oraz teikoplanina. Glikopeptydy wykazują aktywność tylko wobec bakterii Gram(+) - zwłaszcza gronkowców WRSA MRCNS, paciorkowców,
bacytracyna
cykloseryna
b)Leki p/bakteryjne hamujące syntezę nukleotydów = hamujące syntezę puryn i pirymidyn
-sulfonamidy - syntetyczne leki p/bakteryjne np. sulfametoksazol
-trimetoprim
-sulfametaksazol - trimetoprim (kotrimoksazol) np. biseptol, bactrim
c)Leki p/bakteryjne hamujące syntezę kwasu nukleinowego
-inhibitory syntezy DNA
Chinolony; mechanizm działania to zaburzanie syntezy DNA przez hamowanie wyrazy DNA;
stare chinoliny np.kwas nalidyksynowy
fluorochinolony (nowe chinolony) oflatoksyna, norfloksacyna, ciprofloksacynaNitromidazole np. metronidazol - skuteczne wobec bezwzględnych beztlenowców
nowobiocyna
-inhibitory syntezy RNA = transkrypcji RNA np. Ryfampicyna
d)Leki p/bakteryjne hamujące syntezę białek
-inhibitory jednostki rybosomalnej 30S
amino glikozydy działają bakteriobójczo, szeroki zakres działania
hamują syntezę białek przez nieodwracalne wiązanie się z podjednostką 30S rybosomy bakteryjnego, bakterie stają się niezdolne do syntezy białek
np. streptomycyna, neomycyna, nowe amino glikozydy: gentamycyna, tobramycyna, amikacyna, netylmycynaTetracykliny to antybiotyki bakteriostatyczne o szerokim spektrum działania; hamuja syntezę białek przez wiązanie z jednostką 30S rybosomy bakteryjnego i hamuj a wydłużanie peptydów
preparaty:
krótko działające tetracykliny - tetracyklina, oksytetracyklina
długo działające tetracykliny - doksycyklina, mino cyklina
-inhibitory jednostki rybosomalnej 50S
Chloramfenikol
Antybiotyki makrolidowe: erytromycyna, klarytromycyna, azytromycyna
Linkozamidy np. linkomycyna, klindamycyna
wiążą się z jednostką 50S rybosomy i powoduj a przedwczesne zakończenie tworzenia łańcucha peptydowego
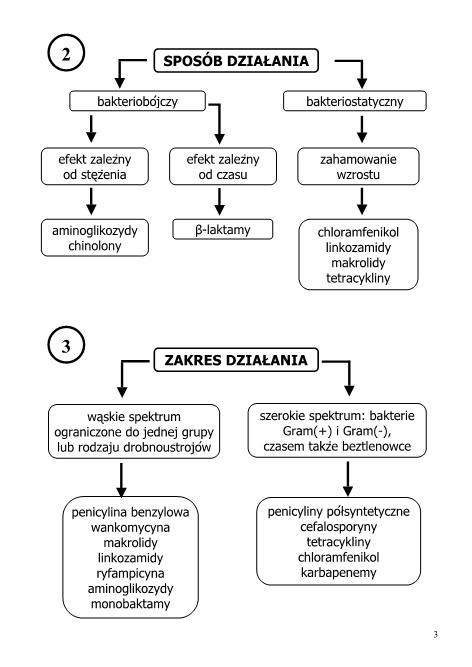
Antybiotyki działające bakteriobójczo i bakteriostatycznie.
Bakteriobójczy - zabija bakterie, zmniejsza liczbę żywych bakterii w hodowli, zabijają jedynie rosnące bakterie
bakteriostatycznie - hamują wzrost bakterii np. sulfonamidy
Synergizm i antagonizm antybiotyków, znaczenie w zastosowaniu leczenia skojarzonego.
Jako leczenie pierwszego rzutu
poszerzenie spektrum potencjalnych czynników zakażenia
uzyskanie efektów synergistycznych (spotęgowany efekt działania dwóch związków)
opóźnienie rozwoju bakteryjnej oporności
zmniejszenie dawek leków o znanych efektach niepożądanych.
ZASADY KOJARZENIA ANTYBIOTYKÓW :
-bakteriobójczy + bakteriobójczy - synergizm lub indyferencja
(nigdy antagonizm)
-bakteriostatyczny + bakteriostatyczny - addycja lub indyferencja
(nigdy synergizm ani antagonizm)
-bakteriobójczy + bakteriostatyczny - indyferencja, antagonizm lub
synergizm przy dużej wrażliwości na antybiotyk bakteriobójczy -
ewentualnie antagonizm, przy ma ej wrażliwości na antybiotyk
bakteriobójczy - czasem synergizm
Mechanizmy nabywania lekooporności przez drobnoustroje.
-Zmiany mutacyjne genów właściwych, które wcześniej nie były odpowiedzialne za oporność lub genów, które odpowiadały za oporność na inne antybiotyki
-Zmiany ekspresji inf. Genetycznej na poziomie transkrypcji lub translacji
-ułatwienie horyzontalnego przekazywania genów między odległymi filogenetycznie grupami bakterii
-synteza nowych układów białkowych
Cel i zasady wykonywania antybiogramów
Aby określić wrażliwość danego drobnoustroju na działanie określonego antybiotyku lub chemioterapeutyku
Metoda dyfuzyjno-krążkowa: dyfuzja antybiotyku zawartego w krążku do podłoża, antybiotyk dyfunduje promieniście, tworząc gradient stężeń. Największa koncentracja przy brzegach krążka i spada wraz ze zwiększaniem odległości od krążka. Wielkość strefy zahamowania wprost proporcjonalna do stopnia wrażliwości bakterii na antybiotyk. Określamy bakterie jako wrażliwe, średnio wrażliwe, oporne.
Metoda rozcieńczeniowa pozwala na określenie minimalnego stężenia antybiotyku MIC hamującego wzrostu bakterii.
Etest łączy dyfuzję antybiotyku w agarze i ilościowe określenie stężenia hamującego MIC. Wykorzystuje się paski nasączone antybiotyki w gradiencie stężeń.
Określenie wrażliwości na antybiotyki - pozwala na wybór najlepszego antybiotyku tj. o największym zakresie działania i o największej skuteczności, sile działania na wyizolowane szczepy bakterii.
MIC - minimalne stężenie hamujące (najniższe stężenie antybiotyku pozwalające na zahamowanie danego drobnoustroju).
MBC- minimalne stężenie bakteriobójcze ( najniższe stężenie antybiotyku działające bakteriobójczo)
Metody oznaczania wrażliwości na chemioterapeutyki
Metody oznaczania MIC
metoda rozcieńczeń - metoda rozcieńczeń w podłożach płynnych (metoda rozcieńczeń probówkowych) oraz w podłożu stałym
metoda dyfuzji krążkowej na agarze= technika Kirby'ego i Bauera= metoda płytkowo-dyfuzyjna
Ad.1 Metody rozcieńczeniowe - są metodami ilościowymi , określającymi wartość najmniejszego stężenia chemioterapeutyku hamującego wzrost bakterii = MIC-
TECHNIKA:
przygotowuje się serie próbówek zawierająca identyczną objętość bulionu i podwójne rozcieńczenia danego antybiotyku np. 32- 16- 8- 4-2-1-0,5um/ml do każdej dodaje się jednakowe ilości standaryzowanej zawiesiny badanego drobnoustroju => stężenie drobnoustroju jest stałe natomiast zmienia się ilość = stężenie antybiotyku; próbka kontrolna nie zawiera antybiotyku
roztwory inkubuje się następnego dnia
- w próbówkach w których stężenie antybiotyku jest niższe niż stężenie hamujące bakterie rosną i zawiesina mętnieje
- w próbówkach w których stężenie antybiotyku jest równe lub większe od stężenia hamującego => bulion pozostaje przejrzysty
- najniższe stężenie antybiotyku , które hamuje wzrost bakterii = MIC
Ad.2 Metoda dyfuzji krążkowej na agarze z użyciem krążków bibułowych nasyconych chemioterapeutykami w stężeniach jakie osiągają w surowicy krwi
TECHNIKA:
hodowle wyizolowanej bakterii na bulionie (Mullera-Hiltona) wysiewa się na płytkę agarową i nakłada się na nią krążki bibułowe nasycone znanymi stężeniami odpowiednich antybiotyków
po odpowiednim czasie inkubacji ok. 24h umożliwiającym wzrost wysianych bakterii, wokół krążków z antybiotykiem widoczne są jasne obszary tzw. Strefy zahamowania wzrostu, w których wzrost został zahamowany przez antybiotyk dyfundujący z krązka do agaru; w miarę zwiększania się odległości od krążka stężenie antybiotyku maleje; w miarę tego spadku osiąga ono taką niska wartość ze nie hamuje już wzrostu bakterii=> określa się to mianem stężenia krytycznego= odpowiada ono zewnętrznej granicy strefy zahamowania
- im niższe MIC dla danego antybiotyku tym większa strefa zahamowania
- po zmierzeniu średnicy strefy zahamowania określa się czy dany szczep jest odporny na antybiotyk czy wrażliwy
test na obecność beta-laktamazy:
technika: hodowlę drobnoustrojów nakłada się na krążek nasycony barwną cefalosporyną= nitrocefina; jeżeli beta-laktamaza jest produkowana=> hydrolizuje nitrocefine i następuje zmiana barwy z białej na różowo-czerwoną.
Ogólne zasady skutecznego leczenia p/bakteryjnego
Cel: zmniejszenie powstawania szczepów odpornych
Obniżenie kosztów leczenia
Obniżenie wystąpienia działań toksycznych
Wyróżniamy: antybiotykoterapię empiryczna- wg polityki antybiotykowej - leki I rzuty bądź alternatywne, zależne od lokalizacji zakażenia, stanu pacjenta, oraz tego czy mamy do czynienia z zakażeniem szpitalnym czy też pozaszpitalnym itp.
Antybiotykoterapię celowaną - na podstawie badania bakteriologicznego i zgodnie z antybiogramem.
Odporność wrodzona= naturalna= pierwotna
Niewrażliwość pewnych bakterii na niektóre grupy antybiotyków jest ich stałą, wrodzona cechą; odporność ta zwykle odnosi się do pewnych cech strukturalnych np. jest determinowana przez geny chromosomalne np.
- wysoka naturalna odporność wszystkich szczepów pseudomonas aeruginosa= na liczne chemioterapeutyki: penicyliny… uwarunkowana złożoną budową ściany kom pałeczki ropy błękitnej ograniczająca penetrację leków p/bakteryjnych
- niska naturalna odporność enterokoków czyli paciorkowców kałowych na penicylinę i ampicylinę spowodowana niskim powinowactwem białek wiążących penicylina = PBP oraz na antybiotyki aminoglikozydowe.
Odporność nabyta - na antybiotyki oznacza pojawienie się szczepów opornych = nabywanie odporności przez niektóre szczepy bakterii za pomocą dwóch mechanizmów:
1)mutacji
2)przekazywania genów oporności między bakteriami, głównie przez plazmidy (koniugacja)
Ad.1 Odporność mutacyjna - wynika z mutacji chromosomalnej, która czyni bakterie niezdolną do interakcji z lekiem p/bakteryjnym
mutacja białek wiążących penicylinę = PBP (protein-binding-proteins tj. zmiana cząsteczki docelowej np. u dwoinki zapalenia płuc lub rzeżączki doprowadziły do odporności na penicylinę. Czy tez białek wiążących metycylinę u s. ureus: gen chromosomalny kodujący PBP.
Zmiany w podjednostce 30S rybosomy wywołana mutacja chromosomalna- wiąże się z wysokim stopniem oporności na amninglikozydy stwierdzaną pałeczek jelitowych gram -, oraz paciorkowców kałowych.
Mutacja białek porynowych, która może zaburzać transport antybiotyków do komórki bakteryjnej; ten typ mutacji przejawia się zwykle jako wielooporność : poryny to swoiste białka błony zew bakterii gram -; zapewniają drogę wejścia dla wielu hydrofilnych antybiotyków; mutacje zmieniają strukturę białek antybiotyków np. mechanizm oporności
Mutacja polimerazy DNA zależnej od DNA np. występuje w szczepach dwoinek zap. opn m-rdz.
Zmiana gyrazy DNA- jest odpowiedzialna a oporność pałeczek jelitowych gram -, w tym E. coli na chinoliny( na zakażenia dr moczowych)
Zmienione enzymy docelowe - wykrywane np. w szczepach wielu gatunków bakterii opornych na sulfonamidy lub trimetoprim
Ad.2 Nabywanie genów oporności najczęściej za pomocą plazmidów
Plazmidy oporności tzw. Plazmidy R- zawierają jeden lub więcej genów dominujących, które kodują syntezę enzymu inaktywującego lub modyfikującego leki p/bakteryjnych ; są zwykle przekazywane na drodze koniugacji.
enzymatyczna inaktywacja leków p/bakteryjnych- bakterie mogą wytwarzać swoiste enzymy, które inaktywują lub modyfikują leki (przed lub po jego przedostaniu się do komórki bakteryjnej)
beta laktamazy- hydrolizują (rozkładają) pierścień beta-laktamowy antybiotyków beta-laktamowych czyli penicylin i cefalosporyn
zmiany białek transportu błonowego (odpowiedzialne za transport przez błonę cytoplazmatyczną)- odpowiedzialne za oporność na tetracykliny u bakterii z rodziny Enterobakteriacae lub chinologów u E.coli na skutek zmniejszenia transportu antybiotyku do wnętrza komórki.
Aktywne usuwanie antybiotyku z komórki bakteryjnej - synteza nowych białek transportowych, które aktywnie usuwają antybiotyk np. aktywnie usuwają tetracyklin z komórek bakterii jelitowych Gram -;
Synteza enzymów mniej wrażliwych na leki hamujące-> tj. rozwój szlaków alternatywnych
Zmutowany enzym może ominąć blokadę spowodowana przez antybiotyk, wykorzystując inny szlak metaboliczny mp. Wankomycynooporne szczepy Enterococcus czyli paciorkowców kałowych lub oporność pałeczek jelitowych Gram-, na sulfonamidy lub oporność S.aureus na trimetoprim.
GRONKOWCE:
MRSA= methicillin - resistant S.aureus- szczepy gronkowca oporne na metycylinę (kładziemy krążek z Oksacyliną)
STREPTOCOCCUS PNEUMONIAE
PRP- szczepy dwoinki zapalenia płuc oporna na penicyliny; jest to genetycznie uwarunkowana oporność związana z PBP
PAŁECZKI GRAM( - )Z RODZINY ENTEROBACTERIACEAE
ESBL(+) - szczepy wytwarzające beta- laktamazę o poszerzonym profilu substratowym enzymu, która rozkłada wszystkie antybiotyki beta-laktamowe z wyjątkiem cefoksyny i karbapenemów.
Wyszukiwarka
Podobne podstrony:
w5 gram -, dietetyka, 1rok, 2 semestr, mikrobiologia, wykłady
Dział 4 - Układ pokarmowy, dietetyka, 1rok, 2 semestr, fizjologia, wykłady
Dział 5 - Fizjologia układu krążenia, dietetyka, 1rok, 2 semestr, fizjologia, wykłady
Dział 3 - Fizjologia układu oddechowego i wydalniczego, dietetyka, 1rok, 2 semestr, fizjologia, wykł
Dział 2 - Układ nerwowy, dietetyka, 1rok, 2 semestr, fizjologia, wykłady
Tableki do oceny jadłospisu, dietetyka, 1rok, 2 semestr, pracownia żywienia i dietetyki
harmonogram I semestr, dietetyka, 1rok, 1 semestr
harmonogram II semestr, dietetyka, 1rok, 2 semestr
pytania oczyszczanie wody egz (3), Politechnika Wrocławska, Ochrona Środowiska W7, Semestr V, SOW- w
ceramiczne-w7, studia, nano, 1rok, 2sem, nanomateriały ceramiczne, wykład
Podstawy bakteriologii 02 - konspekt, Licencjat, Semestr IV, mikrobiologia, Wykłady
Wykład Antybiotyki 02, Licencjat, Semestr IV, mikrobiologia, Wykłady
AIDS 02 - konspekt, Licencjat, Semestr IV, mikrobiologia, Wykłady
Pytania z mikrobiologii, Biotechnologia PWR, Semestr 5, Mikrobiologia Przemysłowa - Wyklad, Egzaminy
mikrobiologia cz.1, pwr, W7 wydział inżynierii środowiska, Pwr OŚ Ochrona Środowiska, Semestr 3, Mik
Tlenowe bakterie fototroficzne Sinice, pwr, W7 wydział inżynierii środowiska, Pwr OŚ Ochrona Środowi
Microbiologia i Paracytologia - opracowane pojecia z wykladow, Studia, Ratownictwo Medyczne, Semestr
Mikrobiologia wykłady, weterynaria 3 rok WROC, semestr 5, Mikrobiologia Wroc
Wykład VIII, Studia Biologia, Mikrobiologia, wykłady z ogólnej
więcej podobnych podstron